兔源肺炎克雷伯氏菌重组酶聚合酶扩增检测方法的建立
赵巧雅,马秀丽,刘存霞,史玉颖,胡 峰,王贵升,兰邹然,黄 兵
(1.山东省农业科学院家禽研究所,山东济南 250023;2.山东省动物疫病预防与控制中心,山东济南 250022)
肺炎克雷伯氏菌病是由肺炎克雷伯氏菌(Klebsiella pneumoniae)引起的,以肺炎和其他器官化脓性炎症为特征的人兽共患散发性疾病。青年兔、成年兔感染肺炎克雷伯氏菌后,以肺炎及其他器官化脓性病灶为主要病变特征,幼兔则以腹泻为特征。各种年龄、品种和性别的兔均对本菌易感,但以断奶前后仔兔以及妊娠母兔易感性最高,危害也最为严重[1],且不同种源的肺炎克雷伯氏菌具有种属特异性[2]。目前常用的肺炎克雷伯氏菌检测方法有生化鉴定、免疫学方法、分子生物学方法等。传统方法检测过程费时费力,且灵敏度较低,而常规PCR方法必须经过变性、退火、延伸3个步骤,需要特殊的基因扩增仪器,因此亟需建立一种快速、简便的检测肺炎克雷伯氏菌的方法。
重组酶聚合酶扩增技术(recombinase polymerase amplification assay,RPA)作为一种新型的快速检测技术,对仪器设备要求较低,在水浴锅、保温杯中即可进行反应,目前已被广泛应用到细菌、病毒、寄生虫等多个领域的检测[3-5]。phoE基因是肺炎克雷伯氏菌的核心基因,其保守区段可用于基因分型[6]。因此,本研究针对兔源肺炎克雷伯氏菌的phoE基因保守序列设计特异性引物,建立了适宜于快速准确检测兔源肺炎克雷伯氏菌的RPA方法,这为兔场生产中的肺炎克雷伯氏菌鉴定和检测提供了一个新方向。
1 材料与方法
1.1 试验菌株
用标准菌株以及本实验室保存菌株进行试验(表1)。

表1 试验用菌株
1.2 试剂
TwistAmp Basic试剂盒:购自北京强欣博瑞生物科技有限公司;DL 2 000 bp DNA Marker:购自 TaKaRa 公司;酵母粉、胰蛋白胨、琼脂粉等细菌培养基及其他试剂:购自生工生物工程(上海)股份有限公司。
1.3 引物设计
根据GenBank中已登录的兔源肺炎克雷伯氏菌phoE基因序列(CP025636.1)设计引物,目的片段277 bp。上游引物F:5'-TTCAACAGCGACGCAGGCAGC-3';下游引物R:5'-GCCGTAGTTCTTCAGCTTC-3'。引物由生工生物工程(上海)股份有限公司合成。
1.4 细菌培养
将表1所有菌株分别接种到4 mL LB培养液中,置于37 ℃恒温箱培养18 h。取纯培养菌液1 mL,备用。
1.5 RPA检测体系优化
以兔源肺炎克雷伯氏菌菌液为模板。RPA反应体系:上、下游引物(10 pmol/μL)各 2.4 μL,Rehydration Buffer 29.5 μL、菌液 1 μL、ddH2O 12.2 μL。漩涡混匀,离心;加入2.5 μL 280 mmol/L MgAc,混匀;放入40 ℃水浴锅内,分别反应10、20、30、40 min;取5 μL扩增产物用1%琼脂糖凝胶电泳分析。
1.6 特异性和灵敏度检验
根据建立的最佳反应时间,将表1中所列菌株的LB培养液作为模板进行RPA反应。取兔源肺炎克雷伯氏菌纯菌液1 mL做细菌计数,用PBS 10倍梯度稀释至10-8,用RPA进行检测,同时与常规PCR方法进行比较。
1.7 临床样本检测
采集55份有鼻炎症状的兔鼻腔拭子,加入1 mL生理盐水震荡后取上清作为模板,采用已建立的RPA方法进行检测,分别与传统细菌分离、常规PCR方法进行比较。
2 结果
2.1 反应时间优化
对RPA反应时间进行优化。优化结果显示,在277 bp处均有1条特异性条带。反应温度为40 ℃,反应30 min后,扩增效率无明显变化(图1),因此将最佳反应时间确定为30 min。
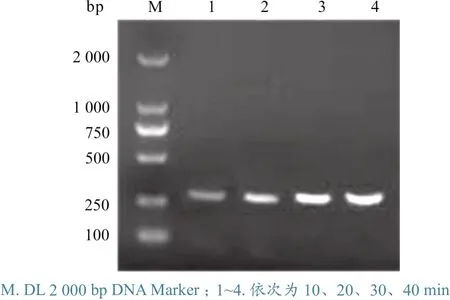
图1 RPA条件优化结果
2.2 特异性检验
试验结果显示,只有兔源肺炎克雷伯氏菌出现单一目的条带,巴氏杆菌、波氏杆菌、大肠杆菌、金黄色葡萄球菌、链球菌等均为阴性(图2)。
2.3 灵敏性检验
将肺炎克雷伯氏菌液稀释至8.3×101CFU/mL后,RPA方法仍能检出,而常规PCR方法的最低检出量为8.3×103CFU/mL(图3)。
2.4 临床样本检测
对55份样品进行肺炎克雷伯氏菌检测,发现RPA与PCR方法的检出率一致(表2),与细菌分离的阳性符合率均为91.67%。

表2 55份临床样本检测结果

图3 RPA与PCR的灵敏度比较
3 讨论
肺炎克雷伯氏菌是引起人畜食物中毒的重要感染源,可引起小儿腹泻甚至死亡,导致成人肺炎、肝脓肿、败血症、脑膜炎等[7-9]。动物感染可导致肺炎、子宫炎以及化脓性炎症等[10-11],危害广泛、严重。目前肺炎克雷伯氏菌的检测主要依靠传统检测方法和分子生物学方法[12-13]。传统方法费时费力,且灵敏度较低,而PCR方法较为快速,但需要昂贵的检测仪器,在现场快速检测方面存在一定的限制。
Cross priming amplification(CPA)或 Loopmediated isothermal amplification(LAMP)方法需要在反应中使用多对引物[14-15],引物设计要求较高,导致有些疾病的基因可能不适合使用此方法。RPA等温检测方法操作简单、反应快速,核心试剂以冻干颗粒形式保存,因而无需冷藏保存和冷链运输;且因反应时间短,可用于现场快速检测和诊断[4-6]。本研究建立的兔源肺炎克雷伯氏菌RPA等温检测法,反应10 min即可出现目的条带,30、40 min的产物没有明显差异。由于反应体系内的重组酶聚合酶活性随反应时间延长而降低或失活,因此本试验最终确认30 min为最佳反应时间。该方法的菌液最低检出量为8.3×101CFU/mL,比传统PCR高100倍。通常引起兔鼻炎或肺炎的细菌有巴氏杆菌、波氏杆菌、葡萄球菌、肺炎克雷伯氏菌、变形杆菌等。本研究结果显示,所建立的方法特异性强,仅能检测出兔源肺炎克雷伯氏菌,因而有利于上述细菌的鉴别诊断。有文献[16]报道,RPA的阳性检出率高于普通PCR。临床样品检测结果显示,本方法与细菌分离的阳性符合率达到91.67%。
4 结论
本研究建立的RPA检测方法特异性强,只有兔源肺炎克雷伯氏菌出现单一目的条带;灵敏性高,最低检出量为8.3×101CFU/mL,高出传统PCR 100倍,临床样品检测结果同PCR的符合率为100%;操作简单,不需要特殊的基因扩增设备。因此,本方法适用于基层实验室对兔肺炎克雷伯氏菌的快速检测,为生产中的兔源肺炎克雷伯氏菌现场快速检测提供了一种新方法。

