柳枝稷PvbZIP8基因的克隆与表达分析
王伟伟, 王勇锋, 张舒梦, 王竹林, 孙风丽, 张 超, 奚亚军
(西北农林科技大学农学院, 陕西 杨凌 712100)
转录因子(transcription factors,TFs)在植物响应逆境胁迫中具有重要的作用,它能够激活或者抑制下游基因的转录,使植物适应或抵御外界环境的变化[1]。近年来,AP2/ERE、NAC、MYB、WRKY和bZIP等转录因子在植物逆境响应中被广泛研究。其中,bZIP转录因子是真核生物转录因子中分布最广泛、最保守的转录因子之一,在人、动物、植物、微生物和昆虫中均有发现[2]。bZIP的家族命名来源于成员蛋白序列共有的保守bZIP结构域,其结构域大约有60~80个氨基酸残基,由一个碱性氨基酸区和一个亮氨酸拉链组成[3]。bZIP转录因子不仅参与调控植物的生长发育过程,还参与调控植物抵抗高盐、干旱和寒冷等恶劣的自然环境[4],比如bZIP家族中的ABI5蛋白是ABA抑制种子萌发和幼苗生长过程中的重要信号组分,受ABA、干旱和高盐胁迫诱导表达,能提高植物对外源ABA的敏感性,在干旱条件下参与靶基因的转录调控[5]。S亚家族在拟南芥中是最大的bZIP亚家族,其中AtbZIP11/ATB2在高碳水化合物组织和维管束中被光上调表达,并且参与蔗糖转录后抑制调控[6];AtbZIP1,AtbZIP2,AtbZIP44和AtbZIP53可能参与平衡碳水化合物的需求和供应[7]。同时,单子叶植物和双子叶植物的数据表明bZIP转录因子S亚家族同源蛋白在胁迫处理后被转录激活[8]。在水稻中发现,S亚家族成员OsbZIP16参与ABA信号传导途径,过表达转基因植株表现出显著的抗旱性[9];OsbZIP71在ABA介导的干旱和盐耐受性中发挥重要作用[10]。
柳枝稷(PanicumvirgatumL.)属于禾本科(Gramineae)黍属(Panicum),是一种多年生C4高大草本植物,具有适应性强、生长速度快、生物量潜力大、对环境友好等多种优点[11-12]。作为不与粮争地的模式能源植物,柳枝稷通常被种植在边际土地[13],因此往往遭受着干旱、洪涝、盐渍、贫瘠等多种非生物逆境胁迫,显著影响植物的生长发育。目前,关于柳枝稷基因功能鉴定方面的研究较少,寻找响应抗逆性相关的基因对柳枝稷的生长发育具有重要意义[14-16]。本研究通过对水稻OsbZIP16基因进行同源克隆获得柳枝稷PvbZIP8基因,随后对PvbZIP8基因进行了相关的生物信息学分析、非生物胁迫下的表达模式分析以及组织特异性表达分析,以期为柳枝稷的抗逆生物学研究提供基础。
1 材料与方法
1.1 实验材料
柳枝稷材料为四倍体低地型‘Alamo’品种,由西北农林科技大学小麦柳枝稷遗传改良研究团队提供。
1.2 实验方法
1.2.1 材料培养与处理 将柳枝稷种子置于培养皿中发芽,7 d后转移柳枝稷幼苗到水培培养液中,置于16 h光照/28℃和8 h黑暗/20℃的培养箱中生长。生长36 d后取长势一致的柳枝稷用于不同的非生物胁迫处理。
试验进行的胁迫处理包括盐、干旱、高温和低温胁迫,分别将柳枝稷置于20%的PEG6000,250 mM的NaCl,16 h光照38℃/8 h黑暗30℃和低温4℃下,之后在不同的时间点(0,2,6和12 h)取样,以0 h处理的样品为对照,每个处理选取10株柳枝稷的叶片组织,混合后用锡纸包裹,迅速放入液氮中冷冻,之后用自封袋包裹放入—80℃超低温冰箱中保存。
用于组织特异性表达分析的柳枝稷材料取自于西北农林科技大学试验地(108°4′26″ E,34°17′49″ N),取材日期是2018年5-10月,选取的组织或器官分别为营养生长时期的根、茎、叶、节和叶鞘以及生殖生长时期的小穗和种子[17],材料保存在-80℃超低温冰箱中备用。
1.2.2 柳枝稷总RNA的提取和cDNA的合成 利用TRIZOL法提取植物组织的总RNA,利用反转录试剂盒PrimeScriptTMRT reagent Kit with gDNA Eraser(Takara,Dalian,China)进行cDNA的合成。
1.2.3PvbZIP8基因的克隆 通过JGI数据库(https://phytozome.jgi.doe.gov/pz/portal.html#)获取柳枝稷PvbZIP8基因的序列[18],利用Primer 6软件设计上游引物(5′- AACCACTGCTTGTTTCCTTCTAC-3′)和下游引物(5′- CGATTGTGCCGATTCATATTAGTTG-3′),以柳枝稷cDNA为模板,进行PCR扩增,扩增体系为:稀释后的cDNA 3 μl,2 × Phanta Max Buffer 25 μl,10 mM的dNTP Mix 1 μl,10 μM的上下游引物各1 μl,Phanta Max Super-Fidelity DNA Polymerase 1 μl,ddH2O 18 μl。扩增程序为:95℃预变性3 min,95℃变性15 s,55℃退火15 s,72℃延伸40 s,共进行34个循环,最后72℃彻底延伸5 min,4℃保存。用1%的琼脂糖凝胶电泳分离PCR产物,用DNA纯化回收试剂盒回收目的片段,回收产物平末端加A后连接到PMD18-T克隆载体,重组质粒转化大肠杆菌DH5α,利用通用引物M13进行菌落PCR验证,并将阳性克隆进行测序鉴定。
1.2.4 序列生物信息学分析 利用ORF Finder (https://www.ncbi.nlm.nih.gov/orffinder/)查找目的基因的开放阅读框,ProtParam (https://web.expasy.org/protparam/)分析相应蛋白的理化性质[19],SOPMA (http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)分析该蛋白的二级结构[20],TMHMM2.0 Server (http://www.cbs.dtu.dk/services/TMHMM/)分析该蛋白的跨膜结构域[21],利用SignalP (http://www.cbs.dtu.dk/services/SignalP/)预测该蛋白是否含有信号肽位点[22],ProtScale (https://web.expasy.org/protscale/)对该蛋白的进行疏水性分析[19],Psort Prediction (https://www.psort.org/)预测该蛋白的亚细胞定位[23],NCBI-CDD (https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)分析该蛋白的保守结构域[24],利用NCBI-Blastp (https://blast.ncbi.nlm.nih.gov/Blast.cgi)搜索目的蛋白的同源序列,之后在Clustalx2.1软件中进行多序列比对并利用MEGA5.05软件构建系统发育树(Neighbor-joining tree,bootstrap设定初始值为1000次)[25,26],最后运用MEME (http://meme-suite.org/tools/meme) 在线程序对PvbZIP8基因进行保守MOTIF分析[27]。
1.2.5 基因表达模式分析 分别以柳枝稷的根、茎、叶、节、叶鞘、小穗、种子和盐、干旱、高温、低温胁迫处理后的叶片cDNA为模板,本试验设计三个生物学重复。根据目的基因测序序列的保守区设计荧光定量PCR引物,上游引物和下游引物分别是F(5′-CTGGGACAGCAGACAAGCAAGAG-3′)和R(5′- CCACTTCCATCTCATTGAGCCTT-3′)。选择Elongation Factor 1-α作为内参基因[28],其引物序列分别是PvEF-1-alphaF(5′-CCAAGAGGCCTTCAGACAAG -3′)和PvEF-1-alphaR(5′- TGAGATCCTTCACAGCAACG-3′)。之后通过QuantStudio 5定量PCR仪(Thermo Fisher,MA,USA)使用TB GreenTMPremix Ex TaqTMII(Takara,Dalian,China)试剂进行qRT-PCR反应。反应体系按照说明书进行(Takara,Dalian,China),反应程序按以下步骤进行:95℃下10 min;95℃下5 s,60℃下31 s,共进行40个循环。反应结束后通过2-ΔΔCT法计算基因的相对表达量[29],分别检测目的基因在柳枝稷不同组织或器官及不同胁迫处理下的表达情况,并通过IBM SPSS Statistics 22.0进行显著性分析(P<0.05),随后利用Microsoft Excel绘制柱状图。
2 结果与分析
2.1 PvbZIP8基因克隆和保守结构域分析
通过柳枝稷基因组数据库获得PvbZIP8的cDNA基因序列,随后设计此基因的特异性扩增引物,经PCR扩增获得650 bp的特异性目的条带(图1),测序分析后确认该序列为柳枝稷PvbZIP8基因,其含有468 bp开放阅读框,编码155个氨基酸(图2)。通过NCBI-CDD网站分析此基因具有完整的bZIP结构域(图3),属于bZIP转录因子家族成员。通过NCBI-blastp比对发现此基因与哈氏黍bZIP8蛋白序列相似度达91%,故将其命名为PvbZIP8。

图1 柳枝稷PvbZIP8基因PCR扩增产物Fig.1 PCR amplification products of switchgrass PvbZIP8注:M.DL2000;1. PvbZIP8扩增片段Note:M.DL2000;1. products of PvbZIP8
2.2 PvbZIP8蛋白理化性质分析
利用ProtParam在线程序对PvbZIP8的蛋白质序列进行理化性质分析,分析结果表明,PvbZIP8基因翻译的蛋白质分子量为17.81 kDa,分子式是C761H1248N24O23S8,等电点是9.15。蛋白中含量较高的包括12.3%的亮氨酸、11.6%的精氨酸、8.4%的丝氨酸和8.4%的丙氨酸;Asp + Glu为21,Arg + Lys为25,属于碱性蛋白质,不稳定系数是61.96,属于不稳定蛋白,总平均亲水性GRAVY值是-0.669,为亲水性蛋白。
此外,二级结构预测显示该蛋白主要包括α螺旋(Alpha helix,67.10%)、无规则卷曲(Random coil,25.81%)、延伸链(Extended strand,4.52%)和β转角(Beta turn,2.58%)(图4)。对柳枝稷PvbZIP8蛋白跨膜结构和信号肽进行预测分析发现,PvbZIP8不包含跨膜蛋白和信号肽位点;亚细胞定位预测显示PvbZIP8蛋白主要定位于细胞核内;利用ProtScale对柳枝稷PvbZIP8蛋白进行疏水性分析发现,该蛋白碱性氨基酸区具有亲水性,亮氨酸拉链区具有疏水性。

图2 PvbZIP8基因ORF序列及氨基酸序列Fig.2 ORF sequence and amino acid sequence of PvbZIP8

图3 PvbZIP8蛋白的功能结构域Fig.3 The conserved domain of the PvbZIP8 protein

图4 PvbZIP8蛋白的二级结构Fig.4 Predicted secondary structure for PvbZIP8 protein
2.3 PvbZIP8同源比较和系统进化分析
利用NCBI-blastp程序分析柳枝稷PvbZIP8基因与其它近源物种的蛋白同源性。结果表明,PvbZIP8蛋白的氨基酸序列与哈氏黍(Panicumhallii,XP_025825344.1)、谷子(Setariaitalica,XP_014660928.1)、玉米(Zeamays,XP_008645357.1)、糜子(Panicummiliaceum,RLM79681.1)和高粱(Sorghumbicolor,XP_002453452.1) 的相似性分别为91%、89%、68%、67%和65%。根据多序列比对分析(图5),柳枝稷PvbZIP8蛋白与其它物种有相似的结构特征,都含有保守的bZIP(碱性亮氨酸拉链)结构域,由一个碱性氨基酸区和一个亮氨酸拉链组成。利用MEGA5.05对同源性较高的物种构建系统进化树(图6),发现柳枝稷PvbZIP8与哈氏黍亲缘关系最近,其次是谷子和糜子;随后通过MEME程序对这些物种中的同源序列进行模体分析,结果表明这些蛋白都含有保守的Motif 1和Motif 6,均位于bZIP保守结构域(图6)。

图5 PvbZIP8蛋白与其它物种同源序列的多重比对Fig.5 Multiple alignment of PvbZIP8 protein with homologous sequences of other species
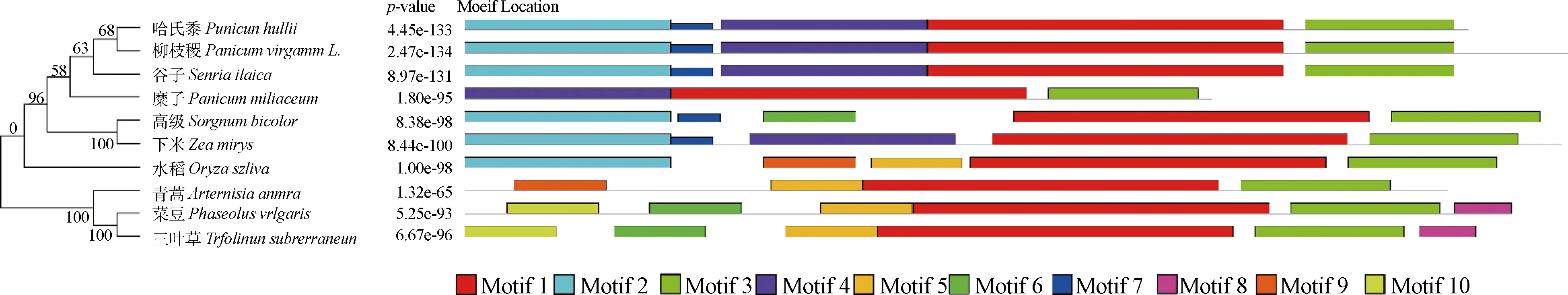
图6 PvbZIP8与其它物种同源序列的系统进化树及蛋白保守结构域Fig.6 Phylogenetic tree and protein conserved domain of PvbZIP8 homologous sequences among species注(note):哈氏黍,Panicum hallii (XP_025825344.1);谷子,Setaria italica (XP_014660928.1);糜子,Panicum miliaceum (RLM79681.1);高粱,Sorghum bicolor (XP_002453452.1);玉米,Zea mays (XP_008645357.1);水稻,Oryza sativa (EAY84825.1);青蒿,Artemisia annua (PWA89386.1);菜豆,Phaseolus vulgaris (XP_007157937.1);三叶草,Trifolium subterraneum (GAU21676.1)
2.4 PvbZIP8基因在非生物胁迫下的表达模式分析
在盐、干旱、高温和低温胁迫下,柳枝稷PvbZIP8基因表达量发生明显变化(图7)。其中在盐、高温和低温胁迫处理6 h,PvbZIP8的表达量上升到最大值,分别是对照组的37,58和8倍,随后表达量在12 h开始下降;在干旱胁迫处理2 h后,PvbZIP8被迅速诱导达到最大值,达到对照组的8倍。

图7 PvbZIP8在多种非生物胁迫下的表达量分析Fig.7 Analysis of the expression level of PvbZIP8 under various abiotic stresses
2.5 PvbZIP8基因在不同组织或器官下的表达模式分析
利用qRT-PCR技术,对柳枝稷根、茎、叶、节、叶鞘、小穗和种子的表达水平进行定量分析,结果表明PvbZIP8基因在多个组织或器官中均有表达,其中在根、茎和叶中表达量较高,在节、叶鞘、小穗和种子中表达量较低,在叶片中表达量最高,约是表达量最低的节中的4倍(图8)。
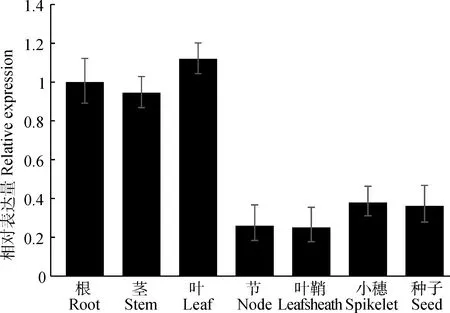
图8 PvbZIP8在不同组织或器官的表达量分析Fig.8 Analysis of the expression of PvbZIP8 in different tissues or organs
3 结论与讨论
bZIP转录因子是最大、保守性最高的转录因子家族之一,bZIP蛋白由碱性氨基酸区和亮氨酸拉链区组成,碱性氨基酸区包含与特异的DNA序列发生作用的核定位信号和DNA结合结构域,亮氨酸拉链区是由多个重复七肽组成。bZIP转录因子家族已经在拟南芥[30]、水稻[31]、玉米[32]、高粱[33]和大豆[34]等多个物种中进行了详细的鉴定和分析,前期研究中表明,bZIP转录因子家族参与植物生长、种子成熟和非生物胁迫等多种生物学进程[30]。基于bZIP家转录因子在植物抗逆过程中的重要性,本研究通过克隆得到柳枝稷PvbZIP8基因,并对其进行相关的生物信息学分析和基因表达分析。研究结果表明,柳枝稷PvbZIP8基因编码155个氨基酸,属于碱性亲水性蛋白质,不包含跨膜蛋白和信号肽位点。该基因预测定位在细胞核内,这与水稻中同源基因OsbZIP16结果相同[9],可能具有反式激活活性。柳枝稷PvbZIP8基因与近源单子叶植物哈氏黍、谷子和糜子的同源序列相似度分别达到了91%,89%和91%,表明该基因在进化过程中具有较高的保守型,并且具有典型的碱性氨基酸区N-X7-R/K和亮氨酸拉链区,属于bZIP转录因子家族成员之一。
系统进化分析表明,柳枝稷PvbZIP8与哈氏黍亲缘关系最近,其次是谷子和糜子;在线程序MEME结果显示哈氏黍、谷子和糜子具有相同的保守结构域,二者之间相互印证,进一步说明PvbZIP8在进化过程中的保守型,以此推测该基因在植物中发挥重要的功能。在水稻中bZIP转录因子家族被分成10个亚家族,不同的亚家族具有不同的结构和功能特点,A亚家族中的基因大多数响应ABA信号途径[31]。通过与水稻bZIP家族基因进行同源比对,柳枝稷PvbZIP8基因被定位在S亚家族,S亚家族被认为与干旱、冷和伤害等非生物胁迫相关。例如水稻OsbZIP16在可以正向调控水稻的抗旱性,在干旱情况下OsbZIP16的表达量被显著诱导,过表达OsbZIP16的转基因水稻植株表现出显著的抗旱性[9]。本实验通过qPCR发现,柳枝稷PvbZIP8响应盐、干旱、高温和低温等多种非生物胁迫,在不同处理时间PvbZIP8基因转录水平发生明显上调,表明该基因在柳枝稷中响应多种非生物胁迫,对柳枝稷的抗逆耐受性具有重要意义,并且该基因在抗旱性中的表现与水稻OsbZIP16基因相一致。在组织特异性表达分析发现,柳枝稷PvbZIP8基因在根、茎和叶中表达水平明显高于其在种子、小穗、叶鞘和节中的表达,并且在叶片中表达水平最高,暗示该基因在营养生长阶段发挥相对重要的作用,具有明显的时空特异性表达特点。
目前,关于柳枝稷基因功能鉴定在bZIP家族中尚未报道,本研究通过对PvbZIP8转录因子进行克隆和表达分析,初步确定该基因在非生物胁迫中发挥重要作用,将为进一步研究柳枝稷PvbZIP8基因的生物学功能奠定基础,并为柳枝稷中其它基因的研究提供重要参考意义。
——现代牙刷的由来

