外源腐胺与亚精胺提高假俭草低温胁迫耐受性的研究
刘南清, 林绍艳, 沈益新
(1.南京农业大学草业学院, 江苏 南京 210095; 2. 江苏农林职业技术学院,江苏 句容 212400; 3. 南京农业大学作物遗传与种质创新国家重点实验室, 江苏 南京 210095)
假俭草(Eremochloaophiuroides(Munro.) Hack.)起源于我国热带与亚热带地区,因其耐酸性土壤、耐粗放管理,以及养护成本低、成坪质量好等优点,在世界各地广泛应用。然而,假俭草耐寒性差,在我国长江中下游地区冬季低温条件下会出现枯黄休眠的现象,极大地影响了其景观应用价值,及在该区域的推广应用。因此,研究假俭草的耐寒机制,探索改善假俭草耐寒性的管理技术,已成为当前草坪草研究中的一个重要课题。
诸多的研究表明,低温胁迫发生时,植物细胞内正常的氧代谢受到干扰,活性氧自由基产生率上升;从而产生过氧化作用,造成细胞膜系统的损伤或瓦解[1]。此外,植物体内的酶活性对低温胁迫具有很强的敏感性。低温胁迫下,酶活性的降低会导致植物光合效率的降低[2]。但与此同时,当低温胁迫发生时,植物细胞内会同时出现抗氧化酶防御系统以及其他抗氧化物质,这些抗氧化酶防御系统与抗氧化物质能消除活性氧积累,防止膜脂过氧化,从而保护植物免受低温伤害。植物抗氧化酶防御系统与抗氧化物质主要包括抗氧化物酶与一些小分子渗透调节物质。抗氧化酶主要包括超氧化物歧化酶(Super oxidase dismutase,SOD)、过氧化氨酶(Catalase,CAT)、过氧化物酶(Peroxidase,POD)、抗坏血酸过氧化物酶(Asorbate peroxidase,APX)和谷胱甘肽还原酶(Glutathione reductase,GR)等[3-4]。而小分子渗透调节物质主要包括有机渗透调节物质与无机离子渗透调节物质,其中有机渗透调节物质主要包括植物细胞内的可溶性多糖(Soluble sugar,SS)、脯氨酸(Proline,Pro)以及一些游离态多胺(Polyamines,PAs)。大量的研究表明,植物的耐寒性与体内的抗氧化酶活性以及渗透调节物质含量有直接的正相关关系,对有些植物进行外源喷施适当浓度的渗透调节物质可以提高低温胁迫下植物体内的抗氧化酶活性以及渗透调节物质的浓度,从而提高植物的耐寒性[5-8]。尽管国内外已经对假俭草耐寒机理进行了较多的研究,然而,通过施用外源多胺以提高假俭草耐寒性的研究却鲜见报道。在低温胁迫下,施用外源多胺对假俭草体内的细胞膜系统、抗氧化酶活性及渗透调节物质含量等方面的影响尚不明确。
本研究以适当浓度的外源腐胺(Putrescine,Put)与亚精胺(Spermidine,Spd)对假俭草进行叶面喷施,旨在明确低温胁迫条件下,施用外源多胺对假俭草叶片细胞的膜系统、抗氧化酶活性以及渗透调节物质积累的影响,以期探索出能提高假俭草耐寒性的有效化学调控途径,为假俭草在长江流域以北区域推广和应用提供技术支持。
1 材料和方法
1.1 试验材料
供试材料为2008年采集于广东信宜的野生假俭草材料,该材料表现出明显的低温敏感特性。自2008年8月始,供试材料一直种植于试验地种质资源圃,正常水肥管理,生长良好。
2015年8月采集其健康的匍匐茎,并切成4~5 cm长的茎段,每段带4~5个茎节,每小段留叶2片,扦插于塑料培养盆中(直径10 cm,高8 cm),盆内为等量的混合培养基质(泥炭土∶珍珠岩=3∶1),每盆扦插假俭草茎段12段。遮阳网覆盖,放置于玻璃大棚内栽培,浇水保湿。当假俭草茎段长出新叶成活时,揭开遮阳网,每隔5天浇水1次,每周每盆施用1/2浓度霍格兰氏营养液25 ml,每周修剪一次,修剪高度为8 cm,使假俭草生长均匀一致。
1.2 试验方法
2015年9月02日,将盆栽的假俭草试验材料从大棚移植至人工气候模拟箱中进行适应性栽培,人工气候模拟箱的光照(1 000 lx,日照时间14 h),昼夜温度设置为30℃/20℃,相对湿度80±5%,不进行低温处理的对照组CK在试验过程中一直保持在该生长条件下生长。
两周后分别使用浓度为0.1 mM的腐胺(Put)、亚精胺(Spd)溶液或去离子水对假俭草进行叶面喷施处理,每周喷施1次,连续喷施3周。每个喷施处理3个重复。每次喷施时,均匀喷施叶面,喷施至叶片由少量液滴滴落为止。
10月7日,进行低温处理,温度为8℃,每天光照时间、光照强度和相对湿度不变。低温处理35 d。低温处理期间,每5天浇水1次,定期调换材料的位置。分别于低温处理的第7,14,21,28,35 d,选取长势一致完全展开的倒二叶(茎尖往下第二叶)进行分析测定。
1.3 指标测定
1.3.1 相对电导率(Electrolyte leakage,EL)测定 采用相对电导率测定方法[9]。取样后,将叶片用去离子水冲洗3次,并用洁净滤纸吸干表面水分。叶片剪成0.5 cm的小片段,准确称取0.5 g,装入具塞试管。加25 ml去离子水,真空抽气10 min,振荡,加塞,在室温下静置l h。3次重复。用电导率仪测得电导率值E1。沸水浴10 min,冷却后测得电导率值E2。3次重复。相对电导率(EL)=E1/E2×100%。
1.3.2 丙二醛(Malondialdehyde,MDA)含量测定 MDA含量采用硫代巴比妥酸法测定[10]。剪取叶片鲜样0.5~1.0 g,在-80℃的液氮冷冻。解冻后,加7 mL磷酸盐缓冲液(浓度为50 mM,pH 7.0),冰浴中研磨。提取液放置于4℃与20 000 g下离心25 min。所得的上清液与三氯乙酸和硫代巴比妥酸充分反应后,用分光光度计(Spectronic Instruments,New York)在532 nm与600 nm波长下测定吸光值。使用Dhindsa的计算公式[11]计算出MDA的含量。
1.3.3 抗氧化物酶活性测定 SOD活性测定采用硝基蓝四氮唑(NBT)光还原法进行[12]。CAT、APX和POD活性的测定参考汤绍虎编写的植物生理学实验教程的方法[13]。酶活性的测定采用分光光度计进行。CAT在240 nm下测定,APX在290 nm下测定,POD在470 nm下测定。
1.3.4 SS含量测定 SS含量采用蒽酮比色法测定[14]。剪取约1.0 g的假俭草鲜叶,加入液氮研磨成粉末,然后加入1 ml的提取液,再加入1 ml的苯酚,充分震荡混合,最后加入5 ml的浓硫酸(95%),把混合反应液放入水浴锅中,在30℃水温下水浴30 min后,取出反应液冷却15 min。用分光光度计(Spectronic Instruments,New York,NY)在490 nm波长下测定反应液的吸光值。用葡萄糖制作标准校准曲线,根据标准曲线分别计算出葡萄糖(G)、蔗糖(S)与果糖(F)的含量,进而计算出可溶性多糖(SS)的含量。
1.3.5 Pro含量测定 Pro含量采用茚三酮法进行测定[15]。剪取叶片鲜样约300 mg,放入研钵中。加入液氮。将鲜样研磨成粉末,然后加入5 ml磺基水杨酸进行萃取。将萃取液移到试管中。先后加入2 ml乙酸和2 ml茚三酮进行显色反应。将试管放置在水浴锅中沸水浴45 min,取出冷却。最后往冷却的反应液中加入4 ml的甲苯完成显色反应。将上层显色液在分光光度计520 nm波长测定吸光度。使用L-脯氨酸制作标准曲线作为比色所用的校准曲线。
1.3.6 PAs含量测定 根据刘俊等[16]测定多胺的方法进行Put,Spd和Spm含量的测定。取0.1 g左右研磨好的叶片干样粉末,放入离心管中。加入2 ml冷却后的高氯酸进行多胺的提取。冰浴60 min,然后在15 000 g下离心30 min。将上清液转入离心管中,冷冻保存在—20℃的低温冰箱。在碱性介质中对上清液中的多胺进行苯甲酰化反应,然后使用二乙醚提取多胺衍生物。将醚相干燥后,用甲醇进行溶解。
使用高效液相色谱仪(HPLC,美国Waltham公司)测定游离态多胺(PAs)的含量。色谱柱为Diamonsil C18(250 mm×4.6 mm×5 μm)。柱温30℃。流动相为甲醇和水(体积比为70∶30),流速0.7 mL·min-1。检测波长为230 nm。进样量10 μL,间隔35 min。标准曲线为Put,Spd和Spm标样曲线。
1.4 数据处理与分析
采用SAS软件(SAS 9.0版)对低温胁迫期间各个不同外源物质喷施处理下假俭草体内的渗透调节物含量以及抗氧化酶活性等进行方差分析。用Fisher检验法确定各不同处理间渗透调节物含量与抗氧化酶活性差异的显著性,P值为0.05水平。
2 结果和分析
2.1 对细胞膜系统透性与丙二醛含量的影响
试验过程中,未进行低温胁迫处理的对照组(CK),其叶片内EL的变化不明显,一直保持在9.22%~10.91%的低水平。低温胁迫处理组内,在低温胁迫进行的第7天开始,不同处理的假俭草其叶片内的EL值快速持续升高,各不同处理间差异明显。在整个试验过程中,各处理的EL值大小依次为:C >C+Put>C+Spd(图1)(其中:C代表低温胁迫+纯水喷施处理;C+Put代表低温胁迫+0.1 mM Put喷施处理;C+Spd表示低温胁迫+0.1 mM Spd喷施处理)。

图1 低温胁迫期间叶片相对电导率的变化Fig.1 Leaf electrolyte leakage changed during chilling stress注:CK=未进行低温胁迫处理的对照组;C =低温胁迫+纯水喷施处理;C+Put=低温胁迫+0.1 mM Put喷施处理;C+ Spd =低温胁迫+0.1 mM Spd喷施处理,下同Note:CK=No cold stress;C=Cold stress+H2O;C+Put= Cold stress +0.1 mM Put;C+Spd= Cold stress +0.1 mM Spd,the same as below
低温胁迫过程中,MDA的变化与EL的变化趋势基本一致。未进行低温胁迫处理的对照组在试验中一直保持较低的MDA含量,且没有明显变化。低温处理组在低温胁迫进行的第7 d后,其叶片内的MDA含量快速持续升高,MDA含量在不同的处理间存在明显差异。低温胁迫过程中,不同处理的假俭草叶片内MDA含量由高至低依次为:C >C+Put>C+Spd(图2)。
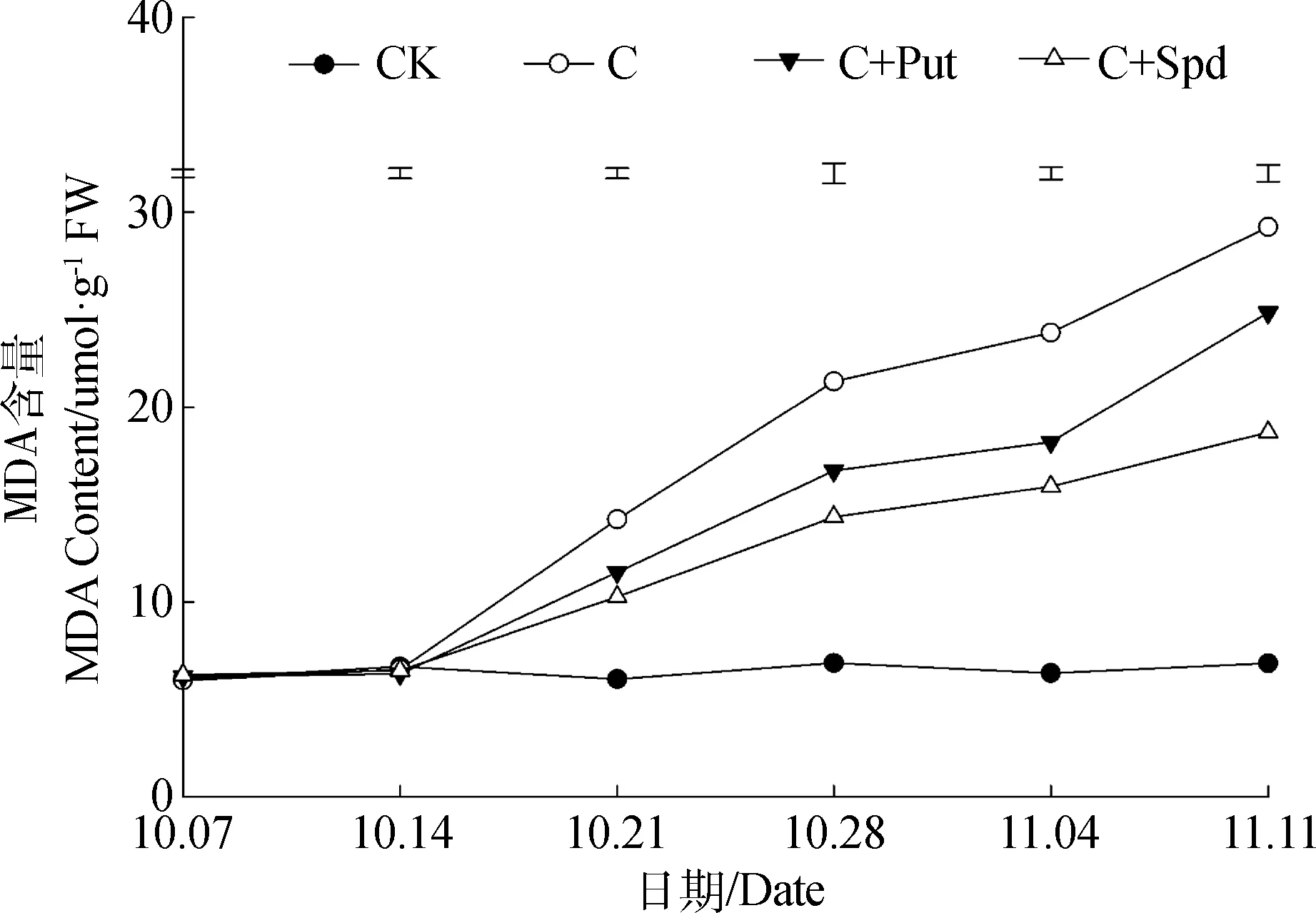
图2 低温胁迫期间叶片MDA含量的变化Fig.2 Leaf MDA content change during chilling stress
2.2 对抗氧化物酶活性的影响
由表1可知,在低温胁迫期间,假俭草叶片内的SOD、POD、APX与CAT的活性都出现了明显的变化,且在不同的低温胁迫时间下因不同的处理表现出明显差异。
2.2.1 SOD活性 低温胁迫下,SOD的活性先出现快速升高,在胁迫的第7 d(10月14日)达到最高,之后开始持续下降,这反应了SOD对环境变化的敏感性。分析结果同时表明,在低温胁迫发生的10月14日-11月11日期间,喷施过Spd与Put的处理其叶片内SOD活性显著高于只喷施去离子水的处理(P<0.05)。具体表现为:处理C+Spd比C高出15.3%~33.0%;处理C+Put比C+H2O高出3.4%~27.9%。除了11月4日,在低温胁迫的其他时期内,处理C+Spd比处理C+Put都具有更高的SOD活性。
2.2.2 POD活性 低温胁迫使得假俭草叶片内的POD活性同样表现出先升后降的趋势。低温胁迫过程中,C+Spd叶片内的POD活性都高于C,差异显著(P<0.05);C+Put在低温胁迫整个过程中其叶片内的POD活性同样都高于C+H2O,但是仅在低温胁迫的第7-21 d(10月14-10月28日)表现出显著差异(P<0.05),在低温胁迫的第28-35 d(11月4-11日),则差异不显著。
2.2.3 APX活性 对APX活性的分析表明,低温胁迫发生后的第7 d(10月14日),各处理假俭草叶片内的APX活性升到最高,随后持续下降。低温胁迫过程中,处理C+Spd与C+Put叶片内的APX活性都高于处理C,且在第7-28 d(10月14日-11月4日)表现出显著差异(P<0.05)。此外,处理C+Spd叶片内的APX活性一直高于处理C+Put,且在第14-28 d(10月21日-11月4日)表现出显著差异(P<0.05)。
2.2.4 CAT活性 低温胁迫下,各处理间假俭草叶片内的CAT活性表现出“升-降-升-降”的波浪形趋势,在低温胁迫发生的第7 d(10月14日)达到最高后,开始持续下降,在11月4日又略有回升,然后在11月11日急剧下降至最低。在所有低温胁迫期间内,不同处理间的CAT活性由高至低依次为:C+Spd>C+Put> C+H2O。其中在低温胁迫的第7-28 d,各处理间差异显著(P<0.05)。在低温胁迫发生的第35 d(11月11日),各处理叶片内的CAT活性降至最低,处理C+Spd叶片内的CAT活性仍然显著高于C+H2O;C+Put叶片内的CAT活性虽然高于C,但是差异不显著。
2.3 对渗透调节物质含量的影响
2.3.1 SS含量 低温胁迫发生后,假俭草叶片内的SS含量先是急剧增加,在低温胁迫的第7 d达到最高,随后其含量持续降低,至低温胁迫结束的第35 d降至最低(图3)。整个低温胁迫期间,各处理叶片内的SS含量由高到低排序为:C+Spd> C+Put> C。不同处理之间存在显著差异(图3)。

图3 外源多胺对低温胁迫下假俭草叶片内可溶性糖含量的影响Fig.3 Effects of exogenous polyamine on soluble sugar content in the leaves of centipede grass under chilling stress注:小写字母表示在相同处理时间内4个处理间的显著性差异(P<0.05),下同Note:Different lowercase letters indicate significant difference within the same treatment time among different treatment at the 0.05 level,the same as below

表1 外源多胺对低温胁迫下假俭草叶片内酶活性的影响Table 1 Effect of exogenous polyamines on antioxidase activities of centipede grass under chilling stress
注:小写字母表示同一行(同一处理的不同时间)在0.05水平上显著,大写字母表示同一列(同一时间的不同处理)在0.01水平上显著
Note:Different lowercase letters indicate significant difference within the same row (the same treatment among different treatment time) at the 0.05 level,and different capital letters indicate significant difference within the same column (the same treatment time among different treatments) at the 0.01 level
2.3.2 Pro含量 随着低温胁迫时间的持续,假俭草各处理叶片内的Pro含量(图4)呈先升后降的变化趋势。低温胁迫的第7 d,各处理叶片内的Pro含量达到最高,之后开始逐渐降低,至低温胁迫的第35 d降至最低。
在低温胁迫期间的7-35 d内,C+Spd叶片内的Pro含量高于C+Put与喷水对照C,差异明显,其中在低温胁迫的第7 d,分别高出10.7%与13.8%。在低温胁迫的7-28 d,C+Put叶片内的Pro含量明显高于喷水对照C,在试验结束的第35 d,二者间叶片内的Pro含量差异不明显。

图4 外源多胺对低温胁迫下假俭草叶片内脯氨酸含量的影响Fig.4 Effects of exogenous polyamine on proline content in the leaves of centipede grass under chilling stress
2.3.3 PAs含量 1) Put含量,低温胁迫的前7 d,各处理的假俭草其叶片内的Put含量快速升高,之后随着低温胁迫的持续,Put的含量开始降低(图5)。在低温胁迫发生的第7-21 d内,处理C+Spd与C+Put叶片内的Put含量显著高于C与对照组CK。
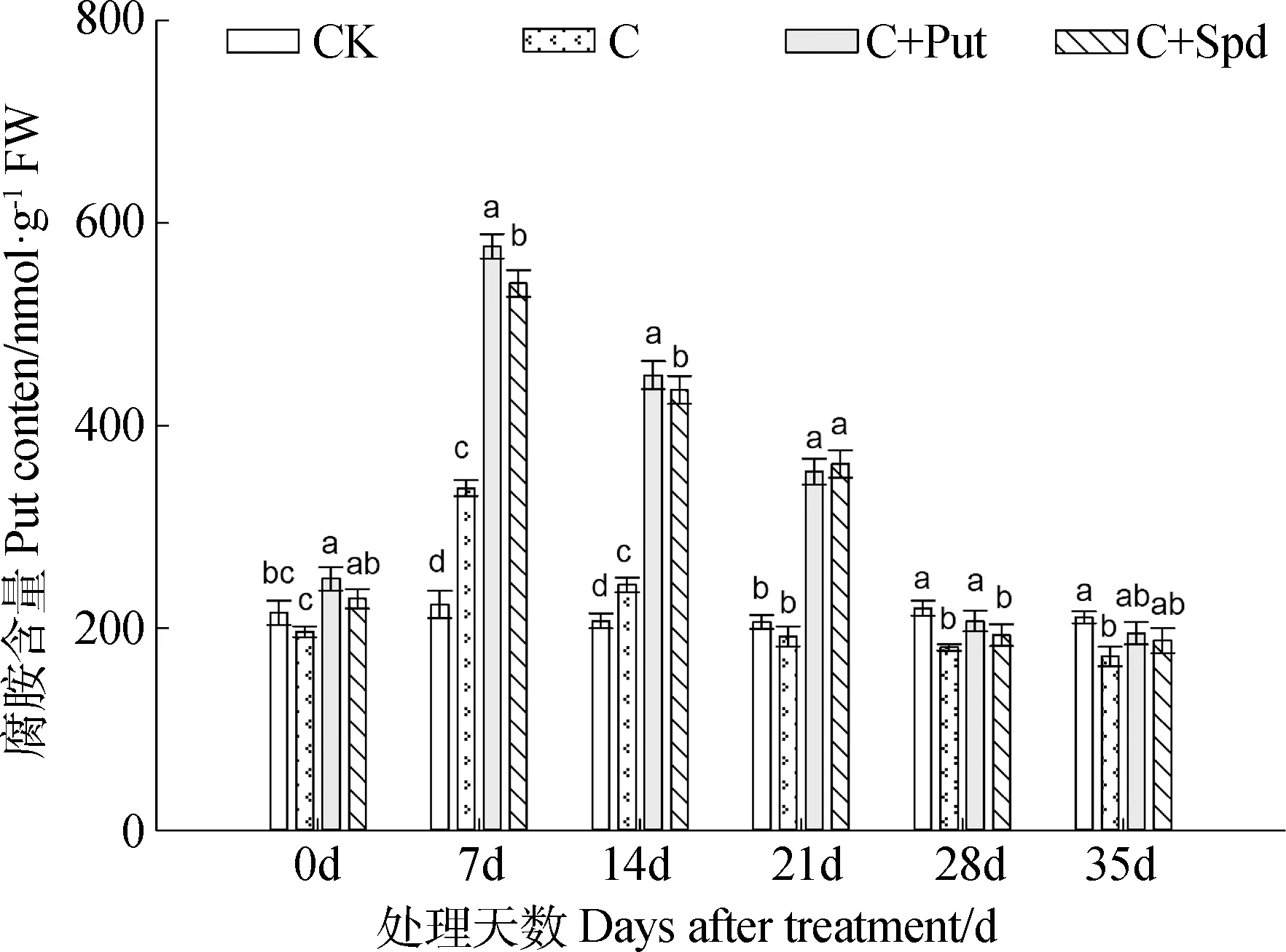
图5 外源多胺对低温胁迫下假俭草叶片腐胺含量的影响Fig.5 Effects of exogenous polyamine on Put content in the leaves of centipede grass under chilling stress
2) Spd含量,在低温胁迫期间,假俭草叶片内的Spd含量呈现出先升后降的变化趋势,在低温胁迫的第14 d达到最高,之后随着低温胁迫时间的持续,Spd含量下降。所有的处理的假俭草叶片内的Spd含量都显著高于对照CK,处理C+Put与C+Spd内的Spd含量显著高于处理C,而处理C+Spd内的Spd含量又显著高于处理C+Put(图6)。
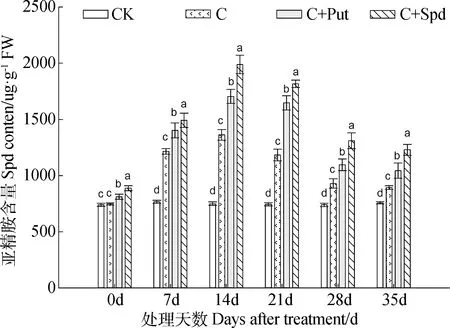
图6 外源多胺对低温胁迫下假俭草叶片亚精胺含量的影响Fig.6 Effects of exogenous polyamine on Spd content in the leaves of centipede grass under chilling stress
3) Spm含量,在低温胁迫期间,假俭草叶片内的Spm含量在低温胁迫后的第7 d达到最高,之后开始持续下降,呈现出先升后降的趋势。在低温胁迫期间,各处理的Spm由高至低排序依次为:C+Spd> C+Put> C。不同处理之间差异显著(图7)。
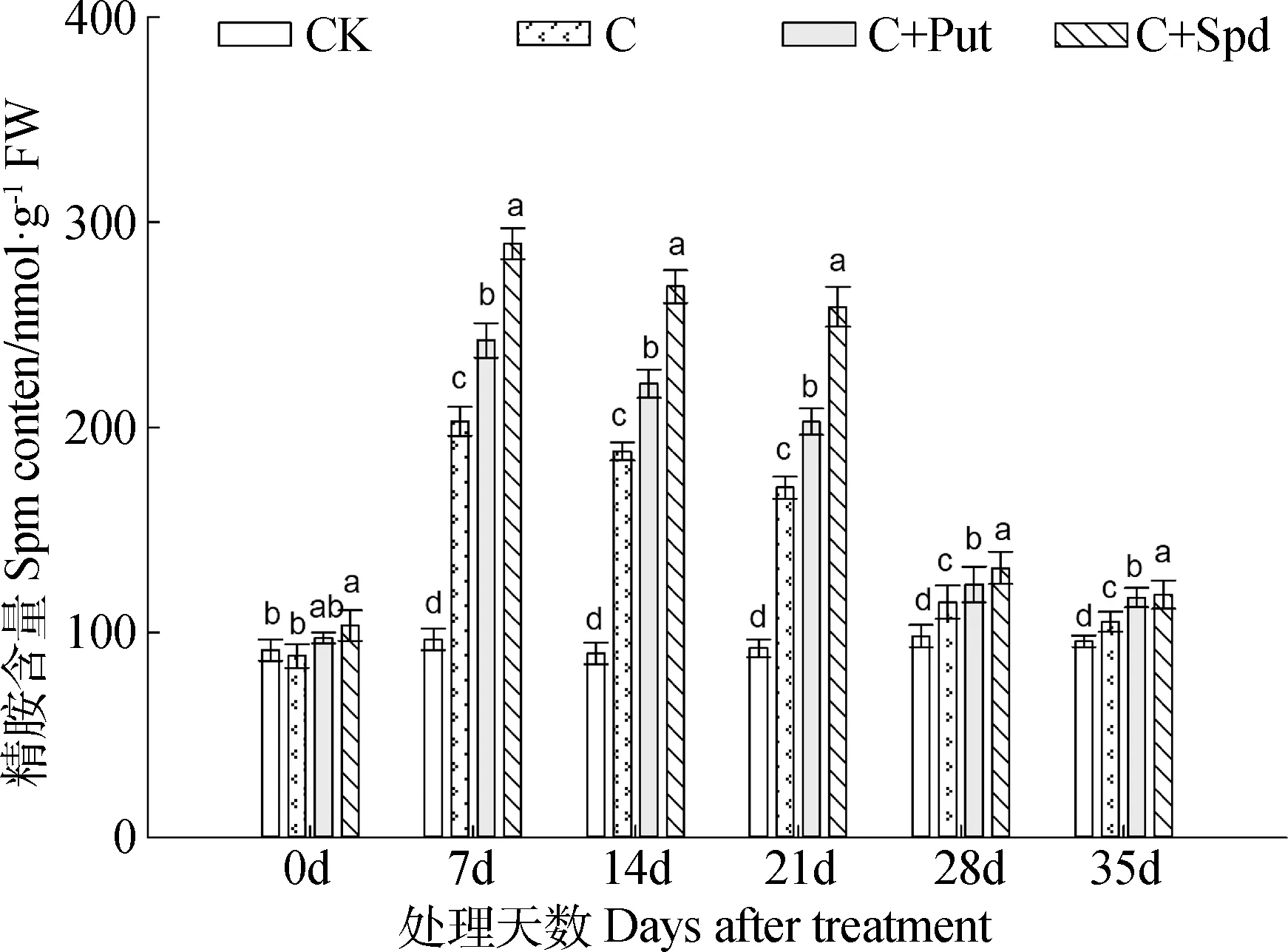
图7 外源多胺对低温胁迫下假俭草叶片精胺含量的影响Fig.7 Effects of exogenous polyamine on Spm content in the leaves of centipede grass under chilling stress
3 讨论
细胞膜脂的过氧化与植物的抗寒性有着密切的关系[17]。低温胁迫下,植物细胞的膜系统是植物受低温伤害的原初部位[18]。暖季型草坪草在低温胁迫下细胞质膜会受到损伤,细胞内的EL与MDA含量升高。本研究中,假俭草在低温胁迫下,其叶片细胞的EL与MDA含量持续上升。这意味着假俭草受到了低温伤害,且随着低温胁迫时间的持续,低温伤害加重。同时,本研究还发现,在低温胁迫期间,与对照相比,前期进行外源喷施Spd与Put的假俭草其叶片细胞内的EL值与MDA含量都显著低于喷水对照,其中喷施Spd的处理具有最低的EL值和MDA含量。喷施Put处理的EL值和MDA含量高于喷施Spd处理,但显著低于喷水对照。这意味着低温胁迫前施用外源Spd与Put可以显著降低假俭草细胞的膜损伤,降低膜脂的过氧化程度,提高了假俭草的耐寒性,Spd的效果显著优于Put。
植物在低温胁迫发生时,其体内卡尔文循环的羧化过程会受到抑制,导致卡尔文循环关键光合酶的活性降低,从而降低了光能利用率与CO2同化,造成O2的光合电子通量增加,从而产生大量的活性氧[2]。这些活性氧对细胞的质膜系统的稳定性产生较大损害。而植物体内抗氧化酶可以通过清除活性氧以保护植物免受伤害。因此,保持植物细胞内活性氧的生产和清除之间的平衡是植物在胁迫条件下存活的必要条件。抗氧化酶是植物体细胞内抗氧化防御系统的重要组成部分。以往的研究表明,在低温胁迫下,抗氧化酶的活性与草坪草的耐寒性紧密相关[5-6]。以往对假俭草耐寒性的研究也曾发现,与不耐寒的品种相比,假俭草的耐寒突变体和其他作物的耐寒品种在低温胁迫期间能保持较高的抗氧化酶活性,积累更多的抗氧化物,从而提高耐寒性[19-21]。本研究发现,在冷胁迫发生的第7 d开始,外源Spd与Put处理显著增加了假俭草叶片细胞内抗氧化酶(SOD,POD,APX和CAT)的活性。抗氧化酶活性的提高与EL和MDA含量降低基本一致。说明Spd与Put处理提高假俭草耐寒性与改善其低温胁迫下的抗氧化酶活性密切相关。此外,与降低细胞膜损伤程度一致;低温胁迫下Spd处理提高抗氧化酶活性的效果好于Put。
在渗透胁迫发生时,植物细胞内会主动积累一些小分子化合物如氨基酸、氨基化合物、可溶性多糖、有机酸,以及一些无机离子,以此降低细胞渗透势和水势,维持膨压,降低伤害。此类化合物统称渗透调节物质[22]。诸多研究表明,低温胁迫下植物细胞内渗透调节物质的积累与其耐寒性有着密切关系。脯氨酸与可溶性多糖是草坪草细胞内与抗寒性相关的重要渗透调节物质,当低温胁迫发生时,沟叶结缕草(Zoysiamatrella)、结缕草、假俭草细胞内的脯氨酸含量显著增加[23-25],对早熟禾在低温胁迫下的生理响应的研究也发现,脯氨酸的含量与耐寒性呈显著的正相关关系[26]。野牛草(Buchloedactyloides)、盐草(Distichlisspicata)和结缕草(Zoysiajaponica)在低温下胁迫下细胞积累较多的果糖可以提高抗寒性[27-29]。低温胁迫下,叶片细胞内积累较高浓度可溶性多糖的狗牙根品种具有更强的耐寒性[30]。本研究发现,当冷胁迫发生时,外源Spd与Put处理显著提高了假俭草叶片细胞内的脯氨酸(Pro)与可溶性多糖(SS)的含量,与相对电导率(EL)值与丙二醛(MDA)含量的变化呈相反趋向。这说明,在低温胁迫下,Spd与Put处理提高其体内的渗透调节物质的含量与改善假俭草的耐寒性密切相关。此外,研究还发现,低温胁迫下,在提高假俭草细胞内的脯氨酸与可溶性多糖含量,以及降低EL值与MDA含量等的效果上,Spd显著优于Put。
低温胁迫下,具有较高的Spd与Put合成能力的转基因植物具有更强的耐寒性[31-33]。过表达CdSAMDC的转基因假俭草具有较强的耐寒性,这可能与其细胞内具有较高的Spd和Spm含量有关[34]。具有较高Spd、Put与Spm含量的假俭草耐寒突变体比假俭草的野生型表现出更强的耐寒性[20]。相反,通过基因敲除技术或者下调ADC,SAMDC,SPDS和SPMS等基因的表达,降低了植物细胞内的多胺含量,导致了植物耐寒、耐旱与耐盐能力的下降[32,35-36]。在低温胁迫发生时,小麦的耐寒性与其体内的Put含量呈正相关[37]。当寒胁迫发生时,耐寒品种的水稻秧苗根部与芽中的Put、Spm和Spd的含量都急剧增加[34]。外源多胺的施用已经成功地应用于提高植物的抗逆性[38-40]。施用外源多胺可以提高植物内源多胺的含量,提高抗氧化酶的活性,降低丙二醛的含量,扭转盐胁迫造成的生长抑制,提高植物耐盐性[41-46]。干旱胁迫下,匍匐翦股颖内源多胺的含量与耐旱性存在正相关关系[47],施用外源亚精胺可以提高匍匐翦股颖在干旱胁迫下的内源多胺含量,提高其耐旱性[48]。在冷胁迫下,施用外源多胺可以提高鹰嘴豆与芥菜型油菜的抗氧化酶活性,降低逆境胁迫导致的过氧化造成的损害,从而提高了耐寒性[49]。外源多胺喷施对提高假俭草的耐寒性有着明显的作用[50]。本研究发现,外源Spd与Put处理显著提高了低温胁迫下假俭草体内的Put、Spd和Spm含量,提高了耐寒性。这与以往的研究结果一致。本研究还发现,外源喷施Spd比Put对提假俭草细胞内的Spd、Spm的效果更加显著,而外源Put则对提高假俭草叶片内的Put含量的作用明显。
4 结论
在低温胁迫过程中,假俭草叶片内的相对电导率与丙二醛含量快速上升,假俭草出现了低温伤害现象。外源喷施Spd与Put可以显著降低假俭草在低温胁迫下叶片细胞内的相对电导率与丙二醛含量,同时显著提高其抗氧化酶的活性,以及脯氨酸、可溶性多糖与游离态多胺等物质的含量,进而提高假俭草的低温胁迫耐受性,降低低温伤害。这表明,外源多胺物质的合理使用是提高假俭草抗寒性,延长其绿色期的一个直接、可行、有效途径,在假俭草养护中具有较为广阔的应用前景。

