棘孢木霉活性代谢产物的初步分离及其抑菌与促生长功能
刘畅 吴长景 窦恺 刘志华 何正权 张福丽 庞丽 宋昊跃 葛红莲
摘 要:为探究棘孢木霉CBS 433.97(Trichoderma asperellum CBS 433.97)的活性代谢产物在促进植物生长与抑制病原菌等方面的功能,本研究初步分离了棘孢木霉代谢产物,并分析了其活性成分对尖孢镰刀菌MC-1和CS-5的抑菌效果,同时研究了棘孢木霉代谢产物中的活性成分对小麦的株高、根长和发芽率的影响。用不同的萃取剂萃取棘孢木霉发酵液中的活性成分,正丁醇萃取相获得的粗提物对MC-1与CS-5的抑菌效果最好。进一步对正丁醇萃取相获得的粗提物进行薄层层析,获得了4个组分TA1,TA2,TA3和TA4,4个组分对MC-1与CS-5均无明显抑制作用,但组分TA3在浓度为1 g·L-1时,对小麦生长具有明显的促进作用。由此可见,棘孢木霉CBS 433.97代谢产物中具有能够抑制病原菌的生长、促进植物生长发育的活性成分,具有较好的开发潜力。
关键词:棘孢木霉;抑菌;促生长;活性代谢产物;初步分离
中图分类号:S476 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2019.07.001
Abstract: To explore the functions of active metabolites of Trichoderma asperellum CBS 433.97 on promoting plants growth and inhibitting phytopathogen, the metabolites were separated preliminarily, and the inhibitions of active components on Fusarium oxysporum MC-1 and Fusarium oxysporum CS-5 , as well as the effects of the active components from T. asperellum CBS 433.97 metabolites on plant height, root length and germination rate of wheat were analyzed. The active components of the fermentation broth from T. asperellum CBS 433.97 were extracted with different ectracting agent, the crude extracts obtained by the n-butanol extraction phase had the best inhibitory effect on MC-1 and CS-5. The crude extracts from the n-butanol phase were further extracted by TLC, and four components, TA1, TA2, TA3 and TA4, were obtained. The four components had no significant inhibitory effect on MC-1 and CS-5. However, component TA3 of 1 g·L-1 significantly promoted germination and growth of wheat. The results showed that the metabolites of T. asperellum CBS 433.97 possessed active components that could inhibit phytopathogen, as well as promote growth and development of plants. Therefore, this Trichoderma strain has good development potential.
Key words: Trichoderma asperellum; inhibition; growth promotion; active metabolites; prefractionation
植物根际促生微生物是植物生长体系中不可缺少的一环,这些微生物能够促进植物生长及营养吸收,甚至能保护植物免受病虫害侵袭[1-2]。由于世界人口不断增加,以及城市发展和气候变化等因素导致了可耕地不断缩减,实际生产中,人们在需要更多粮食的同时还要减少资源投入[3]。而微生物资源的利用在有效解决当前这一问题的同时,有利于土壤的改良[4]。
近年來,真菌代谢产物逐渐成为了生物药剂与农业生产中生物农药和肥料研发的重要来源[5-7]。作为一种非致病性腐生真菌,木霉菌(Trichoderma spp.)是世界上著名的生防因子,可以寄生于植物根系,促进根系生长发育,提高植物对病虫害的抗性,目前为止代谢产物已广泛应用于植物的生物防治中[8-9]。相关研究表明,木霉菌代谢产物具有抵抗植物病原菌、调节植物生长、促进植物根系发育与细胞活力等功能[10-12]。随着木霉菌次级代谢产物在植物保护与生物防治中的潜力被挖掘出来,对未来农业科技发展将具有重大意义[13]。但与链霉菌等真菌相比,木霉菌代谢产物研究及产品开发还相对较少。因此,本研究预对棘孢木霉CBS 433.97代谢产物进行初步分离,并对这些代谢产物的抑菌活性及促植物生长功能进行了分析,以期为木霉菌来源的生物农药等产品开发提供理论依据。
1 材料和方法
1.1 材料与试剂
供试菌株:木霉菌株为棘孢木霉CBS 433.97(Trichoderma asperellum CBS 433.97)购于中国农业微生物保藏中心;尖孢镰刀菌菌株Fusarium oxysporum MC-1(苦瓜枯萎病病原菌)与F. oxysporum CS-5(黄瓜枯萎病病原菌),均由本试验室保藏;小麦(Triticum aestivum)为西农979。
主要试剂: G-254硅胶粉(化学纯),购于青岛海洋化工有限公司;羧甲基纤维素钠(分析纯),购于天津市恒兴化学试剂制造有限公司。其他试剂均为分析纯。
棘孢木霉液体发酵罐发酵培养基:玉米粉40 g,MgSO4·7H2O 0.4 g,ZnSO4 0.001 g,MnSO4 0.001 g,NH4NO3 0.8 g,NaCl 0.7 g,蒸馏水定容至1 000 mL。1×105 Pa灭菌20 min。
PDA固体培养基:土豆200 g,葡萄糖20 g,琼脂20 g,蒸馏水定容至1 000 mL。1×105 Pa灭菌20 min。
PDA液体培养基:土豆200 g,葡萄糖20 g,蒸馏水定容至1 000 mL。1×105 Pa灭菌20 min。
1.2 方 法
1.2.1 棘孢木霉与其代谢产物的抑菌性分析试验 (1)平板对峙试验。用直径为9 mm的打孔器分别截取培养3 d的棘孢木霉和培养5 d的病原菌菌块,两菌块分别放置在PDA固体培养基的一端,二者相距4 cm,每组3个重复。接种完成后,28 ℃温度条件下培养。根据棘孢木霉与2种病原菌在平板中的对峙情况计算棘孢木霉对病原菌MC-1和CS-5的抑菌率,计算公式如下。
抑菌率=×100%
(2)棘孢木霉发酵液制备。将在PDA培养基上培养3 d的棘孢木霉菌菌饼接种于PDA液体培养基中,28 ℃温度条件下、180 r·min-1震荡培养7 d。将棘孢木霉发酵液转接到容量为120 L的液体菌种发酵罐内,液体菌种发酵罐内的培养基为棘孢木霉液体发酵培养基,发酵20 d。发酵好的棘孢木霉发酵液用于代谢产物抑菌活性测定。
(3)棘孢木霉发酵液抑菌活性测定。采用含药培养基平板法[14],按照棘孢木霉代谢产物与PDA固体培养基体积比为1∶10、1∶50、1∶100的比例分别加到PDA固体培养基中并混均,对照为PDA固体培养基。用打孔器打制MC-1与CS-5的菌饼分别接种于含棘孢木霉代谢产物的培养基中心,将平板倒置于28 ℃恒温培养箱内培养,每组3个重复。培养4 d后,测量各组实验菌落直径大小,计算棘孢木霉代谢产物对MC-1和CS-5的抑菌率。
抑菌率=×100%
1.2.2 棘孢木霉代谢产物的分离 (1)最佳萃取剂的确定。在棘孢木霉代谢产物中分别加入等体积的正丁醇、乙酸乙酯和石油醚进行萃取,萃取相用旋转蒸发仪进行减压浓缩蒸干,然后用甲醇溶解,获得粗提物。将粗提物的浓度调整至1 g·L-1,作为母液备用。将粗提物母液分别稀释至浓度为0.1,0.01和0.001 g·L-1溶液,4 ℃保存备用,对照为甲醇。将病菌MC-1和CS-5用打孔器打成菌饼接种于PDA固体平板中央,将各浓度的粗提物与甲醇分别吸取100 μL滴加到接种于平板上的菌饼上,每组3个重复,放置28 ℃培养箱内培养3 d,观察现象,测量菌落直径,用于计算粗提物对病原菌的抑菌率,确定最佳萃取溶剂。
(2)薄层层析。应用张量[15]的方法制备硅胶板。将待测的粗提物样品用毛细管(直径0.5 mm)点样于活化好的硅胶板上,分别用氯仿和甲醇的不同比例的混合溶剂作为展开剂进行展开,在紫外灯下或用碘蒸气进行显色观察来确定最佳的展开剂。
(3)收集组分。将薄层层析获得的各组分从硅胶板上刮下,溶于甲醇中。在超净工作台内将有机溶剂吹干,称各组分质量,用定量无菌水溶解各组分置于EP管内,4 ℃保存备用。
1.2.3 薄层层析获得的各组分功能分析 (1)抑菌功能分析。将在PDA液体培养基中培养2 d的MC-1和CS-5菌液吸取1 mL与100 mL PDA固体培养基混均倒板,将无菌滤纸片均匀放置于含MC-1和CS-5菌液培养基上,然后分别吸取各组分溶液与无菌水各100 μL滴加到滤纸片上,每组3个重复,放置28 ℃培养箱内培养3 d,观察抑菌圈的大小,计算各组分对病原菌的抑菌率。
(2)促生长功能分析。将上述的各组分分别用无菌蒸馏水稀释成浓度为1 g·L-1,100 mg·L-1,10 mg·L-1,
1 mg·L-1,100 μg·L-1,10 μg·L-1,1 μg·L-1和100 ng·L-1的溶液。小麦种子(西农979)用75%的乙醇消毒2 min,无菌水洗6遍,再用2%的次氯酸钠消毒2 min,无菌水洗6遍。用上述不同浓度的各组分溶液分别浸泡小麦种子30 min。同时,用不同浓度的IAA(1 g·L-1,100 mg·L-1,10 mg·L-1,1 mg·L-1,100 μg·L-1,
10 μg·L-1,1 μg·L-1和100 ng·L-1)和无菌水作为对照。无菌滤纸平铺到培养皿中,然后分别加入7 mL相应的各组分溶液,最后将上述处理过的小麦种子接种到滤纸上,每皿10颗,每组3个重复。测定小麦种子在24 h和48 h的发芽率,生長第15天时测定小麦幼苗的根长及株高。试验结果表明(数据未在本文中列出),IAA在浓度为100 μg·L-1时,小麦种子发芽率最高,24 h和48 h时的发芽率分别为75%和90%。培养15 d后,IAA促进小麦种子根部生长的最适浓度为100 μg·L-1;促进小麦幼苗株高的最适浓度为10 μg·L-1。IAA处理小麦根长、株高和发芽率的最佳浓度分别作为此次试验的阳性对照;无菌水处理组作为本次试验的阴性对照。
1.3 数据分析
利用Microsoft Excel 2010 和SPSS 16.0 对数据进行计算与方差分析。
2 结果与分析
2.1 棘孢木霉与其代谢产物的抑菌活性分析
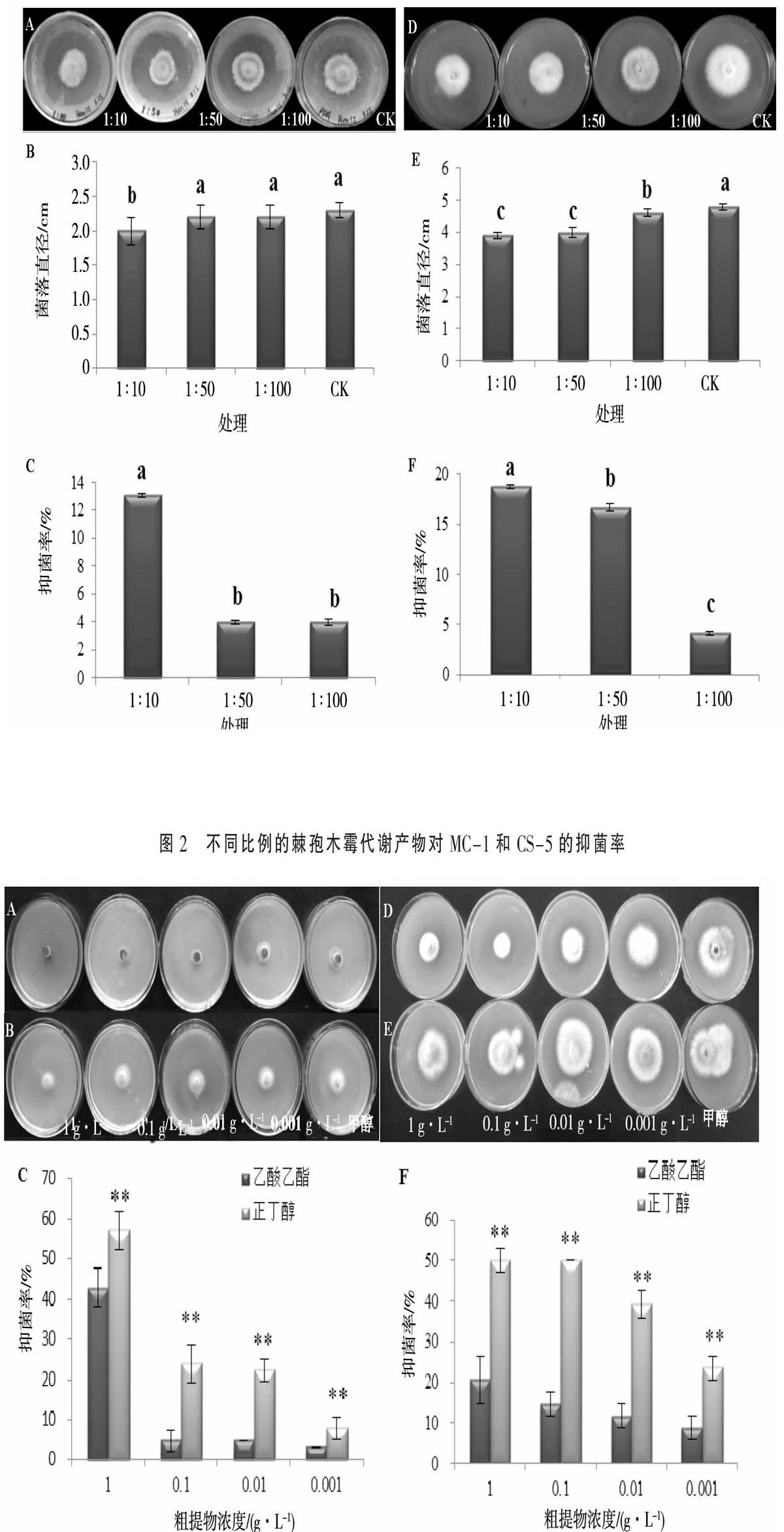
采用平板对峙法分析了棘孢木霉对植物病原尖孢镰刀菌MC-1和CS-5的拮抗作用。结果显示,棘孢木霉对2种病原菌均具有不同程度的拮抗作用,其中对MC-1的抑菌率为36.4%,对CS-5的抑菌率为62.0%(图1)。采用含药培养基法分析棘孢木霉代谢产物对MC-1和CS-5抑制效果。结果显示,在棘孢木霉发酵液与PDA比例为1∶10时对MC-1的抑菌率为13.04%,抑菌效果显著高于其他处理;在棘孢木霉发酵液与PDA比例为1∶10时对CS-5的抑菌率为18.75%,抑菌效果显著高于其他处理(图2)。
2.2 棘孢木霉代谢产物的分离
2.2.1 最佳萃取剂的确定 经过萃取,乙酸乙酯和正丁醇均萃取出活性物质,但是石油醚没有萃取出活性物质(结果未列出),故本研究只列出了乙酸乙酯萃取相与正丁醇萃取相对CS-5和MC-1的抑菌试验。不同浓度的各萃取相粗提物对CS-5和MC-1的抑菌效果见图3。从图3中可以看出1 g·L-1的正丁醇萃取相对CS-5和MC-1的抑菌效果均为最好,对MC-1的抑菌率达到57.14%,对CS-5的抑菌率达到50.45%。故在接下来对棘孢木霉代谢物进行分离时,采用正丁醇作为萃取相进行大量萃取。
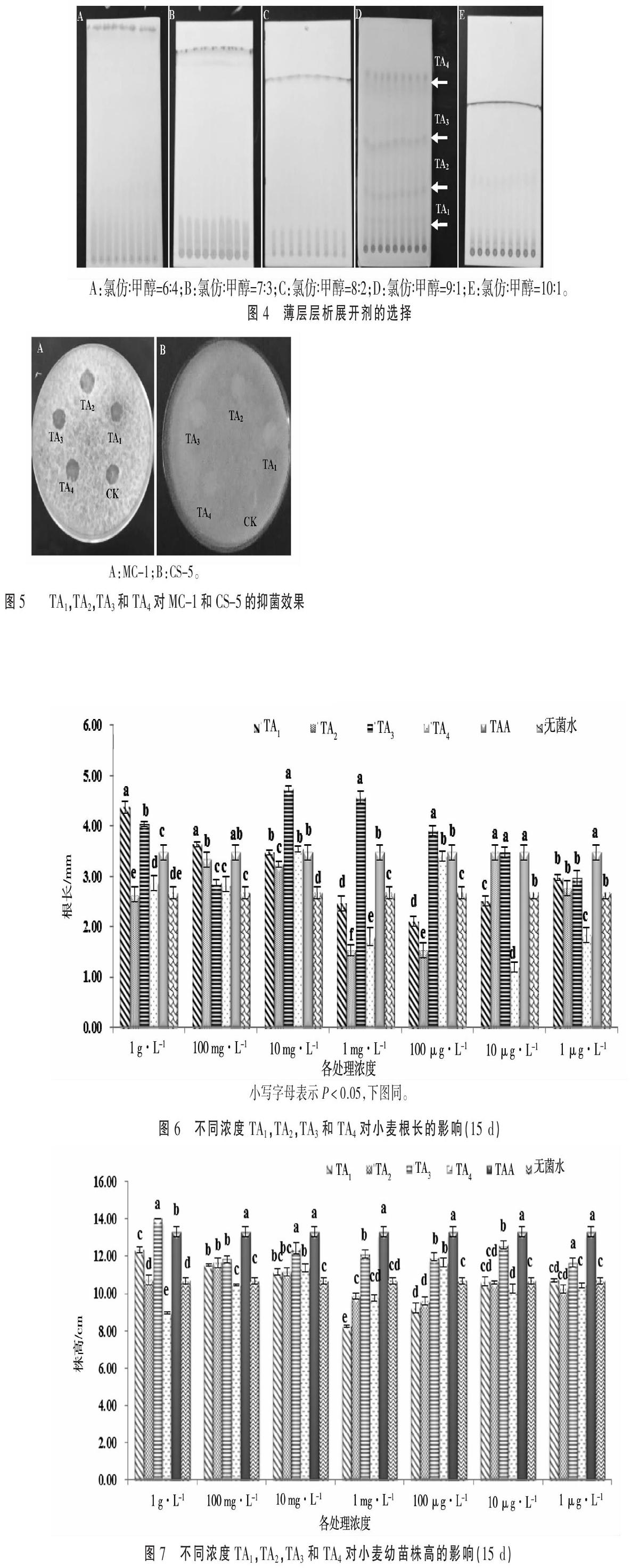
2.2.2 展开剂的选择 本试验探索的展开剂比例有以下几种,氯仿∶甲醇=9∶1,10∶1,8∶2,7∶3和6∶4,待展开完毕后,将硅胶板晾干,用碘蒸气进行显色,展开剂比例为氯仿∶甲醇=9∶1的展开效果最好(图4),得到四条带,自下而上分别标记为TA1,TA2,TA3,TA4。2.3 薄层层析获得的各组分功能分析
2.3.1 抑菌作用 对TA1,TA2,TA3和TA4 4个组分的抑菌活性分别进行了分析,由图5可知,分离得到的4个组分均无明显抑菌效果(图5)。2.2.1部分研究表明该菌株代谢物具有抑制病原菌的潜能,因此此部分的结论与2.2.1部分相矛盾,原因可能是抑菌活性物质在TA1,TA2,TA3和TA4 4个组分之外。
2.3.2 TA1,TA2,TA3和TA4 4个组分的促生长作用分析 小麦种子用各组分不同浓度的溶液培养15 d后根长与株高见图6和图7。由图6可知,组分TA1在浓度为1 g·L-1时,小麦种子根生长最快,与IAA相比根长增长了25.94%,与无菌水相比根长增长了63.67%;组分TA2在浓度为10 μg·L-1时,小麦种子根部生长最快,与IAA相比根长增加了0%,与无菌水相比根长增加了29.96%;组分TA3在浓度为1 g·L-1时,小麦种子根部生长最快,与IAA相比根长增加了36.31%,与无菌水相比根长增加了77.15%;组分TA4在浓度为10 mg·L-1时,小麦种子根部生长最快,与IAA相比根长增加了1.73%,与无菌水相比根长增加了32.21%。
由图7可知,组分TA1在浓度为1 g·L-1时,小麦幼苗生长最好,与IAA相比无明显的促进幼苗生长的作用,与无菌水相比株高增长了15.45%;组分TA2在浓度为100 mg·L-1时,小麦幼苗生长最好,与IAA相比无促进幼苗生长作用,与无菌水相比株高增长了8.89%;组分TA3在浓度為1 g·L-1时,小麦幼苗生长最好,与IAA相比株高增长了5.26%,与无菌水相比株高增长了31.09%;组分TA4在浓度为100 μg·L-1时,小麦幼苗生长最好,与IAA相比无促进幼苗生长作用,与无菌水相比根部长度增长了8.48%。
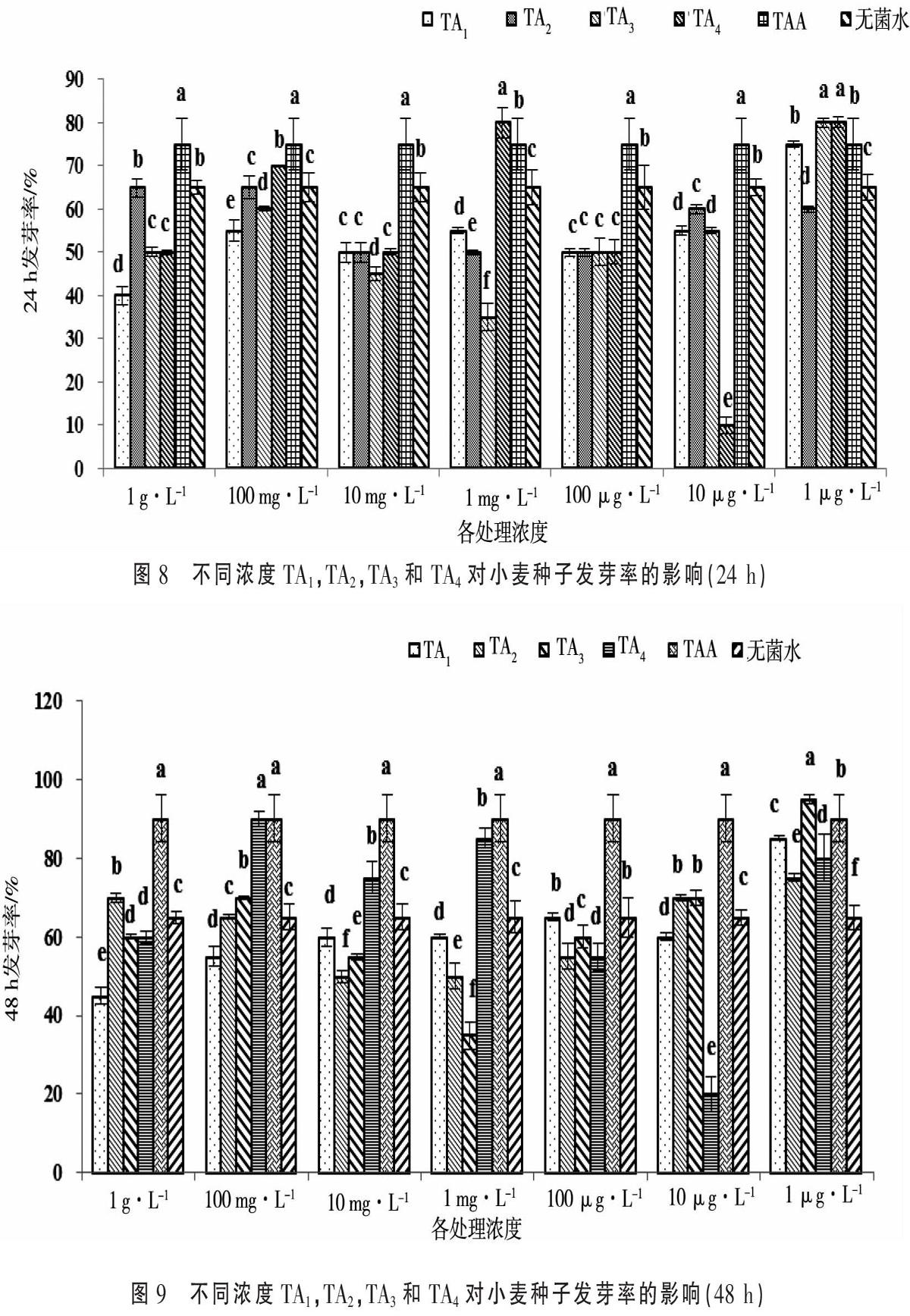
小麦种子用各组分不同浓度的溶液培养的发芽率见图8和图9。种子培养24 h时,无菌水处理的小麦种子发芽率为65%。由图8可知,TA1在浓度为1 μg·L-1时发芽率为75%,发芽率最高,与IAA相比发芽率相同,与无菌水相比提高了10%;TA2在浓度为1 g·L-1,100 mg·L-1时发芽率为65%,发芽率最高,与IAA相比发芽率较低,与无菌水发芽率相同;TA3在浓度为1 μg·L-1 时发芽率为80%,发芽率最高,与IAA相比发芽率提高5%,与无菌水相比发芽率提高15%,TA4在浓度为1 mg·L-1,1 μg·L-1时,发芽率最高,小麦种子发芽率达到80%,与IAA相比发芽率提高5%,与无菌水相比发芽率提高15%。
种子培养48 h时,无菌水处理的小麦种子发芽率为65%。由图9可知,TA1在浓度为1μg·L-1时发芽率为85%,发芽率最高,与IAA相比发芽率较低,与无菌水相比提高了20%;TA2在浓度为1 μg·L-1时发芽率为75%,发芽率最高,与IAA相比发芽率较低,与无菌水发芽率相同提高了10%;TA3在浓度为1 μg·L-1 时发芽率为95%,发芽率最高,与IAA相比发芽率提高5%,与无菌水相比发芽率提高30%,TA4在浓度为100 mg·L-1时,发芽率最高,与IAA的发芽率相同,与无菌水相比发芽率提高25%。
3 结论与讨论
本研究初步确定了棘孢木霉代谢产物中具有抑制尖孢镰刀菌MC-1与CS-5的活性物质,但本试验中获得的4个组分对两种病原菌均无明显抑制作用,表明现阶段暂时未追踪到能够抑制MC-1和CS-5生长的活性物质,接下来的工作中还将继续进行追踪,并采用更多的病原菌进行物质的抑菌活性分析。
虽然本研究未得到对病原菌MC-1和CS-5具有抑菌活性的物质,但在本研究中初步获得的4个组分TA1,TA2,TA3,TA4均对小麦幼苗具有不同程度的促生长作用,其中TA3在浓度为1 g·L-1时的促生长作用最为显著,对小麦根部生长的促进作用与IAA相比提高了36.31%,与无菌水相比提高了77.15%;对小麦幼苗株高的促生长作用与IAA相比增加了5.26%,与无菌水相比提高了31.09%;培养第48 h后,1 μg·L-1的TA3处理后小麦种子发芽率达到了95%,与IAA相比提高了5%,与无菌水相比提高了30%。表明组分TA3能够促进小麦幼苗生长。
本研究只采用薄层层析和一种展开剂比例分离得到了4个组分,并且仅分析了棘孢木霉对尖孢镰刀菌的抑制作用以及对小麦根长、株高和发芽率的影响。后续研究将进一步应用高效液相色谱分析、质谱分析和盆栽试验等对棘孢木霉活性代谢产物进行分离和功能分析,为棘孢木霉CBS 433.97的进一步应用奠定基础和提供理论依据。
参考文献:
[1]NKMAKCI R, ERAT M, ERDOGAN, et al. The influence of plant growth promoting rhizobacteria on growth and enzyme activities in wheat and spinach plants[J]. Journal of plant nutrition and soil science, 2007, 170(2): 288-295.
[2]El-HASAN A, SCHONE J, HOGLINGER B, et al. Assessment of the antifungal activity of selected biocontrol agents and their secondary metabolites against Fusarium graminearum[J]. European journal of plant pathology, 2018, 150(1): 91-103.
[3]胡云平. 微生物农业产业技术研究进展及发展前景[J]. 河南农业, 2018, 467(15): 49-50.
[4]赵嘉宁. 农业微生物资源在国家经济及生态环境建设中的重要作用[J]. 江西农业, 2018(12):87.
[5]FIEDLER H P, BRUNTNER C, BULL A T, et al. Marine actinomycetes as a source of novel secondary metabolites[J]. Antonie van leeuwenhoek, 2005, 87(1): 37-42.
[6]郝泽婷, 郝晓慧, 阎婧, 等. 淡紫拟青霉次级代谢产物的研究进展[J]. 生物技術通报, 2018, 34(10): 11-17.
[7]HWANG K S, KIM H U, CHARUANTI P, et al. Systems biology and biotechnology of Streptomyces species for the production of secondary metabolites[J]. Biotechnology advances, 2014, 32(2): 255-268.
[8]VINALE F, SIVASITHAMPARAM K, GHISALBERTI E L, et al. Trichoderma secondary metabolites active on plants and fungal pathogens[J]. The open mycology journal , 2014, 8(1): 127-139.
[9]CONTRERAS-CORNEJO H A, MACIAS-RODRIGUEZ L, DEL-VAL E, et al. Ecological functions of Trichoderma spp. and their secondary metabolites in the rhizosphere-interactions with plants[J]. FEMS microbiology ecology, 2016, 92(4): 36.
[10]JOSHI D, SINGH P, SINGH A K, et al. Antifungal potential of metabolites from Trichoderma sp. against Colletotrichum falcatum Went causing red rot of sugarcanes[J]. Sugar tech, 2016, 18(5): 529-536.
[11]CHEN S C, ZHAO H J, WANG Z H, et al. Trichoderma harzianum-induced resistance against Fusarium oxysporum involves regulation of nuclear DNA content, cell viability and cell cycle-related genes expression in cucumber roots[J]. European journal of plant pathology, 2016, 147(1): 43-53.
[12]VINALE F, FLEMATTI G, SIVASITHAMPARAM K, et al. Harzianic acid, an antifungal and plant growth promoting metabolite from Trichoderma[J]. Journal of natural products, 2009, 72 (11): 2032-2035.
[13]KESWANI C, MISHRA S, SARMA B K, et al. Unraveling the efficient applications of secondary metabolites of various Trichoderma spp[J]. Applied microbiology and biotechnology, 2014, 98(2): 533-544.
[14]崔振玲, 王洁, 胡忠义. 液体培养基比色法快速检测结核分枝杆菌耐药性[J]. 中国抗生素杂志, 2006, 31(9): 555-558.
[15]张量. 防治辣椒疫病的木霉拮抗化合物筛选及其生防制剂制备[D]. 杭州: 浙江大学, 2015.

