SFRP1基因沉默抑制人胃黏膜上皮GES-1细胞失巢凋亡
汤晓琳 杨丹 吕鑫 沈薇
(沈阳医学院 1机能实验中心,辽宁 沈阳 110034;2药理教研室;3 2018届临床医学专业;4病理生理教研室)
正常上皮细胞与细胞外基质(ECM)脱离黏附后,细胞与基质相互作用消失,发生失巢凋亡(anoikis)。肿瘤对失巢凋亡的抵抗能力在肿瘤转移中发挥重要作用。胃癌是全球常见的恶性肿瘤,预后较差,其5年生存率仅为20%~30%〔1〕,胃癌转移是导致死亡的最主要原因。研究表明,分泌型卷曲相关蛋白(SFRP)1在胃癌中呈低表达,且与淋巴结转移及患者不良预后相关〔2〕。有报道SFRP1甲基化致基因沉默促进胃癌的形成和发展〔3〕,但关于SFRP1对细胞失巢凋亡的影响及其机制尚少报道。本课题组在前期研究中发现胃黏膜上皮细胞(GES)-1为失巢凋亡敏感细胞〔4〕,本研究应用RNA干扰沉默GES-1中SFRP1表达,观察其对GES-1细胞失巢凋亡敏感性的影响,并探讨其相关分子机制。
1 材料与方法
1.1 材料与试剂 人GES-1(武汉普诺赛公司)。RPMI1640培养基(美国Corning公司);胎牛血清(美国Gemini公司);胰蛋白酶-乙二胺四乙酸(EDTA)(天津灏洋生物有限公司);SFRP1基因siRNA(上海吉玛基因公司);脂质体Lipofectamine 2000(美国Invitrogen公司);RNA提取试剂盒(美国Axygen公司);逆转录试剂盒、Q-PCR试剂盒(美国Promega公司);多聚α-羟乙基甲基丙烯酸酯(Poly-HEMA,美国Sigma公司);凋亡检测试剂盒(日本同仁化学研究所);CytoSelectTM24-Well Anoikis Assay(美国Cell Biolabs公司)。兔多克隆抗体SFRP1(美国Abcam公司);鼠单克隆抗体β-catenin 抗体、β-actin抗体(美国Santa Cruz公司);辣根过氧化物酶(HRP)标记山羊抗鼠和山羊抗兔IgG,增强化学发光(ECL)试剂盒(美国Proteintech公司);红色荧光素(RRX)标记山羊抗兔IgG(中国康为世纪公司);4′6-二脒基-乙-苯基吲哚(DAPI)染液、十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE)配制试剂盒(上海碧云天公司)。
1.2 方法
1.2.1 细胞培养及转染 GES-1培养在含有10%胎牛血清的RPMI1640培养基中,在37℃、5% CO2条件下培养。针对SFRP1不同位点的三组siRNA基因序列及对照组Control siRNA序列如下:siRNA-612正义:5′-GCUCAACAAGAACUGCCACTT-3′,反义:GUGGCAGUUCUUGUUGAGCTT-3′;siRNA-891正义:5′-GAAAUCUGAGGCCAUCAUUTT-3′,反义:5′-AAUGAUGGCCUCAGAUUUCTT-3′;siRNA-740正义:5′-UCAUGCAGUUCUUCGGCUUTT-3′,反义:5′-AAGCCGAAGAACUGCAUGATT-3′);Control siRNA正义:5′-UUCUCCGAACGUGUCACGUTT-3′,反义:5′-ACGUGACACGUUCGGAGAATT-3′。转染前24 h,将(1.5~2.0)×105个/ml处于对数生长期的细胞铺于6孔板内,每孔1 ml,培养过夜。第2天用脂质体包埋的siRNA与细胞结合进行瞬时转染,操作严格按照说明书进行。48 h后使用胰酶消化收集各组细胞进行失巢培养。
1.2.2 失巢凋亡模型的建立 称取1 g Poly-HEMA,加入10 ml无水乙醇,震荡混匀,37℃水浴加热至无颗粒状态,浓度为10 mg/ml。取3 ml液体覆盖于培养皿(60 mm)底部,在超净台内吹干,室温下待乙醇挥发使其自然凝固,重复操作2次,使用前磷酸盐缓冲液(PBS)清洗3次。收集转染48 h后的细胞接种于Poly-HEMA包被的培养皿中,细胞在培养皿中非黏附生长而呈悬浮状态,置于37℃、5%CO2条件下培养24 h。
1.2.3 Realtime RT-PCR检测 处理后细胞提取总RNA,以Oligo dT为引物逆转录合成第一条cDNA链,然后以第一条cDNA链为模板进行PCR扩增。引物序列:SFRP1正义:5′-GATGCTTAAGTGTGACAAGTTCCC-3′,反义:5′-TGGCCTCAGATTTCAAC TCGT-3′;GAPDH正义:5′-GCACCGTCAGGCTGAGAA-3′,反义:5′-TGGTGAAGACGCCAGTGG-3′;Cyclin D1正义:5′-AACTACCTGGACCGCTTCCT-3′,反义:5′-CCACTTGAGCTTGTTCACCA-3′;c-Myc正义:5′-ACCAGATCCCGGAGTTGGAA-3′,反义:5′-CGTCGTTTCCGCAACAAGTC-3′。ABI 7500 Real-time PCR扩增仪进行操作,反应条件为95℃预变性10 min、95℃ 15 s、60℃ 1 min,共40个循环,添加溶解曲线,计算平均值,最后以2-ΔΔCt方法计算目的基因相对表达量,重复实验3次。
1.2.4 流式细胞术检测细胞失巢凋亡率 收集各组悬浮培养24 h后的细胞,Annexin Ⅴ-FITC/PI 双染及流式细胞术检测失巢凋亡率。PBS洗涤并收集细胞,加入1倍Annexin V上样缓冲液制成1×106个/ml的细胞悬液,取100 μl细胞悬液,加入5 μl Annexin V-FITC,5 μl碘化丙啶(PI),室温下避光孵育15 min,加入上样缓冲液后上机检测。重复实验3次。
1.2.5 Calcein AM/EthD-1荧光双染法检测失巢凋亡 转染后各组悬浮培养24 h的细胞,每孔分别加入1 μl Calcein AM(500×)和1 μl EthD-1(500×),37℃孵育30~60 min,荧光倒置显微镜下观察。Calcein AM呈绿色荧光,检测活细胞的存在。EthD-1呈红色荧光,检测失巢凋亡细胞的存在。应用Image J软件进行细胞荧光强度的测定及分析。
1.2.6 软琼脂集落培养实验 软琼脂培养皿分为两层,底层软琼脂浓度为0.5%,上层软琼脂浓度为0.3%。转染48 h后收集细胞,制成密度为10×104个/ml的细胞悬液,取100 μl铺于软琼脂覆盖的培养皿中,在37℃、5% CO2条件下孵育14 d,倒置显微镜下观察细胞集落的形态和数目,每组样品随机拍摄5个视野,统计集落数,重复实验3次。
1.2.7 细胞免疫荧光检测 失巢培养24 h后收集细胞悬液,稀释浓度至15×104个/ml,取1 ml悬液铺于共聚焦培养皿中,再加入1 ml培养基,37℃、5%CO2条件下培养过夜。第二天弃掉培养基,PBS洗涤2次,4%多聚甲醛固定30 min,弃掉甲醛用PBS漂洗;0.2%Triton室温30 min进行细胞透化;5%BSA封闭60 min后弃掉液体;一抗β-catenin(1∶200)孵育,4℃过夜。PBS漂洗3次,二抗红色荧光RRX标记IgG(1∶50)室温避光孵育45 min,洗去二抗,加入DAPI染核(200 μl/皿),室温10 min,PBS漂洗后置于倒置荧光显微镜下拍照。
1.2.8 Western印迹检测 提取各组细胞总蛋白测量浓度并定量。一抗为SFRP1(1∶500),β-catenin(1∶200);β-actin (1∶1 000)。二抗为羊抗鼠IgG(1∶5 000),羊抗兔IgG(1∶5 000)。10% SDS-PAGE电泳,电泳分离后将蛋白电湿转至硝酸纤维素膜(PVDF)上,5% 过滤脱脂奶封闭1 h,4℃一抗孵育过夜,TBST洗3遍,每次10 min。加入HRP标记的二抗,室温孵育1 h,TBST洗膜30 min,ECL发光显色。
1.3 统计学分析 应用SPSS23.0软件,两组间比较采用t检验,多组间比较采用单因素方差分析,组间两两比较采用LSD法。
2 结 果
2.1 SFRP1 siRNA转染对GES-1细胞SFRP1 mRNA和蛋白表达的影响 针对SFRP1不同位点的3组SFRP1 siRNA及对照组Control siRNA分别转染GES-1细胞。与对照组设为1比较,siRNA-612组(0.47±0.09)及siRNA-891组SFRP1 mRNA表达(0.31±0.13)均明显降低(P<0.01)。siRNA-740组sFRP1 mRNA相对表达量为0.89±0.09。Western印迹结果显示,siRNA-891组SFRP1蛋白表达水平明显降低(图1)。提示SFRP1 siRNA-891成功转染GES-1细胞,显著下调SFRP1基因和蛋白表达。后续实验选用siRNA-891进行。
2.2 降低SFRP1表达对GES-1细胞失巢凋亡的影响 流式细胞术结果显示,siRNA-891组细胞失巢凋亡率〔(13.80±2.66)%〕较对照组〔(27.85±5.25)%〕明显降低(P<0.05)。
Calcein AM/EthD-1荧光双染法检测发现,与对照组〔EthD-1:(21.98±9.18)%,Calcein AM:(11.63±0.68)%〕比较,siRNA-891组EthD-1红色荧光染色的失巢凋亡细胞数目〔(6.64±1.42)%〕明显减少,Calcein AM绿色荧光染色的存活细胞数目〔(32.10±7.88)%〕明显增多(图2)。Calcein AM和EthD-1荧光值分析显示,siRNA-891组较对照组有显著差异(P<0.05)。
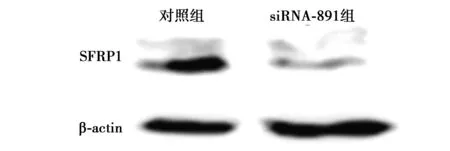
图1 SFRP1 siRNA转染对GES-1细胞SFRP1蛋白表达的影响

图2 Calcein AM/EthD-1荧光双染法检测GES-1细胞失巢凋亡的变化(×20)
2.3 降低SFRP1表达对细胞非锚定生长的影响 siRNA-891组与对照组相比,细胞集落明显变大,细胞集落数量明显增多〔对照组(13.3±4.04)个,siRNA-891组(25.67±2.08)个,P<0.05〕。见图3。
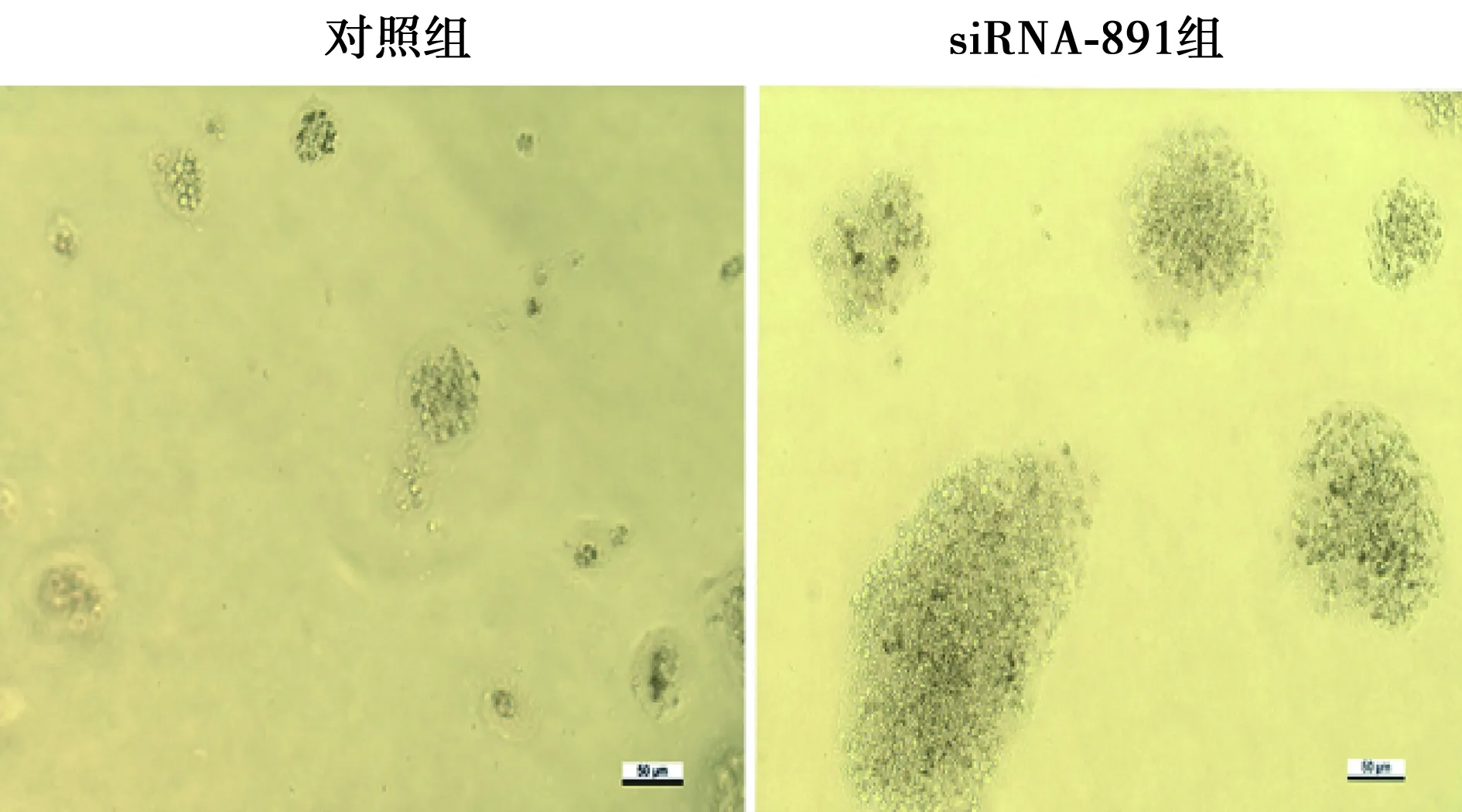
图3 SFRP1 siRNA转染对GES-1细胞非锚定生长的影响(×20)
2.4 降低SFRP1表达对细胞内β-catenin蛋白定位及表达的影响 与对照组比较,siRNA-891组β-catenin在细胞核中表达明显增强。Western印迹结果显示,siRNA-891组β-catenin蛋白表达水平较对照组明显增加。上述结果提示,降低SFRP1表达后Wnt通路激活,其通路中关键因子β-catenin表达增加(图4)。
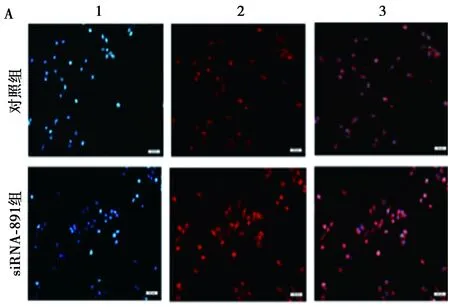

A:1,DAPI标记细胞核;2,β-catenin-RRX荧光标记;3,1和2的重叠影像;B:β-catenin蛋白表达结果图4 SFRP1 siRNA转染对GES-1细胞β-catenin蛋白表达及定位的影响(×20)
2.5 降低SFRP1表达对β-catenin靶基因c-Myc 和 CyclinD1表达的影响 与对照组(1.00±0.00)相比,siRNA-891组c-Myc mRNA(5.55±0.52)和CyclinD1 mRNA(2.48±0.22)表达明显增加,差异有统计学意义(P<0.01)。
3 讨 论
正常细胞依附ECM而存活称为锚定依赖。当正常上皮细胞与ECM失去黏附后,细胞与基质相互作用消失,发生失巢凋亡。这种特殊的细胞死亡形式对于维持机体组织结构至关重要。肿瘤细胞可在锚着不依赖的条件下存活,获得失巢凋亡抗性,进而发生迁移,侵入ECM,通过血液循环扩散到其他组织中增殖。因此,研究失巢凋亡的发生对揭示肿瘤转移的机制有重要意义。失巢凋亡与胃癌的关系近年来受到关注。有报道,促进肿瘤侵袭转移的基因DBC1,α-fetoprotein,Claudin-1可阻止胃癌细胞发生失巢凋亡〔5~7〕。但抑制肿瘤发展基因的表达与胃癌失巢凋亡的关系尚未见报道。
SFRPs 属于分泌型糖蛋白家族,约有300个氨基酸,称为分泌型卷曲相关蛋白。目前发现SFRP家族有7个成员,分别是SFRP1、SFRP2、SFRP3、SFRP4、SARP3、sizzled及crescent,其中SFRP1在多种恶性肿瘤组织中呈低表达或表达缺失。Zhang等〔2〕研究发现,SFRP1表达缺失存在于原发性胃癌,并且与SFRP1高甲基化密切相关。Cheng等〔3〕发现SFRP1的表达缺失促进胃癌发生淋巴转移。有报道人乳腺上皮细胞中SFRP1表达抑制促进细胞发生上皮间质转化,并获得局部浸润和迁移的特性〔8〕。肝癌细胞中过表达SFRP1可降低细胞的增殖力和迁移力〔9〕。但SFRP1表达沉默在肿瘤发生发展中的作用及机制仍不十分清楚,SFRP1基因对胃上皮细胞或胃癌细胞失巢凋亡的影响尚未见报道。本课题组在前期研究中报道了GES-1为失巢凋亡敏感细胞〔4〕,本研究结果提示抑制SFRP1基因表达后,GES-1细胞失巢凋亡敏感性下降,进而易获得失巢凋亡抵抗的能力。细胞的锚定不依赖性生长也可通过软琼脂集落实验检测。有报道软琼脂形成集落数目越多,细胞侵袭能力越强〔10〕。单个细胞集落形成状况反映了细胞抵抗失巢凋亡能力的高低〔11〕。本研究发现转染SFRP1siRNA抑制SFRP1表达后,GES-1细胞集落形成数目显著增多。上述结果证实抑制SFRP1基因表达使正常胃黏膜上皮细胞失巢凋亡敏感性显著下降,SFRP1的表达对于维持胃黏膜上皮细胞失巢凋亡特性具有重要作用,提示胃癌中SFRP1表达缺失可能参与介导细胞获得失巢凋亡抗性。
Wnt信号通路在细胞增殖、分化和凋亡中起重要作用,蛋白通过自分泌或旁分泌作用与位于细胞膜上的Fz受体结合,通过其下游蛋白的磷酸化与去磷酸化过程来完成Wnt信号途径的传递。Wnt通路的异常活化与肿瘤形成密切相关,影响肿瘤的侵袭转移〔12,13〕。有研究发现,胰腺癌细胞中Wnt2的异常表达抑制细胞的失巢凋亡,在体内促进肿瘤转移的发生〔14〕。SFRP1基因结构与Fz受体相似度可达30%~50%,具有同源的配体抑制区,故SFRP1可竞争性抑制Fz受体,阻止Wnt与Fz结合或与Fz结合但形成无功能复合物,从而阻断Wnt通路激活〔15,16〕。
Wnt通路激活时,胞质中的β-catenin不被降解并持续活化,在细胞核中积聚,在细胞失巢凋亡抵抗中发挥重要作用〔17〕。Cho等〔18〕研究发现,肺癌细胞中抑制SFRP1表达后,Wnt通路被激活,β-catenin表达增高。Gauger等〔8〕在乳腺上皮细胞中抑制SFRP1表达,发现β-catenin表达增高,从细胞质移位到细胞核并积聚。本研究得出相似的结果,发现失巢培养的GES-1中抑制SFRP1表达后,细胞核中β-catenin表达明显增多,β-catenin蛋白表达升高;抑制SFRP1表达后,c-Myc和cyclin-D1基因表达显著增高。Dai等〔19〕报道沉默c-Myc表达促进牙周韧带细胞发生失巢凋亡。Jiang等〔9〕发现肝癌细胞中过表达SFRP1可降低CyclinD1表达,抑制细胞侵袭转移。提示β-catenin的靶基因c-Myc和CyclinD1参与细胞失巢凋亡的调控,与本研究结果一致。
综上所述,本研究首次发现抑制SFRP1基因表达可降低EGS-1对失巢凋亡的敏感性,激活Wnt通路,β-catenin及其靶基因表达增高可能是其作用机制。本研究为SFRP1在胃癌发展中的作用及机制研究提供了新的思路和理论依据,提示SFRP1表达沉默诱导正常细胞获得失巢凋亡抵抗的能力。

