双标细胞因子诱导的杀伤性细胞系构建
曹卉 高元慧 郑琳麟 刘克辉 黄邓高
(中南大学湘雅医学院附属海口医院 1中心实验室,海南 海口 570208;2放射科)
近年来,恶性肿瘤的免疫治疗是肿瘤治疗研究热点。细胞因子诱导的杀伤性(CIK) 细胞是一群非组织相容性复合体(MHC)限制性的、有效抗肿瘤活性的免疫细胞〔1〕。CIK细胞在体外具有较高的肿瘤细胞毒活性、广谱的肿瘤靶点和对正常组织的低毒作用,且其对部分肿瘤有确切疗效,目前在临床过继免疫治疗中有广泛应用〔2~4〕。研究显示〔5〕,CIK细胞能够作为一种细胞载体作用于肿瘤组织。通过体内观察CIK细胞的增殖、分布、靶向等生物学行为可以为研究CIK细胞抗肿瘤作用机制提供一些线索。然而,自体CIK治疗效果仍不尽人意,具体作用机制仍不明确,体内实时动态观察CIK细胞的作用效应仍然是目前研究的难点。
荧光素酶(Luc)是目前应用最广泛的活体生物发光成像报告基因之一,Luc标记的生物发光现象可在活细胞内被观测,且发光强度与标记细胞的数目呈正比,用其标记细胞后,通过活体成像系统可直接观察标记细胞在小动物体内的生长、转移等情况〔6,7〕。本研究拟构建Luc-GFP-CIK细胞系,为进一步探讨小鼠体内观察CIK细胞治疗肿瘤,标记细胞的分布及靶向示踪提供细胞来源,为肿瘤治疗的机制研究提供理论依据。
1 材料与方法
1.1 实验动物 SPF级雌性C57BL/6小鼠(广东省医学动物中心,SCXK(粤)2013-0002),6~8 w,体重18~22 g。
1.2 细胞及主要试剂及仪器 293T细胞(中科院上海细胞所),胎牛血清(FBS,BI公司);无血清RPMI1640培养基(BI公司);重组人干扰素(IFN)-γ、重组人白细胞介素(IL)-2、重组人IL-1α均购自上海生工;CD3 单克隆抗体(广州BD公司);抗小鼠CD3-FITC抗体、抗小鼠自然杀伤(NK)1.1-PE抗体(广州BD公司);萤火虫Luc底物(美国,Caliper公司);手持细胞计数器(加拿大,Intelligent-Nano公司);细胞培养箱(美国,Thermo);实时定量PCR仪(瑞士,罗氏公司);荧光倒置显微镜(日本Olympus公司);流式细胞仪(美国,BD公司);小动物成像系统IVIS Spectrum(美国,PE公司);引物由上海捷瑞生物科技有限公司合成;测序工作由南京思普金生物科技有限公司完成。
1.3 脾细胞分离 采用断颈法处死小鼠,置于75%乙醇中浸泡3 min,小鼠移至超净台无菌平皿中,剖开皮肤层,酒精棉球擦拭肌肉层,挑起肌肉层剪开后用止血钳固定,暴露并取出脾脏,在无菌磷酸盐缓冲液(PBS)中去除脂肪及膜组织,剪切并碾碎脾脏组织,无血清1640培养基重悬后,过筛网(400目)收集滤过液,加入3倍体积红细胞裂解液,室温静置5 min,2 000 r/min离心10 min,弃上清,加入6 ml完全培养基(1640培养基+10%FBS+1%青链霉素),重悬细胞,2 000 r/min离心10 min,弃上清,加入2 ml完全培养基重悬细胞并计数。
1.4 CIK细胞培养 按2×106个/ml将细胞接种于3.5 cm培养皿中,加入1 000 U/ml重组人IFN-γ后置于5% CO2培养箱中37℃培养;24 h后加入50 ng/ml CD3单克隆抗体、300 U/ml重组人IL-2和100 U/ml的重组人IL-1α;每3天半量换液并补加重组人IL-2;第14天收获CIK细胞。
1.5 CIK细胞表型检测 取1×105个CIK细胞,加入抗小鼠CD3-FITC抗体、抗小鼠NK1.1-PE抗体,4℃避光孵育15 min后,1 000 r/min离心5 min,PBS洗3次,离心、弃上清,加入200 μl固定液,上流式细胞仪进行检测、分析,鉴定CIK细胞。
1.6 目的基因获得 根据Luc的DNA序列和pCD513B-1的MCS位点,设计特异性PCR引物,Luc正义引物:5′-CCGGAATTCGCCACCATGACTTCGAAAGT TTATGATCCAG-3′,Luc反义引物:5′-CGCGGATCCTCATTGTTCATTTTTGAGAACTCGC-3′,扩增片段1 144 bp。
1.7 pCD513B-1-Rluc的构建与鉴定 20 μl体系下37℃反应过夜,EcoR Ⅰ和BamH Ⅰ双酶切pCD513B-1载体,通过T4 DNA连接酶,将PCR产物与双酶切后pCD513B-1质粒的10 μl体系在22℃条件下反应16 h。取10 μl连接产物转入200 μl新鲜制备的感受态细菌中,冰浴1 h,42℃热激90 s,冰浴5 min,加入600 μl 37℃预热的LB培养液,于37℃、220 r/min振摇1 h,离心后全部涂于含50 μg/ml Amp的LB平板,37℃倒置培养过夜。随机挑取4个菌落增菌培养后抽提质粒PCR扩增。反应结束后,取10 μl产物进行琼脂糖凝胶电泳鉴定。菌落经PCR鉴定为阳性克隆者进行测序,测序验证后进行后续实验。
1.8 病毒的包装与检测 转染前24 h,将处于对数生长期293T细胞用无抗生素DMEM+10%FBS重悬后接种6孔板,2 ml/孔。待第2天细胞密度达到80%~90%融合度时,用配置好的质粒与脂质体混合物对6孔板中液体进行半量换液。培养 6~10 h后,弃掉含有DNA-脂质体复合物的培养基,以正常培养液DMEM+10%FBS进行换液并从此刻开始计算转染时间。转染24 h后,荧光显微镜下观察转染效率;转染48 h后收集细胞上清液,3 000 r/min离心20 min,去除细胞沉淀,0.45 μm滤器过滤,2 000 r/min离心浓缩后分装于-80℃贮存。取其中一支病毒液1 μl加入已接种293T细胞的3.5 cm小皿中,6 h后半量换液,过夜后全量换液,24 h后荧光显微镜下检测并计算病毒滴度。根据表达GFP的293T细胞数目计算实验组和对照组的病毒滴度。
1.9 CIK细胞病毒感染、筛选及单克隆化 取第14天CIK细胞,加入病毒颗粒(MOI=3),37℃培养6 h后半量换液,37℃培养过夜后全量换液。继续培养24 h,检测到荧光表达后加入嘌呤霉素(终浓度1.2 μg/ml)培养24 h,小心吸取上层细胞至新培养皿中37℃培养,3 d后计数并稀释至10个细胞/ml,按100 μl/孔加至96孔板中继续培养(完全培养基+300 U/ml重组人IL-2),6 d后吸取状态较好的细胞转移至3.5 cm培养皿中继续培养(约12 d逐渐长满,期间每3 d半量换液并补加重组人IL-2),待细胞长满后进行Luc活性检测。
1.10 Luc活性测定 取感染后的细胞2×106个离心弃上清,用新鲜配置含有底物的200 μl完全培养基重悬细胞,吹打均匀,将200 μl细胞悬液接种至96孔板中,进行等比稀释。室温静止5 min,在Xenogen IVIS Spectrum 成像系统中采集图像。
2 结 果
2.1 脾脏CIK细胞的培养与鉴定 脾脏单个核细胞在多种细胞因子作用下均处于增殖状态,培养前3 d细胞小,数量少;第6天开始细胞数量开始倍增,镜下可见细胞饱满、聚集成团,呈集落样生长;随着时间的延长,集落数增多,细胞呈簇状生长,见图1。实验取第14天细胞。
2.2 CIK细胞表型检测结果 新鲜脾脏细胞由0.054% CD3+NK1.1-,0.000%CD3-NK1.1+,0.140% CD3+NK1.1+组成;第3天由2.120% CD3+NK1.1-,0.420%CD3-NK1.1+,2.640% CD3+NK1.1+组成;第7天由6.100% CD3+NK1.1-,0.860%CD3-NK1.1+,9.240% CD3+NK1.1+组成;第14天由23.400% CD3+NK1.1-,4.190%CD3-NK1.1+,43.000% CD3+NK1.1+组成,见图2。
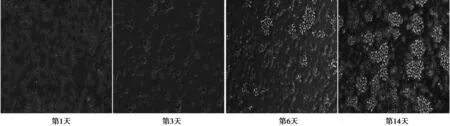
图1 CIK细胞培养结果(×200)

图2 CIK细胞表型鉴定结果
2.3 慢病毒表达载体的酶切鉴定及测序结果 载体pCD513B-1用EcoR Ⅰ和BamH Ⅰ进行双酶切,PCR扩增,得到一条约1 100 bp的条带(图3),选取阳性克隆进行测序,结果与Luc序列一致。
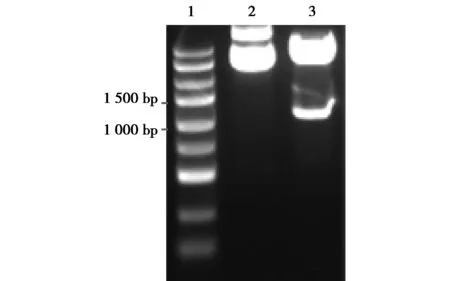
1.DNA Maker;2.未经酶切;3.双酶切后图3 载体酶切电泳
2.4 病毒感染结果 慢病毒感染24 h后,荧光显
微镜下实验组及单克隆株组CIK细胞均表达GFP,实验组细胞GFP表达水平高于单克隆株组细胞,见图4。
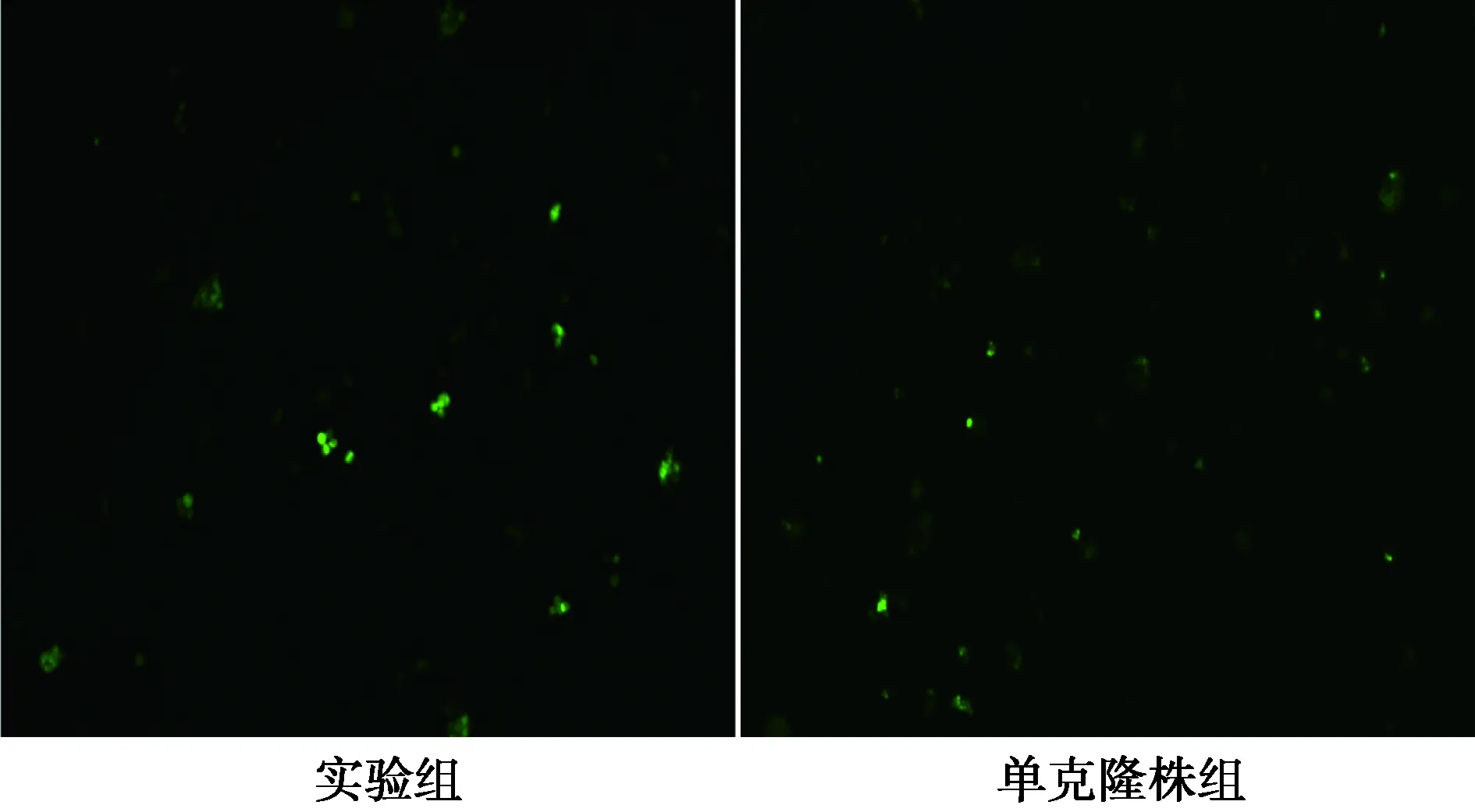
图4 重组慢病毒感染CIK细胞后GFP表达的镜下结果(×100)
2.5 Luc活性测定 活体成像系统下,检测到实验组生物发光信号随着细胞数量的减少,发光强度下降,见图5。
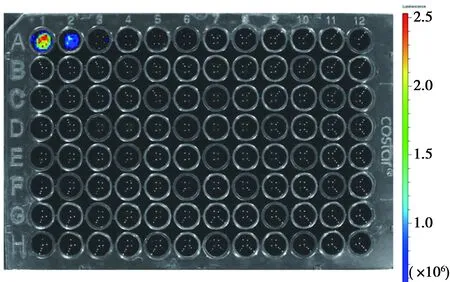
A1孔接种细胞1×106个,A2孔接种细胞5×105个图5 重组慢病毒感染CIK细胞后活体成像系统下Luc发光检测
3 讨 论
过继免疫疗法是通过回输体外扩增并激活的免疫细胞,如CIK、NK细胞及肿瘤浸润淋巴细胞,以消除肿瘤细胞的一种方法〔8,9〕。有研究显示,CIK细胞可通过体外培养外周血单个核细胞并定期添加CD3抗体及细胞因子IFN-γ、IL-2培养超过2 w来获得〔9〕。CIK细胞是一种异质细胞群,本实验从小鼠脾脏组织成功分离培养CIK细胞,通过流式细胞检测技术鉴定显示其构成比例主要由CD3+CD56+和CD3+CD56-及少部分CD3-CD56+细胞组成,与已报道文献一致〔10〕。本次培养脾脏来源的CIK细胞,细胞量大,增殖速度快,第6天开始细胞数量开始倍增,聚集成团,呈集落样生长,2 w左右即可获得所需的实验细胞。CIK有较好的临床应用前景,但大多侧重于患者生存期的比较,具体的作用机制和临床应用尚未明确。CIK是如何归巢并作用于肿瘤细胞、如何产生抗肿瘤效应鲜见报道。Kim等〔11〕在体外利用延时成像的方法对杀死单个肿瘤细胞所需的CIK细胞数量进行检测,为肿瘤患者CIK细胞免疫治疗的合理设计提供线索,提出在体内优化CIK细胞的活性并使其归向肿瘤微环境可能是增加效应细胞数量的关键。徐赞美等〔12〕采用Ad5F11p-GFP 对CIK和NK细胞进行转染,探讨了转染效率及转染后细胞生物学特性的变化。但上述的课题组未进行动物体内研究,无法证实在体内CIK细胞的杀瘤活性是否与体外一致。另有学者报道〔13〕,利用表达GFP及Luc的肝癌细胞株构建肝癌动物模型,通过对发光的肝癌细胞数量的检测来间接评价CIK细胞在体内外的杀瘤活性。这种方法在体内能够对标记的肿瘤细胞进行直观观察,并测量体内肿瘤的大小来侧面评价CIK细胞的活性。提示GFP及Luc可同时标记于同一细胞,可通过活体成像系统在体内实时追踪和观察。
普通细胞没有光学特性,移植入动物体内不可观察。通过体外特异性标志物标记后的细胞能够实现活体内成像。小动物活体成像技术主要包括生物发光和荧光两种技术,使用生物发光成像的技术来进行发光验证,主要原因为:生物发光成像避免了动物本身自发荧光的干扰,这一技术利用Luc标记细胞或遗传物质,加入底物荧光素后可以发生生物化学反应,利用小动物活体成像进行生物发光信号的采集。有报道〔14〕将转基因小鼠GFP+C57BL/6与Luc+FVB-L2G85进行回交,取第十代B6-L2G85小鼠的脾脏进行原代培养,能够获取同时表达GFP及Luc的CIK细胞,并且在体内对CIK细胞的移植物抗宿主病(GVHD)的作用展开了深入研究。实验中通过转基因小鼠进行操作获取GFP-Luc-CIK细胞,转基因小鼠价格昂贵,不容易获取,并且需要有专业的遗传背景知识进行指导,操作难度大、周期长。本次实验在体外利用慢病毒感染的方式对CIK细胞进行标记,成本较低,操作简便、周期较短,或许可以作为替代实验解决转基因小鼠获取困难、成本很高、操作复杂这一难题。CIK细胞具有体外易于扩增、对各种肿瘤细胞的非MHC限制的杀伤活性等优点而备受关注〔15~17〕。本实验构建的Luc-GFP-CIK细胞株能够解决研究条件有限不能从转基因鼠获取源细胞的问题,为小动物体内实时、动态观察CIK细胞的分布及靶向治疗肿瘤、评价CIK细胞的杀瘤活性提供细胞来源。

