衰老对大鼠肠道组织形态及自噬水平的影响
秦廷洋 代军 马晓春 赵宇艳 徐磊 张仕斌
(遵义医学院实验动物中心,贵州 遵义 563000)
肠道是机体吸收营养物质的主要器官,同时也是阻挡细菌、病毒等有害物质进入机体的有效屏障。衰老过程中肠道是机体起始衰老的器官之一,肠道组织退行性变、炎症反应增加,肌层增厚,肠收缩蠕动减弱,各种消化酶水平下降,导致小肠消化吸收功能减退,经常出现慢性便秘、排便障碍等症状〔1〕。研究发现,自噬与多种老年病密切相关,在年老组织中,自噬相关蛋白(Atg)等自噬诱导必需的蛋白表达下调,自噬活性随着年龄增长逐渐降低〔2〕。在正常老年大脑中,Atg5、Atg7 和Beclin1表达均下调,胰岛素抵抗和代谢综合征患者体内沉默信息调节因子(SIRT)1表达下调,而骨关节炎中靶向自噬启动因子(ULK)1、Beclin1和微管相关蛋白1轻链(LC)3表达下调,表明衰老与自噬活性不足有关,进一步研究发现,活化自噬确实具有抗衰老和延长寿命的作用,在小鼠中过表达自噬小体形成过程中的关键蛋白 Atg5 能使小鼠寿命延长17.2%,诱导小鼠自噬活化表现出抗衰老表型,如瘦体型、胰岛素敏感性增强、运动能力提高等〔3〕。目前通过自噬调节延缓机体衰老已成为广泛学者的研究热点,但肠道作为机体重要的组织器官,肠道组织衰老概况研究甚少,衰老过程中组织自噬水平变化尚处于未知,本试验旨在测定衰老过程中大鼠肠道组织的形态变化及肠道组织自噬标志物LC3-Ⅱ表达情况,分析肠道组织自噬水平变化与肠道退行性变的内在联系。
1 材料与方法
1.1 动物饲养管理 选取200~240 g雄性SD大鼠16只,自由采食,于5月龄时,采集8只大鼠肠道组织样品作为青年组;于24月龄时,采集8只大鼠肠道组织样品作为老龄组。
1.2 样品采集 大鼠腹部取十二指肠、回肠、结肠中段约3 cm,用生理盐水冲洗干净,迅速放在4%多聚甲醛中摇匀固定24~48 h。固定好后,制作成石蜡切片,参照徐戬等〔4〕阐述的方法制作组织切片。取十二指肠、回肠、结肠中段约3 cm,将组织剪成细小的碎片,按每20 mg组织加入 150~250 μl裂解液的比例加入裂解液(裂解液中加入蛋白酶和磷酸酶抑制剂),匀浆器匀浆直至完全裂解。裂解后的样品4℃ 12 000 r/min离心 15 min,取上清,进行蛋白质定量后贮于-80℃冰箱,Western印迹测定组织LC3-Ⅱ表达量。显微镜拍照观察,用Olympus摄影显微镜进行图像采集,用影像分析软件Image-Pro Plus5.02分析图片,测定各个肠段绒毛高度、隐窝深度及绒毛高度/隐窝深度比值;Image1.8分析各组图像灰度值。
1.3 主要试剂 LC3-Ⅱ与GAPDH抗体均由BIOSWAMP公司提供。
1.4 统计学分析 采用SPSS19.0软件行t检验。
2 结 果
2.1 两组肠道组织形态变化 老龄组十二指肠、回肠和结肠绒毛较青年组显著萎缩变短(P<0.05),十二指肠与结肠隐窝深度显著缩短,回肠和结肠绒毛高度与隐窝深度比值显著变小(均P<0.05),老龄组肠道绒毛短小且破碎较多,整体表现为衰老,萎缩的状态。见表1,图1。
2.2 两组肠道组织LC3-Ⅱ表达量 老龄组肠道组织LC3-Ⅱ表达量(0.84±0.06)较青年组(0.60±0.15)显著升高(P<0.05),见图2。
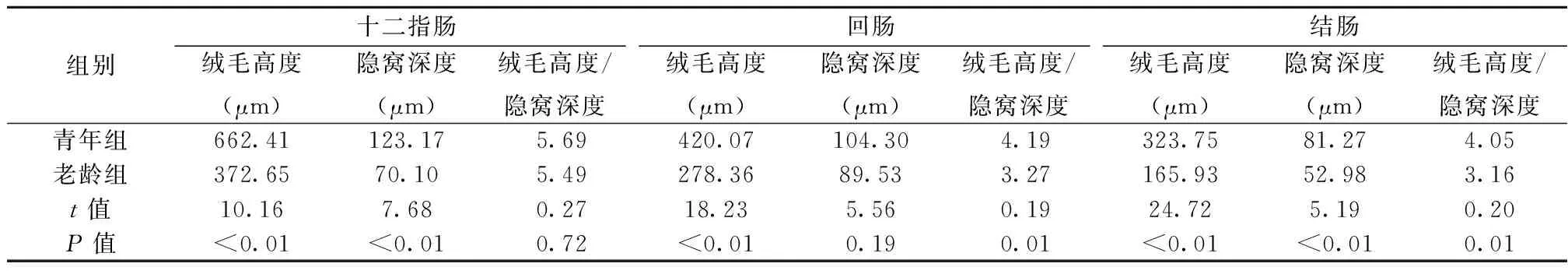
表1 两组肠道形态比较(n=8)
同行间无相同字母表示差异显著(P<0.05)

图1 两组肠道组织切片(×100)
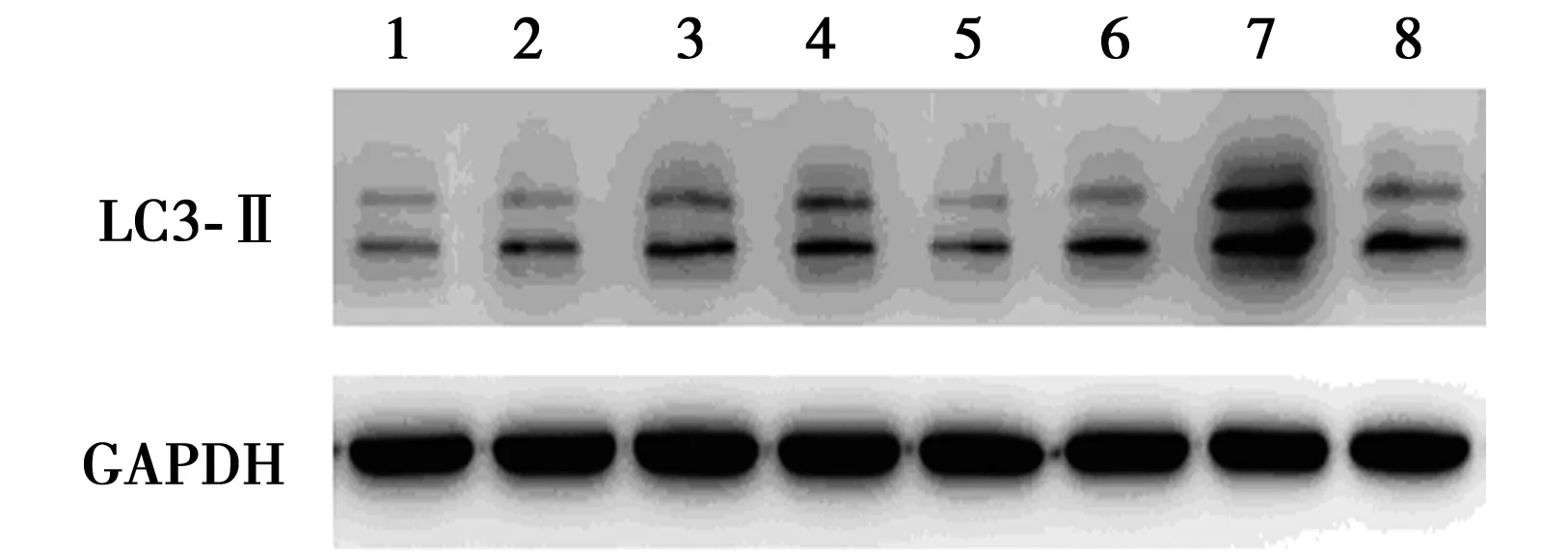
1~4泳道为青年组,5~8泳道为老龄组图2 青年大鼠与老龄大鼠肠道LC3-Ⅱ的表达量
3 讨 论
肠道衰老伴随老年性肠道疾病的发生,自噬调节是缓解机体衰老的重要途径。老年人的消化功能及吸收功能的减退由老年人胃肠道在组织学上的退行性变导致,研究发现,衰老与肠道关系为机体衰老出现胃分泌减少,肠道菌群种类减少,肠道渗透性增强,引起肠道功能障碍及肠道慢性炎症等的发生,严重情况下会演变成炎症性疾病或使胃肠功能丧失〔5〕。老年人肠动力障碍是由肠道细胞功能紊乱所致,研究发现,Cajal间质细胞(ICC)分布于整个消化道,是胃肠道节律性活动的起搏点,在胃肠道动力的发生和动力障碍机制中具有重要作用〔6〕,ICC数量在老年大鼠消化道中显著减少,便秘患者肠道动力障碍的重要原因是ICC数量减少和分布异常〔7〕,老年人肠道ICC功能减退可能导致肠道发生动力障碍;在大鼠生理性衰老过程中,胃肠组织中的一氧化氮合酶(NOS)随年龄的增加而逐渐减少,氮能神经体系的衰老可能导致老年慢性便秘。自噬是广泛存在于真核细胞中高度保守的一种溶酶体依赖性降解系统〔8〕,主要包括自噬诱导阶段(由mTOR等信号转导通路介导〔9〕)、核化阶段(Vps34-Atg6/Beclin1等参与此过程〔10〕)、延伸阶段(由Atg5、Atg12、Atg16 和Atg8/LC3 调控〔11〕),自噬过程中自噬小体与溶酶体融合形成自噬溶酶体,自噬溶酶体将包裹物和内膜一起降解〔12〕。自噬与多种老年病都有密切关系,包括神经退行性疾病、肿瘤、心血管疾病、代谢性疾病等。研究发现,自噬小体在多种神经退行性疾病,包括阿尔茨海默病(AD)、帕金森病(PD)、亨廷顿病及肌萎缩性侧索硬化患者的大脑中堆积,提示自噬可能参与其中〔13〕。家族遗传型PD患者中,PTEN基因诱导假定激酶(PINK)-1 和 Parkin 突变导致线粒体自噬受阻,受损线粒体和ROS大量堆积对神经元造成损伤,自噬能清除错误折叠及易形成聚集倾向的突变蛋白,因此活化自噬对神经退行性疾病的治疗前景已得到充分证实〔13〕。自噬在肿瘤中的作用是一把“双刃剑”,自噬能促进原癌基因诱导的老化反应,预防细胞恶性转化;自噬抑制肿瘤转移,对于原位的肿瘤细胞来说, 自噬通过抑制坏死及促炎免疫细胞浸润或直接促进抗转移免疫因子高迁移率族蛋白(HMG)B1释放而抑制肿瘤转移〔14〕。另一方面,自噬也能促进肿瘤的发生,自噬能维持肿瘤细胞快速增长的营养需求,活化促进肿瘤转移,促进肿瘤细胞对化疗、放疗及肿瘤靶向治疗产生抵抗〔15〕。自噬参与心血管疾病调节,年龄增大,心脏功能下降,在缺血阶段,心肌细胞自噬的增强可为细胞提供能量,清除损伤的线粒体,抑制线粒体途径介导的细胞凋亡,从而对心肌产生保护作用。然而细胞的自噬活性进一步增强时,过度活化的自噬可能导致心肌细胞死亡,加剧心肌细胞损伤〔16〕。自噬参与多种老年性疾病的发生,在肠道退行性变过程中,肠道组织自噬可能是调节肠道衰老的重要途径。
自然衰老过程中大鼠肠道组织显著萎缩,自噬流受阻可能加剧老龄大鼠肠道衰老。LC3-Ⅱ是哺乳动物细胞中酵母Atg8基因的同源物,定位于自噬泡和自噬膜表面,参与自噬体的形成,是自噬小体的特异性标志分子。正常情况下,细胞内合成的LC3经过加工,成为胞质可溶性的LC3-Ⅰ,LC3-Ⅰ经过泛素样加工修饰,与自噬膜表面的磷脂酰乙醇胺结合,形成LC3-Ⅱ并聚集到自噬体膜上,其含量的多少与自噬泡数量的多少呈正比,因此可反映自噬活性〔17〕。LC3-Ⅱ本身可以通过自噬降解,LC3-Ⅱ升高除了表示自噬小体生成增多、自噬活性增强外,还可以因为自噬小体降解减少引起积聚,造成自噬活性升高的假象,因此,LC3-Ⅱ升高也可能是由于自噬流下游受阻,导致LC3-Ⅱ聚集。本研究结果提示自噬流受阻可能加剧老龄大鼠肠道退行性变,提高肠道组织自噬水平可能是缓解肠道老年性疾病的有效途径。
肠道自噬调节可能是治疗老年性肠道疾病的重要途径。自噬是衰老过程中的重要调节机制〔18〕,随着年龄增长,生物体细胞内损伤的大分子和细胞器逐渐堆积,错误折叠蛋白增多导致老年病多发,而活化自噬可以清除细胞内损伤的蛋白和细胞器,从而改善机体衰老状态,研究还发现,自噬和凋亡性细胞死亡途径之间可能存在复杂的相互作用,自噬与凋亡之间的相互作用也可能是自噬缓解衰老的重要原因〔19〕。总之,肠道衰老可能是造成老年性肠道疾病的主要原因,自噬在老龄大鼠肠道组织中显著变化,自噬调节可能在大鼠肠道衰老过程中有重要作用。

