LncRNA NEAT1靶向miR-520b调控口腔鳞癌细胞增殖、凋亡及自噬的分子机制
王斌 吕锦 孔敏 王虎
(1成都市第一人民医院口腔科,四川 成都 610041;2四川大学华西口腔医院放射科)
非编码RNA约占人类基因组的98%,其中包括长链非编码RNA(LncRNA)和短链非编码RNA(miRNA)〔1〕。LncRNA为长度在200个核苷酸以上的非编码RNA,miRNA的长度在19~25个核苷酸,两者均可通过转录、转录后水平及表观遗传调控基因的表达,进而参与人类多种疾病的发生发展〔2〕。自噬为真核细胞的自身降解过程,与机体衰老、神经退行性疾病、肥胖及癌症均具有密切关系〔3〕。大量研究证实,自噬在肿瘤中具有双重作用,在肿瘤的不同阶段发挥不同作用。非编码RNA核富集的转录物(NEAT)1为新发现的一种Lnc RNA〔4〕,在口腔鳞癌中的作用机制尚未完全清楚。miRNA(miR)-520b在不同癌症中发挥不同作用〔5,6〕,其在口腔鳞癌中的作用尚未完全清楚。本研究拟以口腔鳞癌细胞Tca8113为研究对象,观察抑制NEAT1、过表达miR-520b、抑制miR-520b对Tca8113细胞增殖、凋亡和自噬的影响,为口腔鳞癌的治疗提供新靶点。
1 材料与方法
1.1 材料 人口腔鳞癌细胞Tca8113、人正常口腔上皮细胞HOEC,均购自美国菌种保存中心(ATCC);达尔伯克改良伊格尔(DMEM)培养基、胎牛血清、四唑盐(MTT)、胰蛋白酶,均购自美国GIBCO公司;LipofectamineTM2000、二喹啉甲酸(BCA)蛋白定量试剂盒、逆转录试剂盒,购自大连Takara公司;聚偏二氟乙烯(PVDF)膜购自德国罗氏诊断有限公司;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)试剂盒、电化学发光(ECL)发光液和RIPA蛋白裂解液,均购自碧云天生物技术公司;双荧光素酶报告基因检测试剂盒,购自美国Promega公司;Annexin V-FITC/PI凋亡检测试剂盒购自北京索莱宝公司。
1.2 方法
1.2.1 细胞培养 用含10%胎牛血清的DMEM培养基培养Tca8113、HOEC,置于37℃、5% CO2的培养箱中常规培养。
1.2.2 细胞转染 将si-NC、si-NEAT1、miR-520b mimics、miR-NC、si-NEAT1+anti-miR-NC、si-NEAT1+anti-miR-520b按照脂质体LipofectamineTM2000说明书操作步骤要求转染至Tca8113细胞,分别标记为si-NC组、si-NEAT1组、miR-520b组、miR-NC组、si-NEAT1+anti-miR-NC组、si-NEAT1+anti-miR-520b组,转染48 h后,采用qRT-PCR实验检测转染效率。转染成功后,用于后续试验。
1.2.3 qRT-PCR实验 取适量对数生长期1.2.2各组细胞,遵照RNA抽提试剂盒说明书要求提取RNA,进行定量,然后应用逆转录试剂盒按照说明书操作合成cDNA。最后按照qRT-PCR试剂盒说明书检测miR-520b、NEAT1。用2-△△Ct计算miR-520b、NEAT1的表达水平。
1.2.4 MTT实验 取适量1.2.2各组细胞,加入5 g/L的MTT溶液20 μl,培养4 h,然后弃去上清,每孔加入150 μl DMSO,震荡,使结晶溶解,在490 nm波长下检测细胞吸光度(A)。细胞的增殖力与细胞活力呈正比。
1.2.5 Annexin V-FITC/PI流式细胞术实验 取适量1.2.2各转染组细胞,用结合缓冲液500 μl悬浮细胞,分别加入5 μl的 Annexin V-FITC和PI,混匀,室温避光静置15 min。采用流式细胞仪分析结果。细胞的凋亡率(%)= 早期凋亡率+晚期凋亡率。每个样品重复3次。
1.2.6 Western印迹实验 收集1.2.2各组细胞,加入裂解液,冰上裂解30 min。12 000 r/min离心10 min,。取上清置于EP管,加入5倍SDS上样缓冲液,沸水煮沸10 min。电泳后用转膜仪将蛋白转移至PVDF膜;5%脱脂奶粉将膜封闭2 h,洗膜,加入一抗,4℃过夜孵育,洗膜,加二抗,4℃ 2 h。加发光液,曝光。
1.2.7 双荧光素酶报告基因检测实验 取适量对数生长期1.2.2各组细胞,遵照双荧光素酶报告基因检测试剂盒技术手册要求操作。psiCHECK2载体以萤火虫荧光素酶活性为内参,psiCHECK2-NEAT1-3′UTR WT和psiCHECK2-NEAT1-3′UTR MUT的表达为对照,转染24 h后,检测荧光强度。海参荧光素酶的发光强度与萤火虫荧光素酶发光强度的比值即反映miR-520b与NEAT1的结合力。
1.3 统计学处理 采用SPSS21.0软件,计量资料多组间比较采用单因素方差分析,两两比较采用SNK-
q检验。
2 结 果
2.1 NEAT1和miR-520b在人口腔鳞癌细胞Tca8113中的表达 与HOEC组相比,Tca8113组细胞中NEAT1表达显著升高,miR-520b表达显著降低(P<0.05)。见表1。
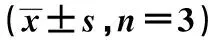
表1 NEAT1和miR-520b在Tca8113细胞和HOEC细胞中的表达
2.2 抑制NEAT1对Tca8113细胞增殖、凋亡的影响 与si-NC组相比,si-NEAT1组Tca8113细胞中NEAT1表达显著降低,48、72 h时细胞活性显著降低,细胞凋亡率显著升高(P<0.05)。见表2。
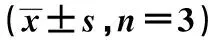
表2 抑制NEAT1表达对Tca8113细胞增殖和凋亡的影响
2.3 抑制NEAT1表达对Tca8113细胞自噬的影响 与si-NC组(0.36±0.04)相比,si-NEAT1组Tca8113细胞中LC3Ⅱ/Ⅰ蛋白表达量(1.07±0.08)显著升高(t=13.749,P=0.000)。见图1。
2.4 过表达miR-520b对Tca8113细胞增殖、凋亡和自噬的影响 与miR-NC组相比,miR-520b组Tca8113细胞中miR-520b表达显著升高,48、72 h时细胞活性显著降低,细胞凋亡率显著升高,LC3Ⅱ/Ⅰ蛋白表达量显著升高(P<0.05)。见表3,图2。

图1 抑制NEAT1表达对Tca8113细胞自噬相关蛋白LC3Ⅰ、Ⅱ表达的影响
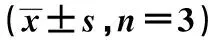
表3 过表达miR-520b对Tca8113细胞增殖、凋亡和自噬的影响
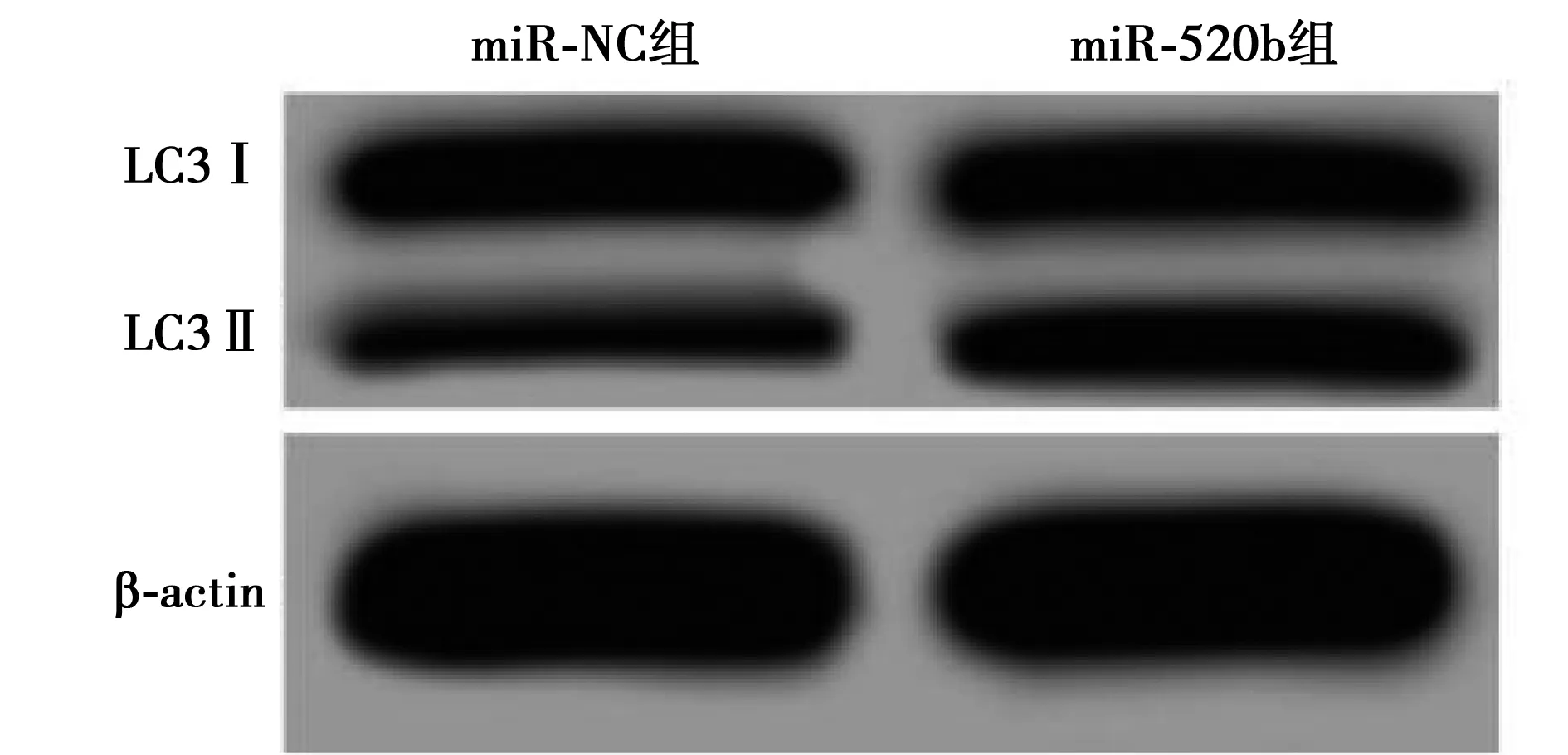
图2 过表达miR-520b对Tca8113细胞LC3Ⅱ、Ⅰ表达的影响
2.5 NEAT1靶向miR-520b 运用miRcode数据库预测到miR-520b与NEAT1 3′UTR存在结合位点(图3);双荧光素酶活性检测结果显示,与miR-NC组相比,miR-520b组WT-NEAT1细胞中荧光活性显著降低(miR-NC组:1.02±0.08,miR-520b组:0.41±0.05;t=11.199,P=0.000),MUT-NEAT1细胞中荧光活性不受影响(miR-NC组:1.04±0.07,miR-520b组:0.98±0.09;t=0.912,P=0.414)。与pcDNA组(0.45±0.04)比较,pcDNA-NEAT1组miR-520b水平(0.21±0.03)显著降低(P<0.05);与si-NC组(0.42±0.05)比较,si-NEAT1组miR-52b水平(1.04±0.06)显著升高(P<0.05)。
2.6 抑制miR-520b和抑制NEAT1对Tca8113细
胞增殖、凋亡和自噬的影响 与si-NEAT1+anti-miR-NC组相比,si-NEAT1+anti-miR-520b组Tca8113细胞在48、72 h细胞活性显著升高,细胞凋亡率显著降低,LC3Ⅱ/Ⅰ蛋白表达量显著降低(P<0.05)。见图4,表4。

图3 NEAT1的3′UTR中含有与miR-520b互补的核苷酸序列

1~4分别为:si-NC;si-NEAT1;si-NEAT1+anti-miR-NC;si-NEAT1+anti-miR-520b图4 LC3Ⅰ、LC3Ⅱ蛋白表达
表4 抑制miR-520b和抑制NEAT1对口腔鳞癌Tca8113细胞增殖、凋亡和自噬的影响
3 讨 论
NEAT1在许多人类癌症中起关键作用〔7,8〕,与机体多种疾病的发生发展密切相关〔9〕。大量研究证实,自噬在人类的多种肿瘤中存在异常,发挥抑制或促进肿瘤的作用〔10~12〕。Liu等〔13〕在口腔鳞状细胞癌中的研究发现,与邻近的非肿瘤组织和正常口腔角质形成细胞相比,鳞癌组织和细胞系中NEAT1的表达显著升高,且与患者的晚期临床分期和较短的存活时间显著相关,抑制NEAT1表达导致鳞癌细胞迁移和侵袭显著减少,伴随着基质金属蛋白酶(MMP)-2和MMP-9蛋白表达的减少,miR-365的抑制消除了敲低NEAT1对鳞癌细胞迁移和侵袭的抑制作用,提示NEAT1通过抑制miR-365促进OSCC细胞的迁移和侵袭,NEAT1可能为治疗鳞癌的潜在靶点。Huang等〔14〕研究发现,NEAT1在口腔鳞状细胞癌中表达异常升高,且可负向调控低表达的miR-365,敲除NEAT1可抑制细胞增殖和侵袭并诱导细胞周期停滞在G0/G1期和细胞凋亡,而抑制miR-365消除了敲低NEAT1对细胞过程的抑制作用,且 RGS20是miR-365的直接靶标,可通过增强细胞活力和运动性逆转过表达miR-365的肿瘤抑制作用,此外,RGS20、细胞周期蛋白D1、E-钙黏蛋白、N-钙黏蛋白和波形蛋白的表达可通过NEAT1/miR-365通路调节,沉默NEAT1也可抑制体内肿瘤生长,揭示了NEAT1/miR-365/RGS20通路可能是OSCC治疗的新策略。本研究结果发现,Tca8113细胞中NEAT1表达显著升高,且抑制NEAT1可抑制Tca8113细胞增殖、促进凋亡,这与Liu等〔13〕、Huang等〔14〕的研究结果相一致;进一步研究发现,抑制NEAT1能促进Tca8113细胞的自噬。
miRNA失调或功能障碍会促进或抑制癌症的发展〔15,16〕。miR-520b在多种肿瘤中表达异常,其在卵巢癌中发挥促癌作用〔17〕,在膀胱癌中发挥抑癌作用〔18〕。梁雪〔19〕研究发现,miR-520b可促进食管鳞癌细胞和乳腺癌细胞的自噬,且过表达miR-520b可抑制肿瘤细胞的增殖、迁移和侵袭。Jin等〔20〕发现,miR-520b过表达明显抑制了体外肺癌细胞增殖,抑制miR-520b能够加速肺癌细胞的增殖,敲低HDAC4逆转了抑制miR-520b诱导的细胞增殖,且在临床人肺癌样品中观察到miR-520b和HDAC4之间的负相关,提示MiR-520b降低HDAC4表达以控制肺癌细胞的增殖。Cui等〔21〕发现miR-520b在胶质瘤组织和细胞中低表达,且miR-520b可抑制胶质瘤细胞的葡萄糖代谢、侵袭、血管生成和化学敏感性,其机制与直接靶向负调控MBD2有关,提示miR-520b在胶质瘤中具有肿瘤抑制剂的作用。Lu等〔22〕在头颈癌的研究中发现,miR-520b可通过上皮-间质转化机制抑制癌细胞迁移和侵袭,并增加癌细胞对药物和辐射治疗的敏感性,其机制与miR-520b靶向调控CD44有关,提示miR-520b为难治性HNC治疗的新靶标。本研究发现,miR-520b在口腔鳞癌细胞中表达异常降低;进一步研究发现,过表达miR-520b可抑制Tca8113细胞增殖,促进凋亡和自噬;双荧光素酶报告基因检测实验验证,NEAT1靶向负调控miR-520b,且抑制miR-520b可逆转抑制NEAT1对Tca8113细胞的增殖抑制和凋亡促进作用。综上所述,NEAT1可促进口腔鳞癌细胞的增殖并抑制凋亡和自噬,其机制可能与靶向调控miR-520b有关,为口腔鳞癌的诊断、预防和治疗提供了新的靶点。

