‘黔核5号’核桃叶片多酚组分及含量差异分析
陆胜波 张文娥 史斌斌 潘学军


摘要:核桃多酚是对人体有益的功能活性物质,常在医疗保健等方面发挥重要作用。以贵州省广泛栽培的优良品种‘黔核5号’为材料,测定其叶片中多酚组分及含量状况,为合理开发利用核桃多酚提供理论依据。采用紫外分光光度法测定总酚、总黄酮,测得总酚、总黄酮含量为179 mgGAE-1FW。采用高效液相色谱法(HPLC)测定多酚组分及含量,测定7种酚酸:没食子酸、绿原酸、咖啡酸、对香豆酸、阿魏酸、丁香酸、丁香醛,4种黄酮类:儿茶素、槲皮素、杨梅素、芦丁,1种萘醌:胡桃醌。其中绿原酸和芦丁含量分别为12604 mg-1FW之间。绿原酸和芦丁是核桃叶片的主要多酚物质。
关键词:叶片;HPLC;多酚;绿原酸;芦丁
中图分类号:S6641
文献标识码:A
文章编号:1008-0457(2019)06-0054-04国际DOI编码:10.15958/j.cnki.sdnyswxb.2019.06.009
Analysis of Polyphenols Composition and Content Difference in Leaves of ‘Qianhe5’Juglans sigillata Dode
LU Sheng-bo,ZHANG Wen-e*,SHI bin-bin,PAN Xue-jun
(College of Agriculture/ Guizhou Engineering Research Center for Fruit Crops,Guizhou University,Guiyang,Guizhou 550025,China)
Abstract:Walnut polyphenols are useful functional substances for the human body and often play an important role in health and medicineThe leaves of 'Qianhe5'(Juglans sigillata Dode)were used as tested materials to determine the components and content of leaves in polyphenols,which provided a theoretical basis for rational development and utilization of walnut leavesThe total phenolics and total flavonoids detected by ultraviolet spectrophotometry were 179 mg GAE-1FW,respectivelyPolyphenol components and content were analyzed by high performance liquid chromatography (HPLC),including seven phenolic acids:gallic acid,chlorogenic acid,caffeic acid,p-coumaric acid,ferulic acid,syringic acid and syringaldehyde; four flavonoids:catechin,quercetin,myricetin,rutin; as well as one naphthoquinone:jugloneThe amounts of chlorogenic acid and rutin were 12604 mg-1FW,respectively,which were significantly higher than other polyphenols components,and the remaining components were about 022 ~ 2534 mglang=EN-US>gallic acid,chlorogenic acid,caffeic acid,p-coumaric acid,ferulic acid,syringic acid and syringaldehyde; four flavonoids:catechin,quercetin,myricetin,rutin; as well as one naphthoquinone:jugloneThe amounts of chlorogenic acid and rutin were 12604 mg
贵州是我国核桃主产区之一,境内核桃资源丰富,从300 ~ 2700 m的海拔范围内都有核桃分布。根据调查,贵州核桃有4个属11个种[1],其中以鐵核桃类型为主,占核桃资源的80%以上,主要集中在黔西北地区。近10年来,贵州核桃产业发展迅速,全省的核桃种植面积近1000万亩[2],已经成为农民增收的重要产业。这主要得益于从贵州实生核桃群体中选育出了一批本地适生的优良核桃品种,如‘黔核5号’、‘黔核6号’、‘黔核7号’、‘黔核8号’系列优良品种;也发掘了一批独具特色的核桃类型,如“小米核桃”、“串核桃”等具有鲜明特点的核桃类型。在大面积生产核桃过程中,其枝、叶、青皮等附加物产量巨大,因得不到合理利用而常被废弃,不仅浪费资源还造成环境污染。
众所周知,核桃营养价值极高,拥有“长寿果”、“益智果”等美誉。核桃不仅含多种必需氨基酸、蛋白质、不饱和脂肪酸等营养物质[3-4],还含有丰富的多酚物质,多酚具有抑菌、抗肿瘤、抗氧化等功能,在食品、医药、工业等[5-6]领域发挥重要作用。核桃叶片能入药,一棵核桃大树的产叶量可达上百斤,是提取多酚物质的良好来源。贵州省核桃资源丰富,栽培过程中产生大量叶片,如能利用叶片提取植物多酚,不仅能提高核桃附加产值,也增加农民种植和管理核桃的积极性。了解核桃叶片的多酚物质状况是其开发利用的前提,因此我们以黔西北地区优良品种‘黔核5号’为材料,测定其叶片中多酚组分及含量,以期为核桃叶片合理开发利用提供参考。
1材料和方法
11材料
111试验材料
试验地为贵州大学教学农场核桃种质资源圃,试验材料为高位嫁接6年后的铁核桃(Juglans sigillata Dode)‘黔核5号’,果树生育期正处于初果期状态。
112试验设计
选取大小、长势一致的10棵核桃树,于成熟期在树冠中部外围采集结果枝基部复叶第2片小叶,分为东南西北四个方位,每个方位采集5片,每棵树20片,共200片叶,三次生物学重复。叶片用0℃冰盒带回实验室,蒸馏水洗净后迅速用液氮冷冻研碎,分装保存于-80℃超低温冰箱备用。
12方法
121主要仪器设备和药品
主要仪器:高效液相色谱仪(HPLC)(LC-15C型,日本岛津公司);紫外分光光度计(UV-2550型,日本岛津公司);高速冷冻离心机(SORVALL Stratos型,美国赛默飞公司);超声波清洗仪(KQ5200DE型,昆山超声仪器厂)。主要试剂和药品:福林-酚试剂,普通甲醇、碳酸钠、亚硝酸钠、硝酸铝、氢氧化钠均为分析纯,购自贵州凯信生物科技有限公司;色谱甲醇、没食子酸、绿原酸、咖啡酸、对香豆酸、丁香酸、丁香醛、儿茶素、杨梅素、槲皮素、芦丁、胡桃醌均购自美国Sigma公司。
122多酚物质的提取
超声波辅助提取法(参考王长雷等[7]):分别称取05 g的核桃叶片,于研钵中加入50%的甲醇水溶液10 mL;研磨至匀浆状态后转入10 mL离心管中,在50℃条件下40KHz超声辅助提取40 min,重复提取两次后合并提取液;再经4℃的高速冷冻离心机8000 r/min下离心10 min,减压浓缩至膏状;取上清液用50%的甲醇水溶液定容至10 mL,即为多酚提取液,用于总酚、总黄酮和单体酚含量的测定。
122多酚、总黄酮含量的测定
采用福林-酚法测定总酚(参考 Condehernández 等[8]):首先吸取02 mL多酚提取液于10 mL容量瓶中,接着加入04 mL福林-酚试剂,再加入25 mL 15%碳酸钠溶液,定容至10 mL;于25℃条件下水浴2 h,在765 nm的紫外分光光度计下测定吸光值。用不同浓度的没食子酸标准溶液替代多酚提取液,在相同条件下测定吸光值,并绘制没食子酸标准曲线。最后可求得总酚含量,计算结果以没食子酸当量(mgGAE瘙簚g-1FW)表示。
采用铝离子络合法测定总黄酮(参考 聂继云 等[9]):首先吸取05 mL多酚提取液于10 mL容量瓶中,加入1 mL 5%亚硝酸钠溶液,静置6 min后加入1 mL 10%硝酸铝溶液,再静置6 min后加入3 mL 4%氢氧化钠溶液;定容后于25℃条件下水浴15 min,在510 nm处测定吸光值。根据不同浓度芦丁标准溶液替代多酚提取液,在相同条件下测得吸光值并绘制标准曲线。最后可求得总黄酮含量,计算结果用芦丁当量mgRE
123多酚组分及含量的测定
采用高效液相色谱法(HPLC)测定多酚组分及含量:LC-15C型高效液相色谱仪,带自动进样器,色谱柱为Agilent C18(250 mm × 46 mm,5 μm)。流动相A和B分别为08%乙酸、色谱甲醇;多酚提取液用022 μm滤膜过滤,进样量10 μL,柱温25℃,流速09 r/min。两种梯度洗脱法[10],梯度 1:0 ~ 10 min,10% ~ 20% B;10 ~ 25 min,20% ~ 50% B;25 ~ 35 min,50% B;35 ~ 40 min,50% ~ 55% B;40 ~ 45 min,55% ~ 10% B,检测波长为 280 nm,用于没食子酸、绿原酸、咖啡酸、对香豆酸、阿魏酸、丁香酸、丁香醛、儿茶素的测定。梯度 2:0 ~ 10 min,10% ~ 40% B;10 ~ 25 min,40% ~ 60% B;25 ~ 35 min,60% ~ 80% B;35 ~ 45 min,80% ~ 10% B,检测波长为 251 nm,用于杨梅素、槲皮素、芦丁、胡桃醌的测定。
124数据统计与分析
采用Excel 2010软件进行数据统计,SPSS 170软件作显著性方差分析。
2结果与分析
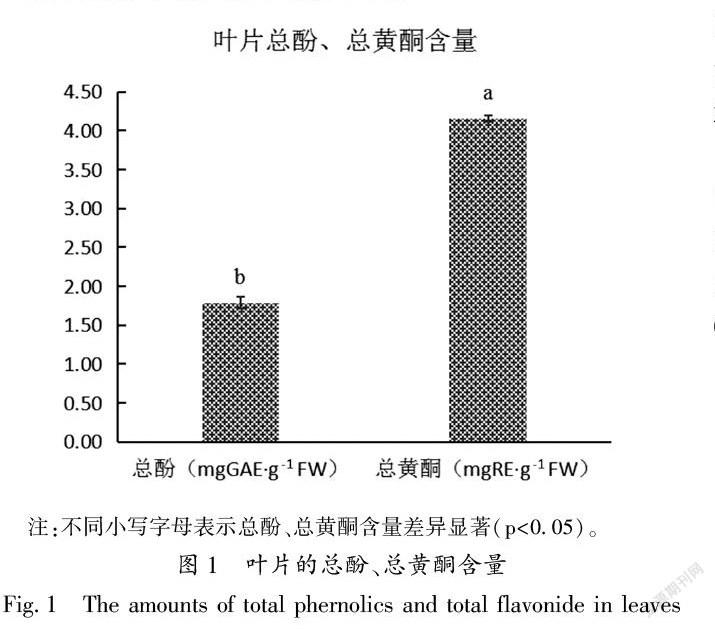
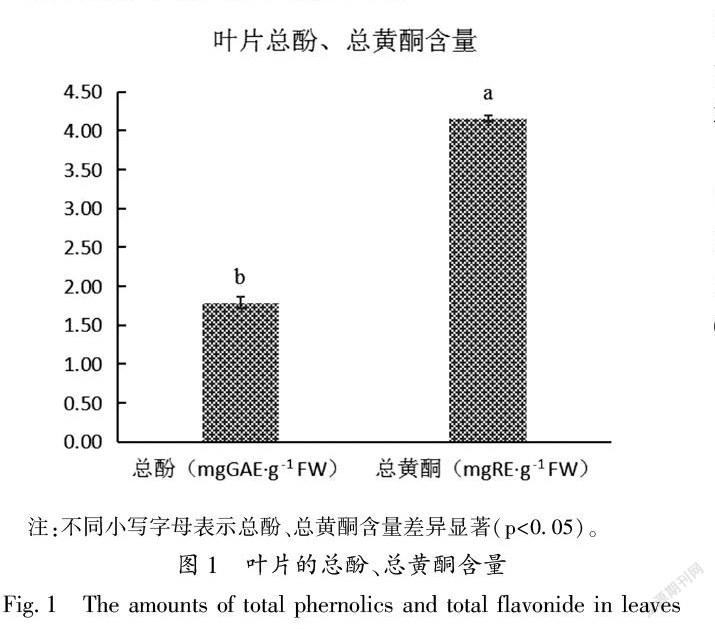
21叶片总酚、总黄酮含量的测定
如图1所示,叶片中测得总酚含量为179 mgGAEans sigillata Dode)were used as tested materials to determine the components and content of leaves in polyphenols,which provided a theoretical basis for rational development and utilization of walnut leavesThe total phenolics and total flavonoids detected by ultraviolet spectrophotometry were 179 mg GAE
22葉片中多酚组分状况及含量测定
叶片中多酚组分及含量如表 1所示,鉴定出没食子酸、绿原酸、咖啡酸、对香豆酸、阿魏酸、丁香酸、丁香醛、儿茶素、槲皮素、杨梅素、芦丁和胡桃醌共12种单体酚。芦丁和绿原酸的含量最高,分别为30757 mg
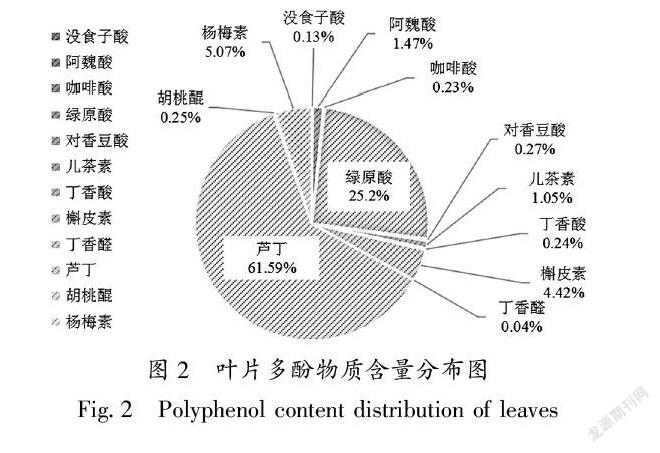
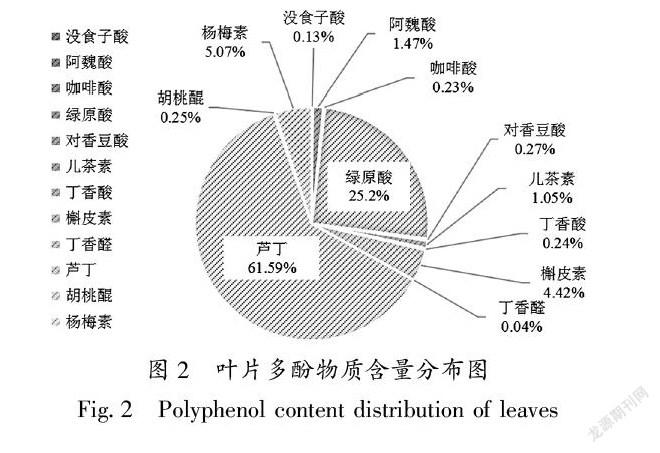
23叶片中多酚含量分布
图 2为12种多酚物质含量分布状况,可见这12种多酚组分的含量差异较大,其中芦丁含量最高为6159%,其次是绿原酸252%,接着是杨梅素(507%)和槲皮素(442%),其余多酚含量在004% ~ 147%之间。
3结论与讨论
‘黔核5号’核桃叶片多酚组分丰富,能测到多种酚酸和黄酮类物质。绿原酸是酚酸中含量最高的物质,为12604 mg·100g-1FW。这与很多药用植物的多酚组分相似,如银杏[11]、番石榴[12]、檵木[13]、八仙花[14]、艾草[15]等多种药用植物叶片,可检测到绿原酸、没食子酸、对香豆酸、咖啡酸、阿魏酸、丁香酸、杨梅素、槲皮素、芦丁等多种酚酸和黄酮类物质,是叶片中发挥功效的主要成分。表明核桃叶往药用方向发展潜力巨大,能作为提取酚酸、黄酮等药物成分的良好植物源。
在测定的12种多酚物质中,黄酮类含量整体比酚酸类含量高。酚酸物质在次生代谢中处于中上游位置,连接着下游的黄酮、花青素、木质素等代谢过程,既是底物又是产物,如咖啡酸、对香豆酸可以由上游苯丙氨酸生成,又可以通过不同的酶促反应进入下游的黄酮、花青苷等途径[16]。植物代谢时会产生多种中间酚酸产物,进一步反应后才生成稳定的黄酮,这可能是检测到酚酸含量较少的原因。耿树香[17-18]、刘基[19]、张春梅[20]等均在铁核桃的青皮、叶片、内种皮等部位检测到含量丰富的多酚和黄酮类物质,也从中鉴定到了没食子酸、绿原酸、槲皮素、胡桃醌等多酚组分。本次试验从核桃叶片中检测到较高含量的芦丁,显著高于其它多酚组分,为30757 mg·100g-1FW;与其他研究者报道的结果相似,如Cosmulescu等[21]在‘Fernette’、‘Vina’、‘Valcor’、‘Hartley’等9个品种的核桃叶片中测得芦丁平均含量为989 mg·100g-1FW,其中‘Valcor’最高为1867mg·100g-1FW,本次测得芦丁分别是其平均含量的342倍、最高含量的165倍,这可能与不同品种核桃和地域因素有关。但均表明核桃叶片中芦丁含量丰富,可为提取核桃叶片中的芦丁提供参考和理论依据。
高液相色谱法(HPLC)是测定多酚物质比较成熟和常用的方法,如吴竹、张启发等[22-23]用高液相色谱法检测银杏、烟草中的多酚物质,能有效地对银杏内酯、山奈素等相关酚类物质进行鉴定。采用高效液相色谱法检测到核桃叶片多酚物质含量丰富,具有很好的开发价值和利用潜力,除了本次试验所测的12种多酚组分外,还有其它多酚组分需要进一步探索。随着色谱与质谱技术的快速发展,今后可使用气质谱联用(GC/MS)、液质联用(LC/MS)、核磁共振(NMR)等更加先进的技术挖掘核桃叶片中更多的酚类物质信息。
参考文献:
[1]欧茂华贵州省核桃种质资源及其利用评价[J].安徽农业科学,2012,40(32):15792-15793,15870.
[2]潘学军,曹景富,张文娥毕节地区核桃产业优势、存在问题及发展对策[J].山地农业生物学报,2018,37(1):1-6.
[3]潘学军,张文娥,刘伟,等.贵州核桃种仁脂肪酸和氨基酸含量分析[J].西南农业学报,2010,23(2):497-501.
[4]刘茂桥,潘学军,张文娥,等.铁核桃叶片主要矿质营养元素含量与生育期动态变化特征[J].云南大学学报(自然科学版),2016,38(1):162-170.
[5]付苗苗核桃的营养保健功能及药用价值研究进展[J]. 中国食物与营养,2014,20(10):74-76.
[6]梁俊玉,赵保堂,殷振雄,等.核桃叶多酚的抗氧化活性测定[J].食品与发酵工业,2012,38(11):171-174.
[7]王长雷,张文娥,潘学军核桃雄花中总多酚提取工艺的研究[J].食品工业,2015,36(1):77-81.
[8]CONDE-HENNDEZ L A,GUERRERO-BELTN J Total phenolics and antioxidant activity of Piper auritum and Porophyllum ruderale[J]. Food Chemistry,2014,142:455-460.
[9]聂继云,吕德国,李静,等.分光光度法测定苹果果实总黄酮含量的条件优化[J].果树学报,2010,27(3):466-470.
[10]史斌斌铁核桃多酚类物质含量与抗氧化活性、代谢相关酶活性的关系[D].贵阳:贵州大学,2017.
[11]陈晶,王京辉,傅欣彤,等.高效液相色谱法测定银杏叶提取物中4个酚酸类化合物的含量[J]. 药物分析杂志,2013,33(5):818-821.
[12]邵萌,王英,翦雨青,等.番石榴叶乙醇提取物的化学成分研究[J]. 中国中药杂志,2014,39(6):1024-1029.
[13]杨郁,于能江,张 杨,等.檵木叶的化学成分研究[J].中国药学杂志,2015,50(3):205-208.
[14]陈亚军,于莹,高岩,等.八仙花叶中酚酸类化合物的分离和结构鉴定[J]. 中医药信息,2017,34(1):10-13.
[15]王小俊,邓玉环,张丽萍,等.UPLC-DAD-MS定性和定量分析蕲艾中的酚酸和黄酮类成分[J].中国中药杂志,2019,44(5):983-989.
[16]欧阳光察,薛应龙植物苯丙烷类代谢的生理意义及其调控[J]. 植物生理学通讯,1988(3):9-16.
[17]耿树香,宁德鲁,李勇杰,等.云南省主栽核桃品种内种皮中多酚的检测分析[J].西部林业科学,2016,45(5):124-127.
[18]耿树香,宁德鲁,陈海云,等.不同品种核桃青皮中主要功能性成分含量测定及分析[J].西部林业科学,2018,47(5):57-63.
[19]刘基,赵宁,王小双,等.几种云南核桃不同部位总黄酮含量的测定[J].山东农业科学,2017,49(12):135-138.
[20]张春梅,陈朝银,林玉萍,等.几种云南核桃内种皮黄酮及多酚含量的测定[J].云南中医学院学报,2013,36(2):10-13.
[21]COSMULESCU S,TRANDAFIR I,NOUR VSeasonal variation of the main individual phenolics and juglone in walnut (Juglans regia)leaves[J].Pharmaceutical Biology,2013,52(5):575-580.
[22]吳竹,王秋萍,田漫漫,等.银杏不同部位黄酮、内酯和银杏酸含量分析[J].山地农业生物学报,2017,36(4):72-75.
[23]张启发,聂琼,邹序生,等.HPLC法同时测定烟叶中6种多酚类物质[J].山地农业生物学报,2018,37(3):21-26.

