IL-32的结构与功能的生物信息学预测*
刘建兵 李文龙 郝建卿 崔小华 林晓雨 李 莉
(山西医科大学基础医学院细胞生物与遗传学教研室 山西太原 030001)
生物信息学是由生命科学和信息技术等学科相结合形成的新兴交叉学科。利用生物信息学技术,以基因组DNA 序列信息分析作为源头,获得蛋白质编码区的信息后进行蛋白质空间结构模拟和预测,然后依据特定蛋白质的功能进行更深入的研究与应用。白介素-32(Interleukin-32,IL-32)是一种新近发现的促炎细胞因子[1],其蛋白序列与其他细胞因子不存在同源性,并且在啮齿类物种中也未找到与其同源的蛋白[2]。IL-32 在人不同组织或器官中都有表达,其中包括脾脏、胸腺、白细胞、肺、小肠、结肠、心脏、胎盘、肝脏、肌肉、肾脏、胰腺和脑等[3]。研究表明,IL-32 在炎症性疾病、感染性疾病及癌症发生发展中都发挥着重要作用[3-4]。本研究利用生物信息学方法,对人IL-32蛋白的基本性质、结构、功能及蛋白相互作用等进行了预测和分析,为进一步了解IL-32 基因功能
机制的实验研究奠定理论基础。
1 材料与方法
1.1 材料从NCBI(https://www.ncbi.nlm.nih.gov/protein/)数据库中下载 IL-32 的氨基酸序列进行分析(GenBank 登录号:AAH09401.1)。
1.2 方法 采用 ProtParam[5](https://web.expasy.org/protparam/)软件对 IL-32 蛋白的理化性质进行预测分析;采用ProtScale[5](https://web.expasy.org/protscale/)软件对其疏水性进行分析;采用SignalP 4.0[6](http://www.cbs.dtu.dk/services/SignalP-4.0/)对其信号肽结构进行预测分析;采用SecretomeP 2.0 server[7](http://www.cbs.dtu.dk/services/SecretomeP/)对其进行非经典型分泌蛋白预测;采用在线程序 TMHMM Server v.2.0[8](http://www.cbs.dtu.dk/services/TMHMM/)对其跨膜结构进行分析;采用在线软件NetNGlyc 1.0 Sever(http://www.cbs.dtu.dk/services/NetNGlyc/) 和 Net -OGlyc 4.0 Server[9](http://www.cbs.dtu.dk/services/NetOGlyc/)对其N-糖基化位点进行预测;采用在线软件YinOYang1.2 Server[10](http://www.cbs.dtu.dk/services/YinOYang/)对其 O-糖基化位点进行预测;采用在线软件 Netphos 2.0 Server[11](http://www.cbs.dtu.dk/services/NetPhos-2.0/)对其磷酸化位点进行预测;采用在线软件 PSORTⅡ[12](https://psort.hgc.jp/form2.html)对其亚细胞定位分析预测;采用 在线软件 STRING[13](https://string-db.org/)对其蛋白网络互作进行预测分析。
2 结果
2.1 IL-32 蛋白的理化性质分析 利用在线生物信息学软件ProtParam 对IL-32 蛋白的氨基酸序列进行了理化性质预测分析,结果显示其蛋白分子量(Mr)=26676.35,蛋白分子式 C1177H1814N318O355S18,理论等电点PI=5.14,属于酸性蛋白。组成IL-32 蛋白的氨基酸有20 种,其中亮氨酸(Leu)含量最高,占总氨基酸的10.3%,异亮氨酸含量最少,只有0.4%(图1)。带负电荷的残基总数为35 个,带正电荷的残基总数为26 个;不稳定指数为56.33,属于不稳定蛋白;亲水性平均总值为-0.495,脂肪指数为67.52。通过在线软件 ProtScale 分析显示,IL-32 氨基酸序列的第184 位疏水性最大分值为1.944,第222 位亲水性最大分值为-2.256,整体亲疏水性预测显示IL-32 蛋白为亲水性蛋白(图2)。

图1 IL-32 蛋白氨基酸的组成
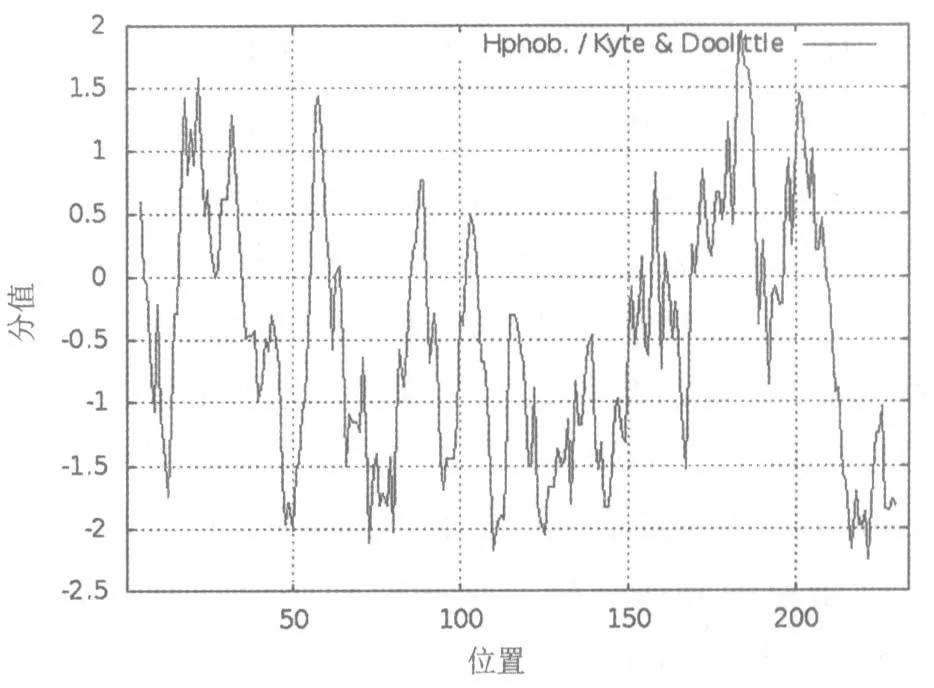
图2 IL-32 蛋白亲水性与疏水性分析
2.2 IL-32 蛋白的信号肽分析 生物信息学在线软件SignalP 4.0 被广泛应用于蛋白信号肽的预测,结果包含了 C 值、Y 值和 S 值。其中通过 S 平均值判断分泌蛋白(若S 平均值高于0.500,则为分泌蛋白,且存在信号肽);C 值是剪切位点值;Y值是综合考虑C 值和S 值后的一个参数,可更准确判断信号肽剪切位点。IL-32 蛋白氨基酸序列的信号肽预测结果显示C 值最大为0.168、Y 值最大为 0.206、S 平均值为 0.226。由此推测,IL-32 蛋白不存在信号肽序列,不是经典的分泌型蛋白(图3)。
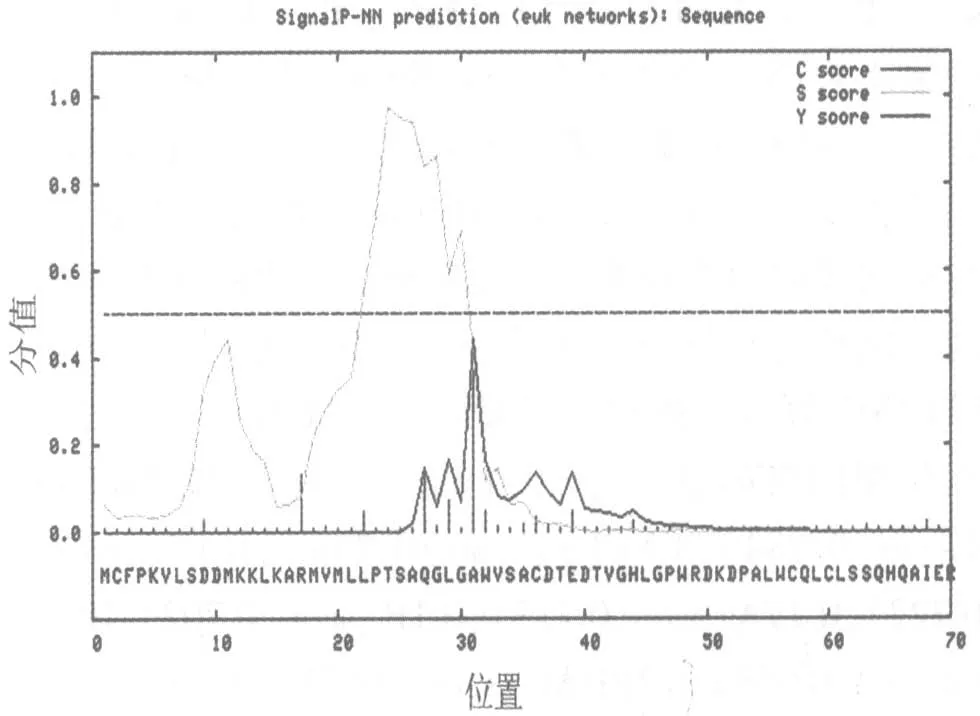
图3 IL-32 蛋白的信号肽分析
2.3 非经典型分泌蛋白预测 SecretomeP 2.0 server 是预测非经典分泌型蛋白的专业软件,结果评价主要参考NN-score,哺乳动物序列的阈值为0.6[8]。利用 SecretomeP 2.0a Server SecretomeP 2.0 Server 对 IL-32 蛋白氨基酸序列预测,NN-score 为0.534。由此判断,IL-32 不是非经典型分泌蛋白。
2.4 IL-32 蛋白的跨膜结构分析 利用在线生物信息学软件TMHMM Server v.2.0 对IL-32 蛋白氨基酸序列进行跨膜结构预测分析,结果表明:IL-32 蛋白序列全部位于膜外区,不存在跨膜区。
2.5 IL-32 蛋白亚细胞定位 PSORTⅡ在线软件的the k-NN Prediction 对IL-32 蛋白亚细胞定位预测结果表明,IL-32 定位于不同细胞器的可能性分别为:细胞质(60.9%)、细胞核(17.4%)、线粒体(8.7%)、细胞骨架(8.7%)和高尔基体(4.3%)。
2.6 IL-32 蛋白翻译后位点修饰 利用生物信息学在线软件 NetNGlyc 1.0 Sever、NetOGlyc 4.0 Server、YinOYang1.2 Server 和 Netphos 2.0 Server 对IL-32 蛋白的翻译后糖基化和磷酸化位点修饰进行了预测分析。NetNGlyc 1.0 Sever 和 NetOGlyc 4.0 Server 预测结果表明IL-32 蛋白没有N-糖基化位点,其O-糖基化位点分别在第34 位、第133 位、第211 位和第 228 位氨 基酸 ;YinOYang1.2 Server 对O-糖基化位点再次进行预测,结果显示有7 个位点,分别位于第 24 位、第 80 位、第 143 位、第 207位、第 228 位、第 232 位和第 233 位氨基酸。第 228位氨基酸被2 种软件同时预测为O-糖基化位点。Netphos 2.0 Server 对IL-32 蛋白磷酸化位点预测结果表明,IL-32 蛋白有 14 个 Ser、6 个 Thr、2 个Tyr 可能成为蛋白激酶磷酸化位点。
2.7 IL-32 蛋白相互作用分析 相互作用基因库检索工具(Search Tool for the Retrieval of Interacting Genes,STRING)能构建已知蛋白质与预测蛋白质之间的相互作用。它不仅包括直接的物理相互作用,还包括间接的功能相关,通过对蛋白质之间相互作用的可能性进行打分,评价相互作用可能性的大小。STRING 数据库预测结果显示,构成IL-32 蛋白相互作用网络的蛋白有10 个(图4),分别为:PRTN3(score:0.984)、CXCL8(score:0.748)、IL18(score:0.722)、IL17A(score:0.713)、IL1B(score:0.702)、HGF(score: 0.658)、IL18RAP (score:0.653)、IDO1 (score:0.644)、DNAJA2(score:0.642)、TSLP(score:0.625)。

图4 IL-32 蛋白互作网络
3 讨论
IL-32 基因位于人染色体16p13.3,含有8 个外显子。蛋白质前体由234 个氨基酸残基组成,目前发现有9 个可变剪接体。IL-32 的表达主要在免疫细胞,在肿瘤细胞、成纤维细胞、角质细胞和内皮细胞中也有表达。
国内、外研究表明,在IL-32 蛋白的9 种剪接体中,只有 IL-32γ 存在N 末端疏水信号肽,而其他剪接体没有典型的信号肽[3];从 IL-32 的分布来看,IL-32α 分布于细胞内,而 IL-32β 是被分泌到细胞外[14],也有研究显示 IL-32β 分布于内质网中,而在细胞核和质膜中不存在[15],在人T 细胞中 IL-32β 不被分泌[16];IL-32 蛋白不存在跨膜区,但是也有研究指出IL-32 在外周血单核细胞中的表达与细胞膜有关联[17]。由此可见,IL-32 蛋白的作用部位仍存在争议[18],还待进一步研究。本研究显示IL-32 蛋白为不稳定的亲水性蛋白,不具有信号肽,既不是经典型分泌蛋白,也不是非经典型分泌蛋白,分布于细胞质(60.9%)、细胞核(17.4%)、线粒体(8.7%)、细胞骨架(8.7%)和高尔基体(4.3%),属于胞内蛋白。这为 IL-32 蛋白性质的研究添加了新的证据。
糖基化和磷酸化修饰是真核生物内蛋白质翻译后广泛存在的重要修饰方式,能调控信号转导、基因表达、细胞周期等诸多细胞过程,这种修饰的异常与疾病的发生有密切的关联[19-20]。本研究利用多种不同的在线生物信息学软件,对IL-32 蛋白的糖基化预测结果表明,IL-32 蛋白不存在N-糖基化位点,但是存在有O-糖基化位点。虽然不同软件的分析结果不完全一致,这可能是由于不同软件的算法不一致导致的,但是第228 位氨基酸被共同预测为O-糖基化位点。在磷酸化位点的预测中,有 14 个 Ser、6 个 Thr、2 个 Tyr 被预测为蛋白激酶磷酸化位点。这将为研究IL-32 蛋白在细胞生理活动中的功能及机制提供参考依据。
生物信号传递、基因表达调节、能量和物质代谢及细胞周期调控等组成了生命过程的各个环节,而蛋白质是体现生命活动的最终执行者。蛋白质不是独立地行使功能,而是由许多蛋白质及其他分子形成蛋白质互作网络而实现的。分析蛋白的相互作用关系,对于了解蛋白质的工作原理及了解蛋白之间的功能联系都有重要意义。本研究进行的IL-32 蛋白相互作用网络预测研究显示,IL-32 蛋白与10 个蛋白具有相互作用的可能性,其中包括白介素家族的IL18、IL17A、IL1B 及IL18的受体辅助蛋白(IL18RAP),这与目前报道的关于IL-32 的功能主要与炎症有关相一致。其次笔者从 HPA 数据库(Human Protein Atlas,https://www.prot-einatlas.org/)查询发现,在互作蛋白中PRTN3 和CXCL8 在骨髓中显著高表达,提示IL-32可能与PRTN3 和CXCL8 蛋白相互作用,在骨髓相关疾病中发挥一定的作用;HGF 和IDO1 在胎盘中显著高表达,提示IL-32 蛋白可能与HGF 和IDO1 相互作用,在人妊娠过程中发挥一定的功能,这为后续研究IL-32 蛋白在人妊娠过程中的功能提供了理论依据。
总之,本研究利用生物信息学的方法对IL-32蛋白的结构、功能及蛋白互作网络进行了预测分析,为进一步研究IL-32 蛋白在生命活动中的作用机制研究提供了思路和依据。

