术前外周血小板计数与淋巴细胞计数比值对非小细胞肺癌根治术后并辅助化疗患者预后的影响
王晓东,张 涛,崔 凯,梁晓华,赵 芳,李小飞
空军军医大学第二附属医院胸外科六病区(西安710038)
非小细胞肺癌(Non-small cell lung cancer,NSCLC)占原发性肺癌85%左右[1],而肺癌是导致癌症相关死亡的首位原因[2]。在可手术的NSCLC患者中,其预后差异较大,如Ⅰa期术后患者5年OS(Overall survival)可达73%,而Ⅲa期术后患者的5年OS仅为24%[3]。即使病理分期一致,同样接受了术后辅助化疗,预后差异仍较大。因此,寻找具有预后不佳特征的NSCLC患者,并对其进行更为积极的治疗,从而到达治疗最大获益的目的,就显得意义重大。虽然目前有不少临床病理学指标可提示NSCLC肺癌患者的预后,比如肿瘤大小、淋巴结有无转移、切缘是否阳性、ECOG-PS评分等,但正如上述,即使同样分期患者接受相同的治疗,预后及复发情况仍然参差不齐;因此,需要寻找更多的生物标志物预测患者的预后及复发情况。外周血血小板与淋巴细胞比(Platelet-to-lymphocyte ratio ,PLR)为外周血血小板计数与淋巴细胞计数的比值,综合反映炎症反应和免疫系统功能平衡的指标,被认为与多种肿瘤的预后有关,包括非小细胞肺癌[4-7]。本研究旨在评估PLR对于可手术的NSCLC的患者接受手术治疗并术后辅助化疗的预后是否有预测价值。
资料及方法
1 一般资料 收集我病区2012年1月1日至2012年12月31日期间连续住院因Ⅰ-Ⅲ期NSCLC行根治术并术后联合辅助化疗的患者108例。排除标准:术前伴有任何系统感染;既往恶性肿瘤史;手术未达R0切除标准;低度恶性肿瘤如粘液表皮样癌、类癌、原位腺癌等;肉瘤样癌、癌肉瘤;既往曾有输血史者;合并自身免疫系统疾病者;术前曾接受放疗、新辅助化疗或者靶向药物治疗等癌症相关治疗;术后30d内死亡。血小板计数、淋巴细胞计数为术前血常规结果。PLR为中性粒细胞绝对值/淋巴细胞绝对值。术后辅助化疗方案以铂类为基础的两药方案4次。
2 随访方法 本研究关注的主要终点为总生存时间(Overall-Survival,OS),次要终点为无疾病生存时间(Disease-Free-Survival,DFS)。随访方式包括病历回顾及电话随访。所有患者随访时间截止时间为2018年3月31日。DFS是指自手术日起至临床发现局部复发或远处转移,未发现局部复发或远处转移的患者视为截尾数据;OS是指自手术日起至患者死亡,如仍然存活的患者视为截尾数据。
3 分组方法 根据患者术前的血常规结果计算PLR。PLR的计算公式为血小板计数与淋巴细胞计数的比值。应用受试者工作特征(Receiver operating characteristic,ROC)曲线分析PLR与患者生存状态的关系,通过约登指数选取兼顾特异度与敏感度最佳的PLR界值为本研究PLR的最佳截点。依据以上所得的PLR截点将入组患者分为两组:低PLR组(PLR值<最佳截点);高PLR组(PLR值≥最佳截点)。
4 统计学方法 分类资料的组间比较应用χ2检验或者Fisher确切概率法。生存时间的估算采用Kaplan-Meier法,生存曲线的比较采用Log-rank法,多因素分析应用Cox比例风险回归模型。采用SPSS23.0进行统计分析。P<0.05为差异有统计学意义。
结 果
1 PLR临界值的确定 经纳入标准及严格的排除标准的筛选,共有108例符合标准的患者纳入统计。应用ROC曲线分析(图1),PLR对于OS的曲线下面积(Area of the curve,AUC)为0.728(95%CI:0.616~0.760,P=0.035),灵敏度为0.613,特异度为0.636时约登指数最大,对应的PLR为137.12。PLR<137.12组患者52例(48.15%),PLR≥137.12组患者56例(51.85%)。表1给出了PLR不同组别患者的基本情况。如表所示,高PLR组与低PLR组两组间的性别、年龄、吸烟史、手术类型、病理类型、T分期、N分期均无统计学差异(P均>0.05)。
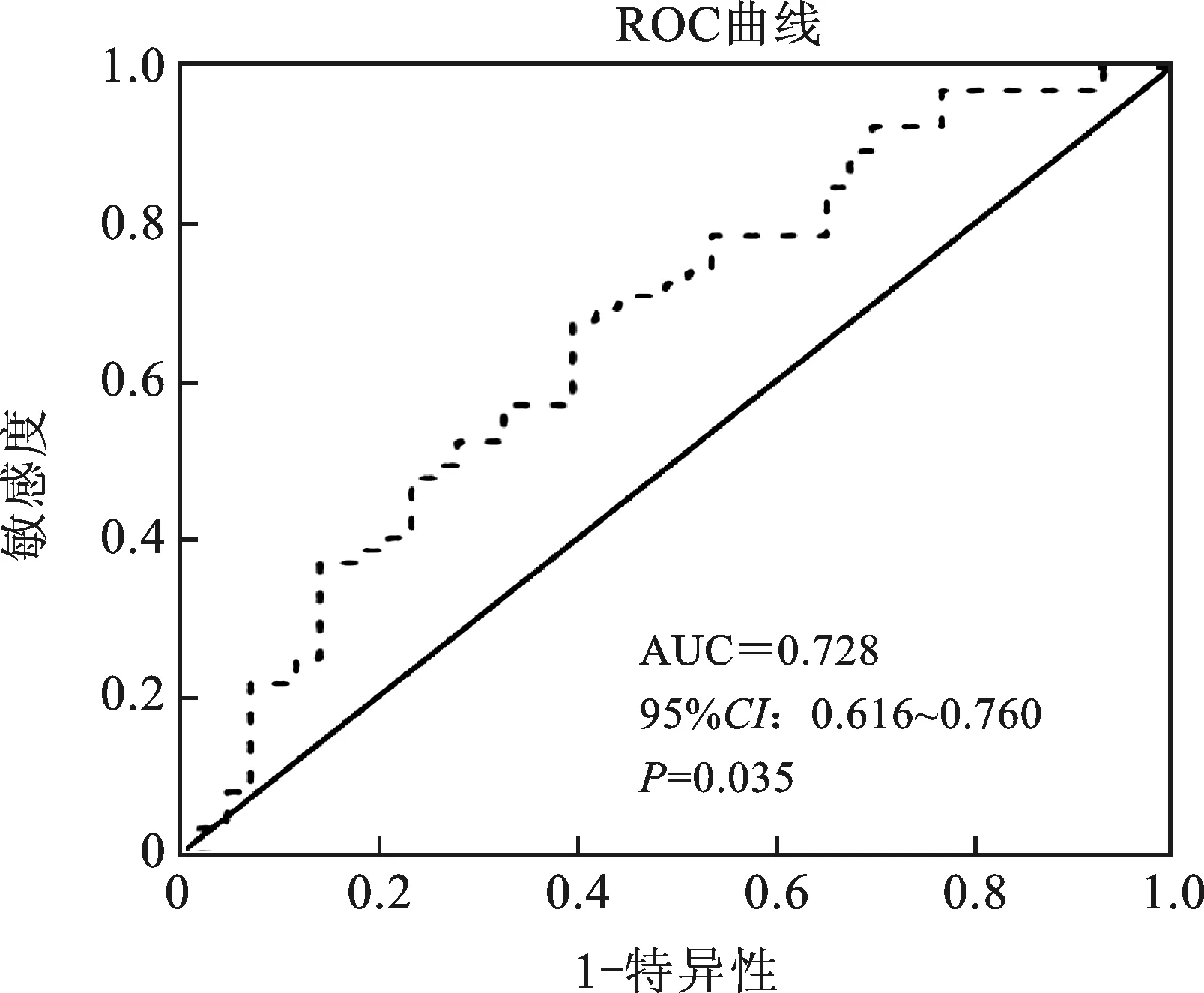
图1 PLR预测OS的ROC曲线
2 COX多因素分析 将性别、年龄、吸烟史、T分期、N分期、手术类型、病理类型及PLR分组作为变量纳入COX比例风险回归模型进行多因素分析。经多因素分析剔除其他因素影响后,PLR分组、N分期为独立预后因素,如表2所示。其中PLR分组的RR1.747,95%CI(1.029~2.966),P=0.039。PLR分组相对危险度RR为1.747,表示在其他条件一致时,NLR高的患者是NLR低患者的死亡风险高1.747倍。其他因素如性别、年龄、吸烟史、手术类型、病理类型、T分期在回归模型中无统计学意义(P>0.05),也就是说不是独立预后因素。
3 不同PLR组OS比较 总体中位生存时间46个月,95%CI(30.878~61.122)。低PLR组中位OS54个月,95%CI(27.622~80.378),高PLR组中位OS36个月,95%CI(18.585~53.415),P=0.036。Kaplan-Meier生存曲线见图2。在图2中,虚线表示低PLR组的生存曲线,实线表示高PLR组的生存曲线,低PLR组的生存曲线明显优于高PLR组。

表1 不同PLR组别中患者临床特点[例(%)]
注:#4例腺鳞癌,3例鳞腺癌;*3例腺鳞癌,1例鳞腺癌,1例大细胞癌

表2 多因素分析显示对OS有独立预后意义的因素
注:△PLR分组、N分期均为独立预后因素,P均<0.05
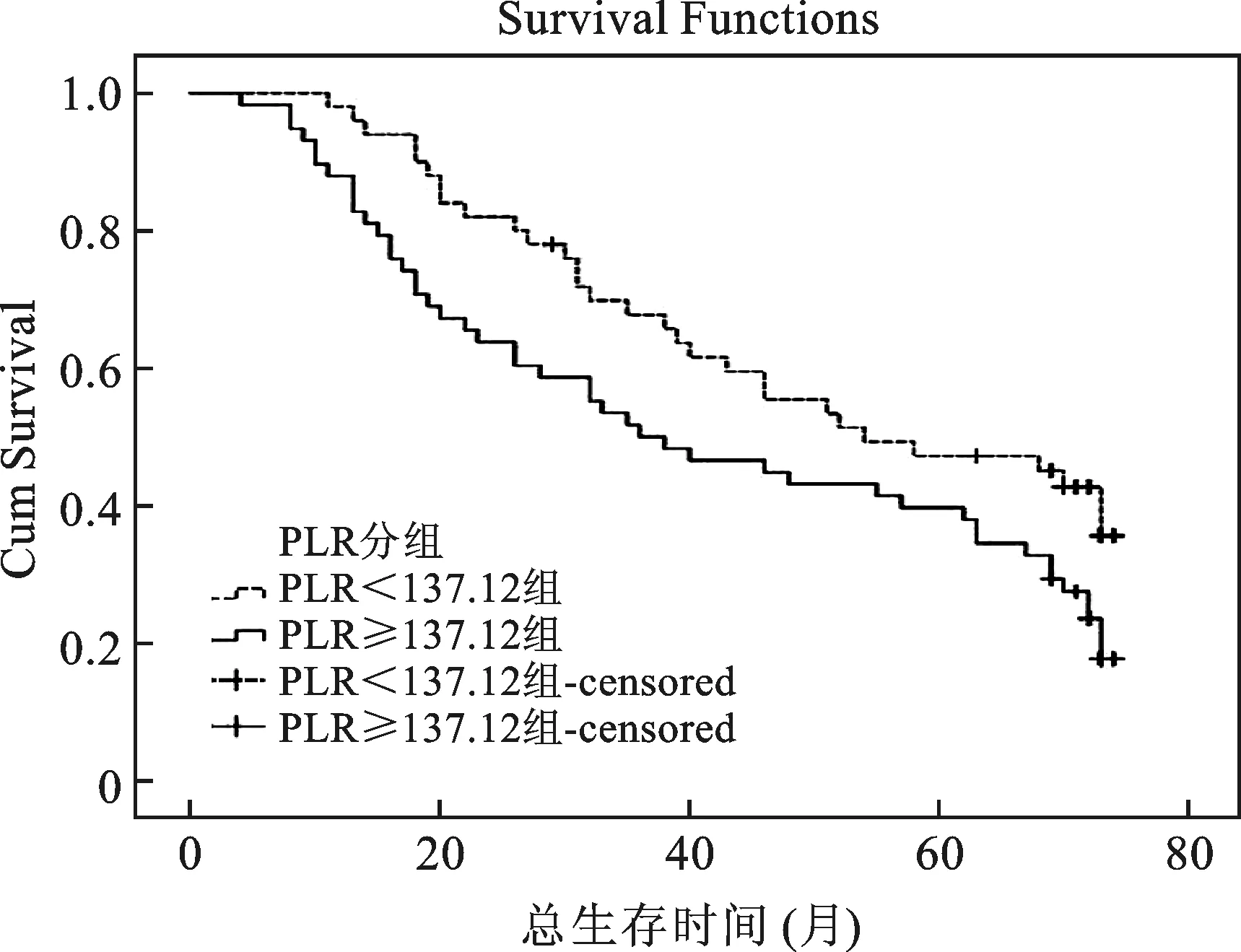
低PLR组中位OS 54个月,95%CI(27.622~80.378),高PLR组中位OS 36个月,95%CI(18.585~53.415),P=0.036
图2低PLR组与高组OS生存曲线Log-rank比较
4 不同PLR组DFS比较 总体中位DFS18个月,95%CI(12.180~23.820)。低PLR组中位DFS21个月,95%CI(14.076~27.924),高PLR组中位DFS 15个月,95%CI(5.049~24.951),两组差异无统计学意义(P=0.928)。Kaplan-Meier生存曲线见图3。在图3中,低PLR组的生存曲线以虚线表示,高PLR组的生存曲线以实线表示,两条曲线分的不开并且有交叉两条曲线无统计学差异。
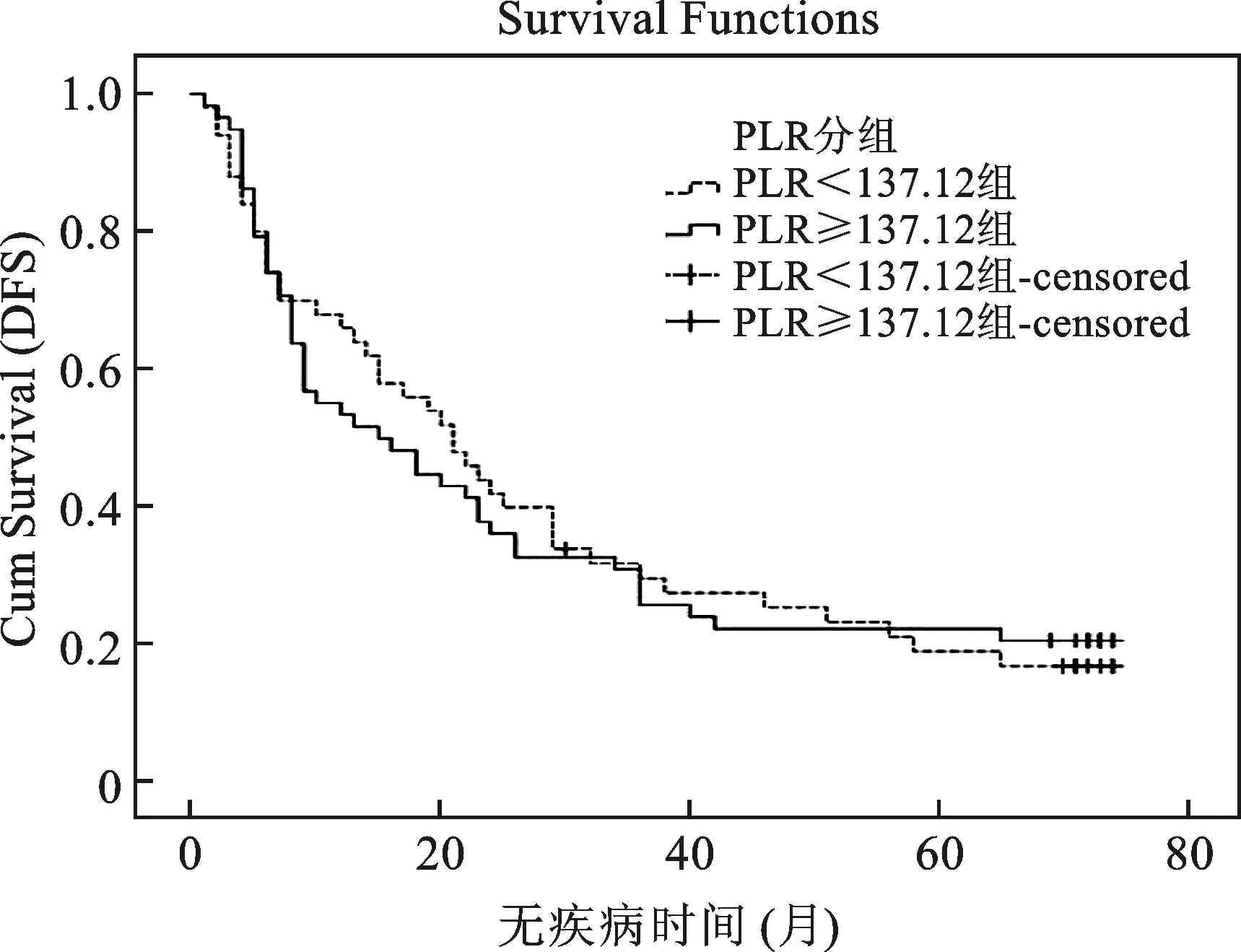
低PLR组中位DFS 21个月,95%CI(14.076,27.924),高PLR组中位DFS 15个月,95%CI(5.049,24.951),P=0.928
图3低PLR组与高PLR组DFS生存曲线Log-rank比较
讨 论
PLR的增高归因于血小板计数的相对增高或者淋巴细胞计数的减低或者两者兼有。有文献报道[8],癌细胞进入血液系统后会触发血小板参与调节的一系列反应,最终被细胞表面受体、细胞产物、细胞外因子和免疫细胞放大。这些相互作用的结局是抑制了免疫识别和癌细胞的清除,促进了内皮细胞的阻滞,促进了微血管的卡压,从而促进了癌细胞的生存。这导致癌细胞的存活和扩散。血小板通过释放基质金属蛋白酶MMP-9、血管内皮生长因子VEGFR、血小板衍生生长因子等,对于肿瘤的生长及血管生成起到了很重要的作用。也有报道[9],血小板释放物在体外和体内对肝癌细胞均有增殖作用。这种效应依赖于肝细胞癌细胞中KLF6表达的减少。
淋巴细胞减低则会导致患者自身对于肿瘤的免疫力下降,加快转移。Sun等[10]报道的一项前瞻性研究中包括31例晚期非小细胞肺癌患者,在这些患者中,循环肿瘤细胞(CTCs) 水平与CD3+T细胞(P=0.01)、CD8+T细胞(P=0.04)水平呈负相关,T淋巴细胞越低,预后越差。正是因为外周血淋巴细胞在肿瘤免疫中起到的重要作用,因此在多种预后相关的标志物中,应均将淋巴细胞因素考虑了进去,比如NLR[11],以及Glasgow Prognostic Score[12]等。
有多家研究报道,PLR为炎症标志物,综合考虑了血小板计数和淋巴细胞计数,为多种肿瘤的独立预后因素,包括肺癌。Wen等[4]的研究纳入了723例连续住院的胃癌或食管癌并接受手术治疗的患者,该研究旨在评价Platelet lymphocyte ratio (PLR), Modified glasgow prognostic score (mGPS), Neutrophil lymphocyte ratio(NLR),Prognostic index(PI)和Prognostic nutrition index(PNI)5项类似炎症标志物的意义,结果提示PLR为独立的预后因素。Vernieri C[5]的一项单中心回顾性研究涉及有57例转移性三阴性乳腺癌(mTNBC)患者,该研究中的患者接受卡铂为基础联合紫杉醇或吉西他滨方案的化疗。研究结果显示,不论在单因素分析还是多因素分析中,高NLR、高PLR与低PFS相关,NLR、PLR为转移性三阴性乳腺癌的独立预后因素。Lee等[6]的研究纳入自2005-2015年期间总计497例局部晚期胰腺癌患者,接受新辅助并最终放化疗,临界值取中位数149,分为PLR<149和PLR≥149两组,1年OS分别为68.1%与61.3%(PLR<149组与PLR≥149组),P=0.029;1年PFS分别为37.9%与32.5%(PLR<149组与PLR≥149组),P=0.027。治疗前高PLR预示低OS和低PFS,PLR为独立预后因素。
Toda等[7]的回顾性研究纳入了327例因患非小细胞肺癌行根治性手术患者,其中有78例患者接受了术后辅助化疗,通过ROC曲线确定PLR临界值为162,分为高PLR组与低PLR组,应用Kaplan-Meier法比较两组生存差异,在接受术后辅助化疗亚组中,5年OS在低PLR组和高PLR组分别为69%与37%(P<0.01);经COX比例风险回归模型分析进一步证实,术前高PLR为非小细胞肺癌根治性手术并术后辅助化疗患者OS的独立不良预后因素,同时也是DFS的独立不良预后因素。江冠铭等[13]的报道探讨了治疗前PLR对于EGFR突变阳性NSCLC接受靶向治疗的疗效和预后价值。该研究纳入EGFR突变阳性的患者90例,治疗前计算PLR,并取中位数139为截点分组,分为PLR≤139组(PLR低组)44例和PLR>139组(PLR低组)46例,结果PLR低组中位OS、PFS均显著小于PLR高组(P=0.001)。有多家报道[7,14],术前PLR为非小细胞肺癌的预后因素。据我们所知,目前尚无PLR与非小细胞癌术后并辅助化疗患者预后关系方面的中文文献报道,因此,在参考了大量前人的研究后,我们也进行了类似的回顾性分析。我们的研究虽然是回顾性研究,但制定了严格的纳入标准及排除标准,能够做到尽量严谨、科学。共有108例患者符合标准,应用ROC曲线分析,兼顾灵敏度与特异度的情况下,确定PLR对OS有预测意义的最佳临界值为137.12,分为高PLR组与低PLR组。低PLR组中位OS 54个月,95%CI(27.622~80.378)与高PLR组中位OS 36个月,95%CI(18.585~53.415),P=0.036。COX比例风险回归模型进行多因素分析显示,PLR为OS的独立预后因素, RR1.747,95%CI(1.029~2.966),P=0.039。但我们的研究发现,低PLR组中位DFS 21个月,95%CI(14.076~27.924),高PLR组中位DFS 15个月,95%CI(5.049~24.951),P=0.928,两组差异无统计学意义。也就是说,PLR不是DFS的独立预后因素。究其原因,可能与本试验中入组患者的肺癌分期、肺癌类型等因素的分布情况不同有关系。
术前高PLR可能为根治性手术治疗并接受术后辅助化疗的非小细胞肺癌患者的独立不良预后因素。

