Calpain2在FN诱导的口腔鳞癌细胞上皮间质转化中的作用
张玉莲 龚靖淋 刘一秀 李真华 周晓红 叶果
口腔鳞状细胞癌(OSCC)为常见的恶性肿瘤之一,尽管患者术后经化疗控制病情发展,但5年生存率仍不足50%[1-2]。因此,寻求新的治疗手段成为临床治疗OSCC的新希望。上皮-间质转化(epithelialmesenchymal transition,EMT)是近年来肿瘤发生发展的研究热点,EMT的发生被认为是癌症转移的启动过程,其可使上皮细胞来源的恶性肿瘤获得侵袭能力[3]。研究发现,钙激活中性蛋白酶2(calcium-activated neutral protease2,calpain2)过表达可通过肾细胞癌中的AKT/mTOR信号传导促进细胞转移和增殖[4]。另有研究发现,在乳腺癌中纤连蛋白(fibronectin,FN)诱导MCF-7细胞EMT的同时伴随Calpain1和Cal-pain2蛋白表达的上调[5]。这些说明Calpain2可能参与包括EMT在内的肿瘤细胞的多种恶性生物学行为。因此本实验以口腔鳞癌Tca8113细胞为研究模型,FN诱导模型细胞EMT,观察Calpain2在其中的作用。
1 材料与方法
1.1 材料
1.1.1 细胞系 人口腔鳞癌Tca8113细胞(中国科学院上海细胞库)。
1.1.2 试剂 RPMI 1640培养基、胎牛血清(FBS)、磷酸盐缓冲液(PBS)(Gibco公司,美国);FN(Sigma公司,美国);总蛋白提取试剂盒和细胞裂解液(上海碧云天公司);Calpain2 siRNA转染试剂盒(上海吉玛公司);抗E-cadherin抗体(货号3195)和抗Twist抗体(46702)(CST公司,美国);抗Calpain2抗体(sc-373966)(Santa Cruz公司,美国);抗GAPDH 抗体(AP0063,内参)、羊抗小鼠IgG-HRP及羊抗兔IgGHRP(BS13278和BS12478)(南京巴傲得公司);聚偏二氟乙烯膜(PVDF膜)(Millipore公司,美国)。
1.1.3 仪器 20、200和1 000μl移液器(Gilson公司,法国);CKX41倒置显微镜(Olympus公司,日本);Allegra 64R Centrifuge台式高速冷冻离心机(Beckman Coulter公司,美国);SW-CJ-2FD超净工作台(苏州净化设备有限公司);DYY-7C电泳仪(GE公司,美国)。
1.2 方法
1.2.1 细胞培养 人口腔鳞癌Tca8113细胞以含12% FBS及1%青链霉素的RPMI 1640高糖培养基培养;细胞放置于37℃、5%CO2的培养箱中,生长至70%汇合度进行传代。
1.2.2 侵袭小室实验检测细胞的侵袭能力 实验前拿出Matrigel胶放于冰上融化。用RPMI 1640培养基稀释Matrigel胶至浓度为250μg/ml。吸取稀释好的培养基基质胶混合物100μl于小室中,避免打入气泡。将培养板放置到培养箱静置3 h。将同步化24 h的Tca8113细胞或siRNA处理过的Tca8113细胞消化制成细胞悬液并调整细胞密度至1×106个/ml,吸取混合均匀的细胞悬液200μl轻轻加入Transwell小室。在小室外的24孔板下室中加入800μl含趋化因子及高浓度FBS的RPMI 1640培养基,放置于培养箱培养24 h。24 h后倒掉侵袭小室中的培养基并用PBS洗2遍,甲醇固定20 min,PBS洗2遍,放入到0.5%结晶紫水溶液中染色20 min,PBS洗2遍,用棉签轻轻擦掉小室内房细胞,放置5~10 min风干。倒置显微镜下观察并取6个视野拍照并计数,计算侵袭率。
1.2.3 蛋白印迹检测蛋白表达 用总蛋白提取试剂RIPA细胞裂解液(使用前20 min加蛋白酶抑制剂,使其终浓度为1 mmol/L)裂解细胞,12 000 r/min离心20 min,吸取上清,采用BCA试剂盒蛋白定量,计算并制备样品。进行蛋白印记检测,每泳道上样量为30 μg,SDS-PAGE电泳分离蛋白,然后将分离蛋白电转移至PVDF膜上;配制5%脱脂牛奶封闭PVDF膜2 h,TBST缓冲液洗膜3次,每次15 min;然后按要求加入Calpain2抗体(1∶1 000)、Twist抗体(1∶1 000)或E-cadherin抗体(1∶1 000)等4℃孵育过夜。一抗处理后,TBST洗膜3次,再加入相应的辣根过氧化物酶标记二抗(1∶2 000),室温杂交1 h,PVDF膜以化学发光试剂盒进行显色,Syngene Imaging System进行成像,以Image J对蛋白印迹条带进行处理和分析。
1.2.4 siRNA转染沉默Calpain2表达 转染前24 h用1 ml高糖1640全培养基将模型细胞接种在6孔板上,每孔4×105个细胞,待细胞汇合度达到70% ~90%时,更换培养基。siRNA的转染浓度为60 pmol/ml,提前准备配制siRNA-lipo2000混合液,预先将lipo2000试剂轻轻摇匀,按需取出适量,用高糖1640培养基稀释并轻轻混合,常温放置5 min;高糖1640培养基稀释siRNA,轻轻混合;将稀释好的lipo2000与稀释好的siRNA混合并轻轻混匀,常温放置20 min以形成siRNA-lipo2000混合物。设立Calpain2转染组(siRNA-Calpain2)和空载对照组(siRNA-NC),将相应siRNA-lipo2000混合液加入含有细胞以及培养液的6孔板中,十字摇晃混合。将培养板置于37℃的CO2培养箱中24 h后进行其他实验。
1.3 统计学方法
采用SPSS 17.0软件对实验结果进行统计学分析处理,数据以±s表示,统计量n=6。整体数据分布不符合正态分布,组内两样本比较用Mann-whitney检验。检验水准α=0.05,P<0.05差异有统计学意义(双尾)。
2 结 果
2.1 FN对Tca8113细胞Calpain2及EMT标志物的影响
Western blot检测Calpain2、Twist和E-cadherin蛋白表达水平;FN(15μg/ml)处理Tca8113细胞12、24、48 h发现,各时间点Calpain2、Twist和E-cadherin相对蛋白表达量,与0 h相比,Calpain和Twist蛋白表达逐渐增加,差异具有统计学意义(P<0.05或P<0.01);E-cadherin蛋白表达逐渐降低(P<0.05或P<0.01)(图1)。
2.2 FN对Tca8113细胞侵袭能力的影响
侵袭小室实验观察FN对Tca8113细胞侵袭能力的影响,与空白对照组(Control)相比,FN(15μg/ml)组细胞侵袭数增加了(116.7±5.1)%(图2)。

图1 FN对Tca8113细胞Calpain2、Twist和E-cadherin蛋白表达的影响Fig 1 The effect of FN on the expression of Calpain2,Twist and E-cadherin proteins in Tca8113 cells
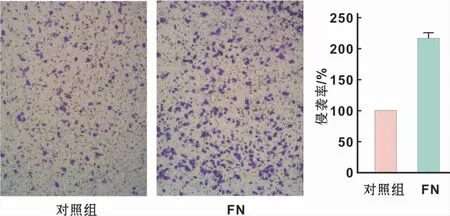
图2 FN对Tca8113细胞侵袭能力的影响(结晶紫染色,×100)Fig 2 The effect of FN on the invasion ability of Tca8113 cells(Crystal violet staining,×100)
2.3 Calpain2沉默对FN诱导的Tca8113细胞EMT标志物的影响
siRNA转染沉默Calpain2蛋白表达,FN处理各组细胞48 h。与siRNA-NC组相比,siRNA-Calpain2组蛋白表达下调(90.3±3.3)%(P<0.01)。与siRNANC组相比,siRNA-Calpain2组由FN诱导的E-cadherin蛋白表达下调及Twist蛋白表达上调被逆转(P<0.01)(图3)。
2.4 Calpain2沉默对FN诱导的Tca8113细胞侵袭能力的影响
siRNA转染沉默Calpain2蛋白表达,FN处理各组细胞48 h。与siRNA-NC组相比,siRNA-Calpain2组细胞侵袭数下降(51.3±4.5)%(P<0.01)(图4)。

图3 Calpain2沉默对FN诱导的Tca8113细胞Twist和E-cadherin蛋白表达的影响Fig3 The effect of calpain2 silencing on FN-induced Twist and E-cadherin protein expression in Tca8113 cells

图4 Calpain2沉默后FN对Tca8113细胞侵袭能力的影响(结晶紫染色,×100)Fig 4 The effect of FN on the invasive ability of Tca8113 cells after Calpain2 silencing(Crystal violet staining,×100)
3 讨 论
EMT在乳腺癌、肝癌、胰腺癌等肿瘤的发生发展中扮演了重要角色[6]。研究报道,口腔鳞癌细胞发生EMT伴随细胞迁移和侵袭能力的增强[7]。而EMT的发生机制为细胞E-Cadherin蛋白的减少或丢失以及N-钙黏蛋白、波形蛋白(Vimentin)或FN等间质表型蛋白表达上调[8]。另外Twist蛋白表达上调也为EMT的标志之一,其为一个高度保守的转录因子,可与E-cadherin结合并抑制后者的活性。
本研究以FN刺激Tca8113细胞后发现模型细胞E-cadherin蛋白表达下调,Twist蛋白表达上调,同时细胞侵袭能力增强。提示FN诱导Tca8113细胞发生EMT。进一步实验发现FN还可诱导Calpain2蛋白表达的上调。为观察Calpain2在FN诱导Tca8113细胞EMT中的作用,本研究采用siRNA转染沉默Calpain2蛋白表达,再以FN刺激模型细胞。结果发现沉默Calpain2后,模型细胞Tca8113由FN诱导的E-cadherin表达下调和Twist表达上调被逆转,FN刺激诱导Tca8113细胞的侵袭活动被抑制。提示,Calpain2可能参与FN诱导的模型细胞Tca8113发生EMT。研究报道,作为Calpain2调节亚基的Calpain4可通过Wnt/βcatenin信号通路的激活促进人黑素瘤细胞EMT[9]。在乳腺癌中,Calpain2可通过MAPK的介导调节乳腺癌细胞MDA-MB-231迁移及黏附[10]。最新研究发现,Calpain2可能参与调节正常乳腺上皮细胞MCF-10A细胞EMT[11]。这些都提示Calpain2与EMT可能存在潜在的调控关系。而Calpain2参与调节口腔鳞癌细胞Tca8113为本研究首次发现,围绕Calpain2或其下游信号靶点进行研究可能为临床治疗口腔鳞癌提供实验依据。
文献已报道Calpain2参与了肿瘤细胞增殖、迁移、侵袭以及凋亡的调控[9-10,12],但其具体的调控机制还未完全明了,有待于进一步的实验研究。因此,本实验组未来会对Calpain2下游信号靶点就行研究探索,为丰富Calpain2的生物学效应做出一定的努力。总之,本研究发现FN能诱导口腔鳞癌Tca8113细胞发生EMT,该作用可能与Calpain2蛋白表达上调相关。

