含1,2-苯并噻嗪结构的咪唑并[1,2-b][1,3,4]三氮唑衍生物的合成及其抗肿瘤活性
王 新,赵小美,张平平,汲 霞,胡国强
(1齐鲁医药学院 药学院,淄博 255213;2河南大学药物研究所,开封 475001)
甲状腺乳头状癌重要的致病机制是RET/PTC基因重排,而RET基因重排的现象在炎症反应中也有存在。肿瘤相关因子NF-κB是免疫和炎症反应重要的调节因子,同时也是肿瘤重要的启动因子[1]。虽然炎症与致癌基因相互作用的机制尚不明确,但有研究表明[2],炎症有促进肿瘤发展的趋势。炎症是肿瘤的特征反应之一,那么炎症与肿瘤之间的关系将为新型抗肿瘤药物的研发提供新的思路。
具有1,2-苯并噻嗪结构母核的抗炎药被称为昔康类药物,第一个上市的药物为吡罗昔康,由吡罗昔康前体酯或吡罗昔康甲基物与2-氨基吡啶反应得到。吡罗昔康是很好的COX-2抑制剂,通过抑制COX-2的活性,从而抑制花生四烯酸的生成,导致前列腺素合成受阻,进而发挥抗炎作用。
目前,1,3,4-三氮唑类化合物广泛应用于各种疾病的治疗中,由于其具有广泛的生物活性,也常常出现在具有生物活性的农药、医药等化合物中。该类化合物具有抗结核[3]、抗肿瘤[4-6]、抗真菌[7-8]、杀菌[9]、抗病毒[10]、抗惊厥[11]、抗癫痫[12]等性能,因而受到广大研究者的广泛关注。基于此,本文以吡罗昔康甲基物为原料,用杂环、稠杂环作为1,2-苯并噻嗪环C-3取代基的生物电子等排体,经多步反应合成一系列咪唑并[1,2-b][1,3,4]三氮唑的衍生物,合成路线见路线1。
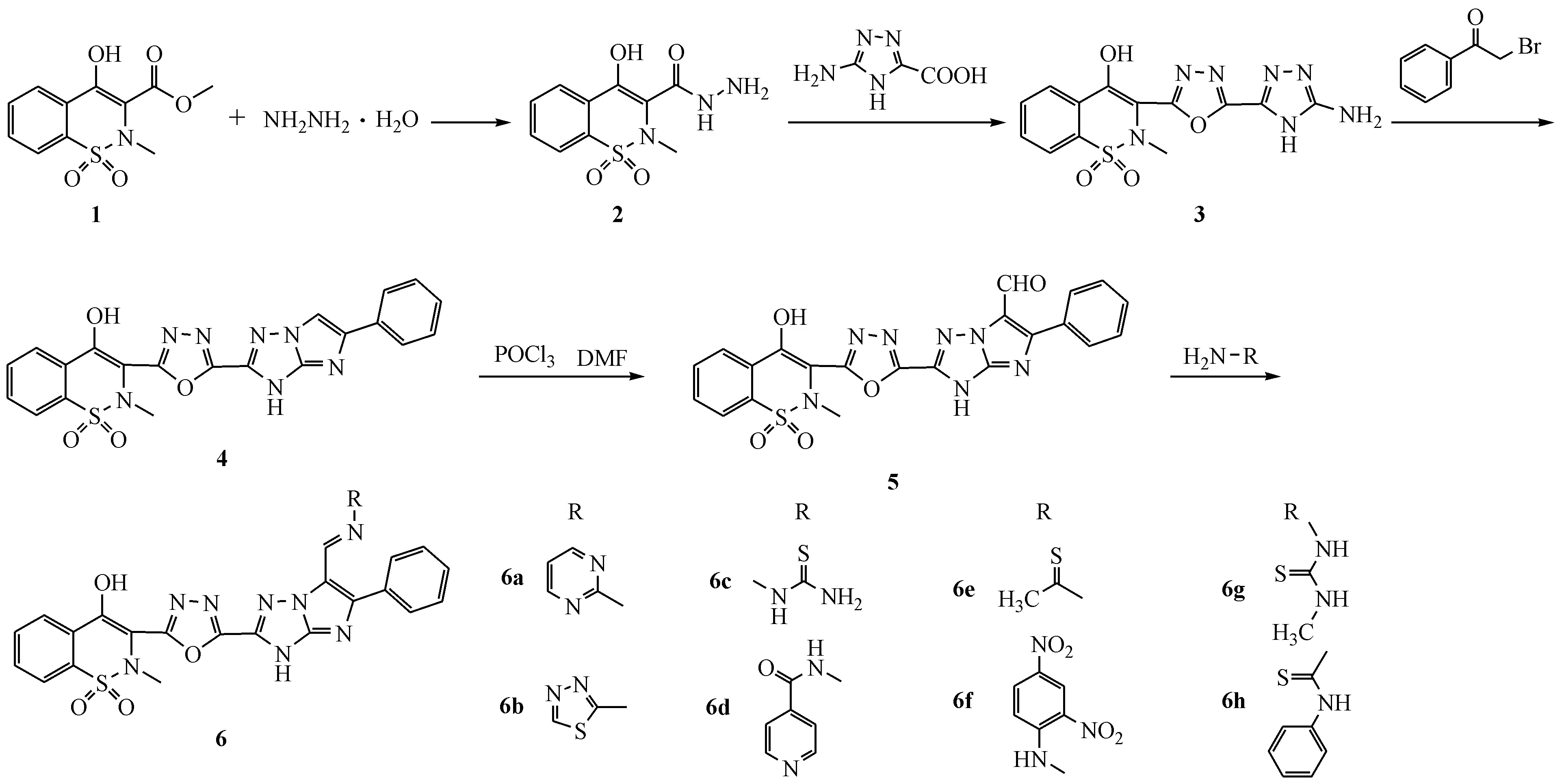
Scheme1 Synthetic route of the target compounds
1 实验部分
1.1 仪器与试剂
熔点用毛细管法测定,温度未校正;AM2400型核磁共振仪(德国Bruker公司);HP1100型质谱仪(美国Agilent公司);PE2400-Ⅱ元素分析仪(美国PE公司);试剂均为市售分析纯,未经处理,直接使用。
1.2 实验步骤
1.2.1 化合物2的合成 将吡罗昔康甲基物1(26.9 g,0.1 mol),80%水合肼(15.0 g,0.3 mol)和无水乙醇270 mL依次加入500 mL三口瓶中,加热回流反应6 h,蒸出乙醇使反应液温度达到100 ℃,再回流6 h。减压回收溶剂,得黏稠状物质,用乙醇重结晶,抽滤得黄色粉末状化合物220.2 g。收率75%,mp:240~242 ℃。
1.2.2 化合物3的合成 取化合物2(13.5 g,0.05 mol),加入三氯氧磷27 mL,冰浴降温至0 ℃左右,控制温度(0~5 ℃),分批加入5-氨基-1,2,4-三氮唑-3-羧酸(7.7 g,0.06 mol),加毕,冰浴(0~5 ℃)反应1 h后,自然升至室温反应6 h,加热回流反应约12 h,将反应液趁热倒入冰水中,调节反应液pH至2~3,得目标化合物。采用乙醇和水的混合溶剂对产物进行重结晶,过滤,干燥,得黄色化合物34.0 g。收率22%,mp:263~265 ℃。
1.2.3 化合物4的合成 取化学物3(3.61 g,0.01 mol),溴代苯乙酮(2.4 g,0.012 mol),无水乙醇54 mL,依次加入到250 mL三口瓶中,加热至回流,反应8 h,TLC检测,原料反应完全后,自然冷却至室温,析出结晶,过滤,得黄色粉末状化合物43.2 g。收率69%,mp:256~259 ℃。
1.2.4 化合物5的合成 向100 mL三口瓶中,加入DMF4.5 mL,冰盐浴降温0 ℃以下,缓慢滴加POCl313 mL,温度小于10 ℃,滴毕,缓慢加入化合物4(2.25 g,0.004 9 mol),加毕,升温至80~90 ℃反应3 h后,冷却至室温,加入甲苯20 mL,缓慢滴加水至无HCl气体生成,升温至70~80 ℃反应1 h,倒入冰水中,乙酸乙酯萃取,饱和NaHCO3洗涤有机层,干燥后浓缩,析出结晶,过滤,得棕色化合物50.7 g。收率29%,mp:236~238 ℃。
1.2.5 化合物6a的合成 向250 mL三口瓶中,加入化合物5(0.49 g,0.001 mol),2-氨基嘧啶(1.2 g,0.013 mol),无水乙醇50 mL,加热至回流,反应6 h,TLC检测,反应结束后,自然冷却至室温,过滤,得黄色化合物6a0.25 g。收率45%,mp:231~233 ℃。
按化合物6a类似的方法分别制备目标物6b~6h。理化性质和光谱数据见表1和表2。
Table1 Physical properties of compounds6a-6h

Compd.FormulaYield/%mp/℃Elementalanalysis/%CHN6aC26H18N10O4S45231-23355.063.0424.626bC24H16N10O4S252226-22850.362.8624.446cC23H18N10O4S255227-22949.143.2527.966dC28H20N10O5S46232-23455.243.2822.966eC24H18N8O4S253220-22252.723.3420.536fC28H19N11O8S41236-23850.182.8522.936gC24H20N10O4S252231-23350.033.5624.346hC29H21N9O4S243241-24355.843.3220.15
Table2 Spectral data of compounds2-5and6a-6h

Compd.1HNMR(DMSO-d6)δ13CNMR(DMSO-d6)δMS(m/z)212.87(1H,s,-NH),12.04(1H,s,-OH),7.36-7.94(4H,m,Ph-H),4.54(2H,s,-NH2),2.96(3H,s,-NCH3)166,157,134,132,129,127,124,111,41230[M+H]+312.92(1H,s,-NH),12.03(1H,s,-OH),7.30-8.04(4H,m,Ph-H),5.64(2H,s,-NH2),2.87(3H,s,-NCH3)167,156,134,132,129,127,124,110,38362[M+H]+412.63(1H,s,-NH),11.84(1H,s,-OH),8.14(1H,s,-C=CH-N),7.14-7.95(9H,m,Ph-H),2.88(3H,s,-NCH3)166,156,140,136,134,132,129,127,124,110,38462[M+H]+512.83(1H,s,-NH),11.78(1H,s,-OH),9.83(1H,s,-CHO),8.04(1H,s,-C=CH-N),7.18-7.93(9H,m,Ph-H),2.98(3H,s,-NCH3)189,157,140,137,134,132,129,126,124,110,39490[M+H]+6a13.12(1H,s,-NH-),12.04(1H,s,-OH),8.08-8.43(3H,m,pyrimidine-H),8.15(1H,s,-N=CH-),7.56-8.04(9H,m,Ph-H),2.94(3H,s,-NCH3)163,160,158,152,149,140,136,134,132,129,127,124,115,110,39567[M+H]+6b13.08(1H,s,-NH-),12.14(1H,s,-OH),8.76(1H,m,-N=CH-S-),8.17(1H,s,-N=CH-),7.56-8.22(9H,m,Ph-H),2.96(3H,s,-NCH3)164,160,158,152,149,146,136,134,132,129,127,124,117,110,38573[M+H]+6c13.13(1H,s,-NH-),12.16(1H,s,-OH),10.28(1H,s,-NH-C=S),8.25(1H,s,-N=CH-),7.52-8.08(9H,m,Ph-H),7.75(2H,s,-NH2),2.85(3H,s,-NCH3)179,163,160,158,152,147,140,136,134,132,129,127,124,115,110,39563[M+H]+6d13.18(1H,s,-NH-),12.25(1H,s,-OH),9.94(1H,s,-O=C-NH-N=),7.68-8.23(4H,m,Pyridine-H),8.15(1H,s,-N=CH-),7.56-8.04(9H,m,Ph-H),2.88(3H,s,-NCH3)164,163,160,158,152,149,140,136,134,132,129,127,124,115,110,38609[M+H]+6e13.02(1H,s,-NH-),12.12(1H,s,-OH),8.09(1H,s,-N=CH-),7.42-8.12(9H,m,Ph-H),2.94(3H,s,-NCH3),1.45(3H,s,-CH3)214,163,160,158,152,149,140,136,134,132,129,127,124,115,110,39,30547[M+H]+6f13.21(1H,s,-NH-),12.02(1H,s,-OH),9.86(1H,s,-NH-N=),8.32(1H,s,-N=CH-),7.42-8.52(12H,m,Ph-H),2.94(3H,s,-NCH3)164,160,157,152,149,140,136,133,132,129,127,124,115,110,38670[M+H]+6g13.13(1H,s,-NH-),12.16(1H,s,-OH),10.28(1H,s,N-NH-C=S),8.25(1H,s,-N=CH-),7.52-8.08(9H,m,Ph-H),7.75(1H,s,-NH-C=S),2.95(3H,s,-NCH3),2.73(3H,s,-CH3)179,163,160,158,152,149,140,137,134,132,129,126,124,115,110,39,31577[M+H]+6h13.58(1H,s,Ph-NH-),13.21(1H,s,-NH-),12.02(1H,s,-OH),8.32(1H,s,-N=CH-),7.42-8.24(14H,m,Ph-H),2.94(3H,s,-NCH3)185,163,160,158,152,149,140,136,134,132,129,127,124,117,115,110,39624[M+H]+
2 抗肿瘤活性
对合成的目标化合物,蒽醌类抗肿瘤药物阿霉素以及母体吡罗昔康甲基物进行抗肿瘤活性评价。采用MTT法测定对人胰腺癌细胞Capan-1(中国医学科学院协和细胞库)和鼠白血病细胞L1210(中国医学科学院协和细胞库)的半数抑制浓度(IC50),结果见表3。

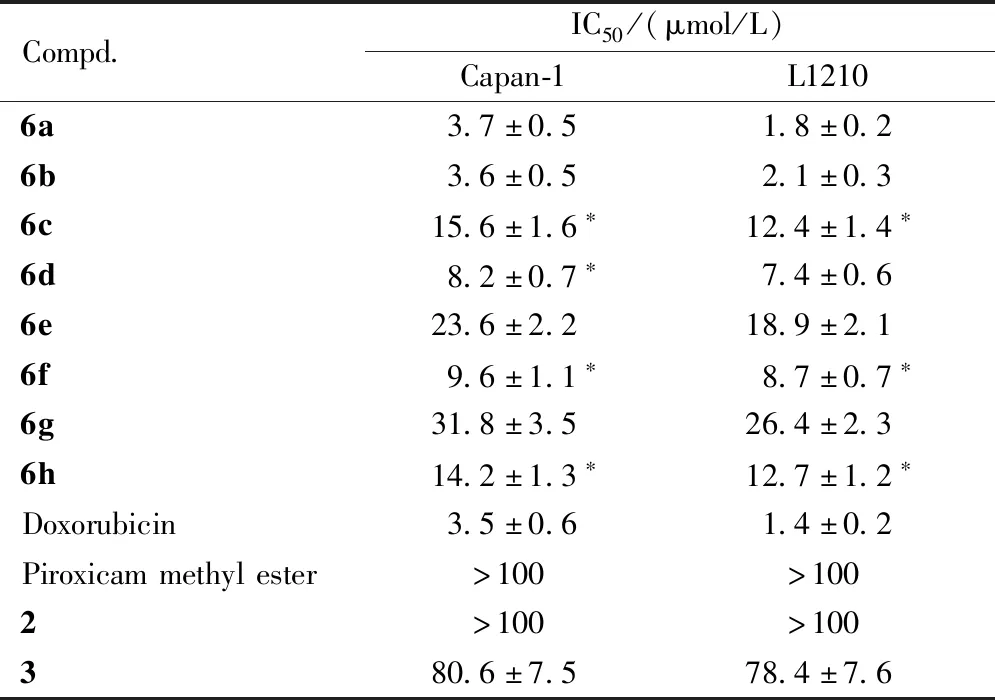
Compd.IC50/(μmol/L)Capan-1L12106a3.7±0.51.8±0.26b3.6±0.52.1±0.36c15.6±1.6∗12.4±1.4∗6d8.2±0.7∗7.4±0.66e23.6±2.218.9±2.16f9.6±1.1∗8.7±0.7∗6g31.8±3.526.4±2.36h14.2±1.3∗12.7±1.2∗Doxorubicin3.5±0.61.4±0.2Piroxicammethylester>100>1002>100>100380.6±7.578.4±7.6
*P<0.05vsdoxorubicin group
体外抗肿瘤实验结果显示,目标化合物对人胰腺癌细胞Capan-1和鼠白血病细胞L1210呈现出不同程度的抑制作用,其中化合物6a、6b对Capan-1和L1210的IC50与对照阿霉素的活性相当。结果表明,咪唑并三氮唑侧链的引入,对提高该类化合物的抗肿瘤活性有一定的作用,具有进一步研究的价值。

