大鼠Pdcd4基因真核载体的构建与表达
钟 波 李 静 吕社民 侯 伟 刘海燕 金巧艳 魏 伟
程序性细胞死亡因子4(programmed cell death 4,Pdcd4)基因最初被发现与细胞的程序性死亡有关[1]。该基因在大鼠定位于1q55, cDNA全长为1410bp,所编码的蛋白质共含个469氨基酸。笔者在之前的研究中应用抑制性消减杂交技术筛选出Pdcd4作为抗原诱导肺部炎症上调表达的差异表达基因[2]。为进一步研究该基因的功能,以E3大鼠为研究对象,克隆其肺组织Pdcd4基因并构建pEGFP-C1-Pdcd4重组真核载体,为揭示该基因的功能建立基础。
材料与方法
1.菌株与载体:所用感受态DH5α大肠杆菌菌种、真核表达载体pEGFP-C1均为西安交通大学医学部基础医学院分子生物学系实验室保存。本研究选用含有绿色荧光蛋白及Hind Ⅲ与Xho Ⅰ酶切位点的pEGFP-C1质粒作为重组载体。其结构与多克隆位点如图1所示。
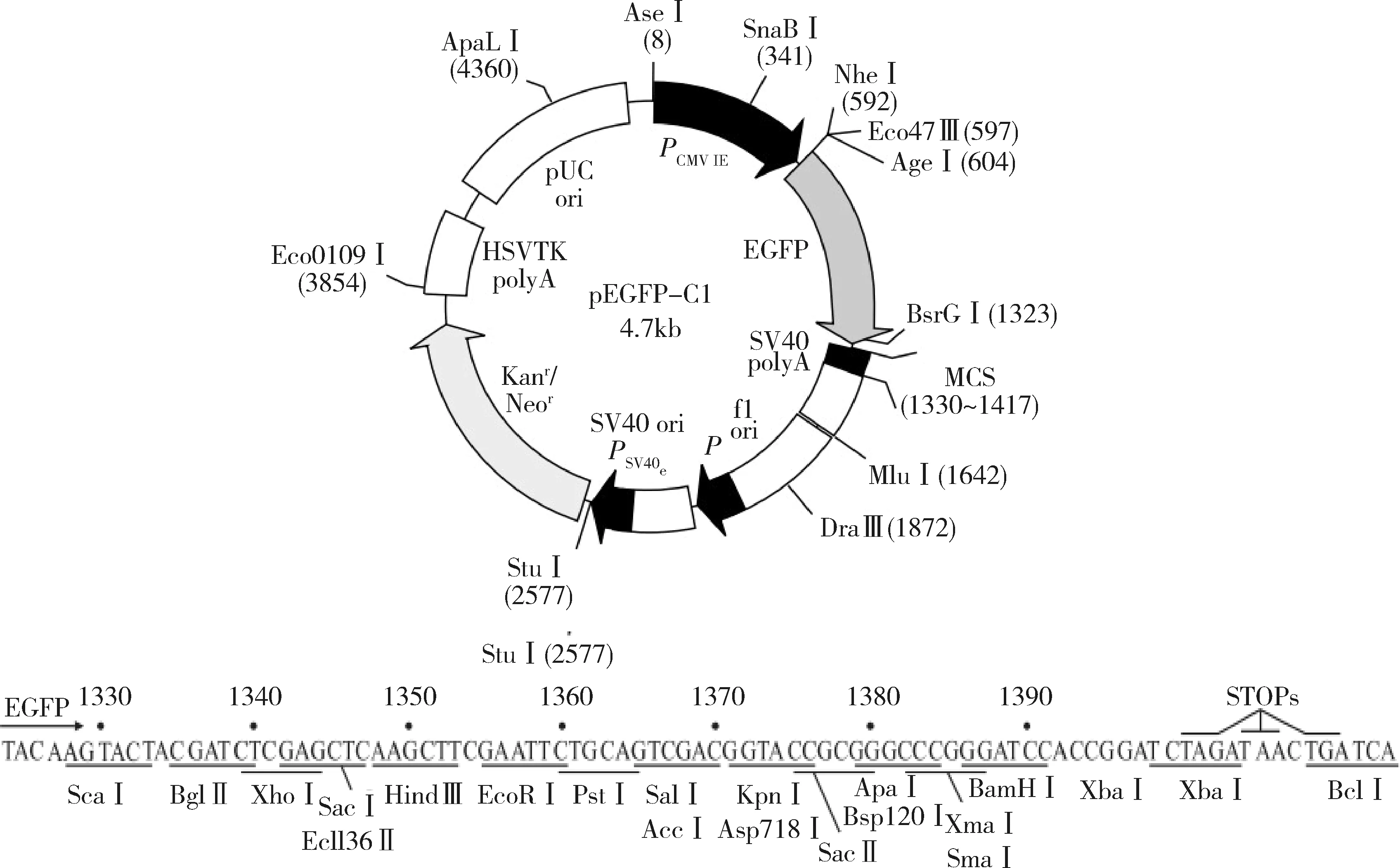
图1 pEGFP-C1载体结构和多克隆位点示意图
2.细胞与实验动物:本研究使用大鼠巨噬细胞系NR8383细胞与8周龄近交系E3大鼠(SPF级动物房繁育),均为西安交通大学医学部基础医学院生物化学与分子生物学系所保存。
3.试剂:Trizol®Reagent、Lipofectamine 2000购自美国 Invitrogen公司,RevertAidTM First Strand cDNA Synthesis Kit、限制性内切酶Hind Ⅲ与Xho Ⅰ购自加拿大Fermentas公司,质粒提取试剂盒购自北京天根生物技术公司,胶回收试剂盒购自北京博大泰克生物基因技术有限责任公司,T4 DNA连接酶购自美国Sigma公司,胰蛋白胨及酵母提取物购自英国Oxoid公司,高保真Taq酶、DNA Marker购自日本 TaKaRa 公司,F12K培养基、胎牛血清购自美国HyClone公司,其他试剂均为国产分析纯。6孔板购自美国Corning公司,倒置相差显微镜及正置荧光显微镜购自日本Olympus公司。
4.引物:PCR引物均由北京三博远志生物技术有限责任公司合成,序列信息如表1所示。

表1 PCR引物信息
5.实验方法
(1) E3大鼠肺组织总RNA提取:将大鼠称重,按1g/kg体重乌拉坦(质量体积比为20%)的剂量麻醉大鼠;经腹主动脉取血,从甲状软骨处剪断气管,分离肺组织,放入研钵中加液氮彻底研磨,加Trizol室温放置5min,加入1/5体积三氯甲烷,混匀15s,室温静置10min,4℃ 12000r/min离心20min,取上层水相,加入等量预冷的异丙醇,混匀后-20℃放置2h,4℃ 12000r/min离心15min。弃上清,加入1ml预冷的75%乙醇,重新悬浮沉淀,7500r/min离心5min。弃上清,使剩余乙醇彻底挥发。20μl DEPC-H2O溶解RNA,所得RNA溶液保存在-80℃低温冰箱备用。微量核酸/蛋白定量仪上测定总RNA浓度,RNA电泳鉴定总RNA的完整性。
(2) cDNA反转录与PCR扩增Pdcd4 cDNA全长:按照RevertAidTM First Strand cDNA Synthesis Kit说明书操作,反应体系oligo(dT)18引物1μl,RNA 2μg,DEPC处理水加至总体积12μl,混匀、离心。70℃孵育5min后于冰上放置,加入5×反应缓冲液4μl,dNTP(10mmol/L)2μl,M-MLV 反转氯酶1μl, 核糖核酸酶抑制剂1μl。混匀、离心,42℃孵育1h,70℃ 10min终止反应。建立Pdcd4全长扩增的反应体系:cDNA 0.5μl,Pdcd4克隆上游引物1μl,Pdcd4克隆下游引物1μl,高保真Taq酶0.5μl,5×Taq酶缓冲液10μl,dNTP 4μl,H2O 33μl。反应条件95℃10min,30个循环95℃ 45s、57℃ 45s、72℃ 1.5min,循环结束,72℃ 延长10min。生成的PCR扩增产物用于后续酶切实验。
(3)重组质粒的构建与鉴定:①建立酶切PCR扩增产物反应体系:Hind Ⅲ 2μl,Xho Ⅰ 2μl,10×M缓冲液 3μl,PCR扩增产物20μl,H2O 3μl。建立pEGFP-C1质粒载体反应体系:Hind Ⅲ 2μl, Xho Ⅰ 2μl,10×M缓冲液 5μl, pEGFP-C1质粒 30μl, H2O 11μl。37℃酶切过夜。将双酶切好的目的DNA片段和载体电泳鉴定,之后用胶回收试剂盒回收;②建立连接反应体系:DNA片段8μl,pEGFP-C1载体4μl,T4 DNA连接酶1μl,10×连接缓冲液 2μl,H2O 5μl,16℃水浴连接过夜。取5μl连接产物加入200μl DH5α感受态细胞中,冰上放置30min。42℃热激90s,冰上放置5min。加入LB培养基1ml,37℃摇床150r/min复苏1h。离心1min后,弃掉上清900μl,剩下的菌液混匀后涂布在含卡那霉素的LB固体培养基平板上,菌液吸收后,倒置放入37℃培养箱中过夜培养。挑选单克隆菌落在LB培养液(含卡那霉素)中37℃过夜扩增。次日经菌液 PCR 检测鉴定插入片段,并按照质粒提取试剂盒的说明步骤提取质粒。将经菌液 PCR 检测鉴定有插入片段的质粒测序送交生物公司测序,后至 NCBI数据库行BLAST比对,确定插入片段无突变,表明克隆构建成功。
(4)细胞转染:转染共分3组:空白对照组、pEGFP-C1组和pEGFP-C1-Pdcd4组,每组3个复孔。6孔板中每孔接种8×105个NR8383细胞,加2ml 10%胎牛血清F12K培养基培养,接种24h后将培养基换为2ml不含胎牛血清的F12K培养基。取无菌EP管加入脂质体5μl和245μl无血清培养基,混匀后37℃孵育5min。取无菌EP管,加入2μg质粒DNA,加入无血清培养基至总体积为250μl,每种质粒配3份,空白对照组只加无血清培养基250μl,混匀后37℃孵育5min。各取一管脂质体与一管质粒混合,使总体积为500μl,瞬时离心,37℃孵育20min。将脂质体和质粒的混合物加入6孔板对应的孔中。24h后倒置荧光显微镜下观察绿色荧光的表达以确定转染效率。同样的转染共重复3次,将3次的结果取平均值为最终结果。
(5)总RNA提取、cDNA反转录与RT-qPCR:转染24h后倒置荧光显微镜下可以观察到明显的绿色荧光表达,收集细胞于1.5ml EP管中,1000r/min离心10min,离心后取一半沉淀加入1ml Trizol并吹打数次。按前述步骤提取总RNA,-80℃保存备用。测定总RNA浓度,电泳鉴定总RNA的完整性。按照前述的方法反转录合成cDNA,产物保存于-20℃备用。在mRNA水平检测细胞中Pdcd4在体RNA干扰的效率,反应体系:20倍稀释的cDNA 4μl、SYBR®Premix Ex TaqTM Ⅱ 4μl、Pdcd4上游引物0.5μl、 Pdcd4下游引物0.5μl、H2O 1μl,混匀、瞬时离心。反应条件95℃ 1min,40个循环95℃ 10s,退火温度30s,72℃ 30s,熔解曲线41个循环,55~95℃ 30s。引物信息见表1,选GAPDH为内参,结果采用ΔΔCt法计算相对基因表达量。
(6)Western blot法检测Pdcd4的表达水平:细胞离心后取另一半沉淀加入含有蛋白酶抑制剂的RIPA细胞裂解液,冰上放置30min,12000×g4℃离心20min,取上清,BCA法测定蛋白浓度。常规方法制备分离胶、浓缩胶。将蛋白样品与5×上样缓冲液混合,100℃保温5min使蛋白变性,取50μg蛋白上样,电泳分离后将蛋白质从凝胶中转移到NC膜上。5%脱脂奶粉室温封闭1h。Pdcd4(山羊抗大鼠)一抗使用浓度为1∶200,β-actin使用浓度为1∶500,4℃孵育过夜。1×TBST洗膜3次×15min。Pdcd4(兔抗山羊)二抗使用浓度为1∶5000,β-actin使用浓度为1∶1000,26℃孵育1h。1×TBST洗膜3次×15min。ECL显色,发光。
结 果
1.肺组织总RNA电泳鉴定:提取的肺组织总RNA经微量核酸蛋白定量仪和1%琼脂糖凝胶电泳鉴定。总RNA电泳结果显示总RNA条带清晰,28S∶18S约为(1.5~2.0)∶1.0(图2)。
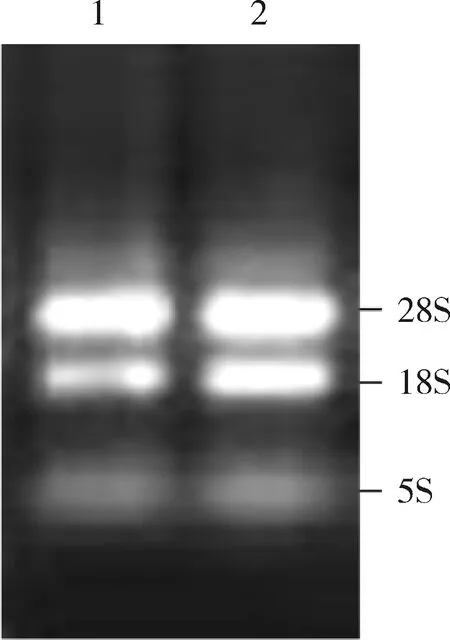
图2 电泳检测肺组织总RNA1.2μl大鼠肺组织总RNA上样;2.3μl大鼠肺组织总RNA上样
2.重组质粒的构建与鉴定:首先以大鼠肺组织cDNA为模板,用特异性引物PCR获得Pdcd4的cDNA全长,与pEGFP-C1质粒载体同时双酶切,双酶切后的Pdcd4 cDNA片段大小约1400bp,pEGFP-C1载体在酶切之前表现为两种条带,酶切之后形成线性化条带,大小均一(图3A)。
将pEGFP-C1载体片段和Pdcd4 cDNA连接后转化入大肠杆菌,涂平板过夜培养后见平板长满菌落,随机挑取10个单独菌落行过夜培养扩增,次日行菌液 PCR 检测,部分克隆结果见阳性条带(图3B),片段大小约1400bp,这些克隆为阳性克隆,取相应质粒送公司测序,测序结果显示未见变异重组质粒构建成功。

图3 双酶切与菌液PCR电泳结果A.Pdcd4 全长cDNA与pEGFP-C1质粒载体的双酶切电泳鉴定:1.Pdcd4 全长cDNA双酶切前; 2.Pdcd4 全长cDNA双酶切后; 3.pEGFP-C1质粒载体双酶切前;4.pEGFP-C1质粒载体双酶切后;M.DL2000 DNA marker;B.菌液 PCR产物电泳鉴定:1、2.随机排选不同克隆的菌液PCR产物;M.DL2000 DNA marker
3.NR8383细胞转染:将构建好的重组pEGFP-C1-Pdcd4质粒和对照空载体质粒pEGFP-C1分别转染大鼠巨噬细胞系NR8383细胞, 24h后于荧光倒置显微镜下观察转染效率,可以看到细胞中有明显的绿色荧光的表达(图4),转染成功。

图4 细胞转染后绿色荧光蛋白的表达(×100)A、C.细胞在光镜下的形态;B、D.细胞在荧光显微镜下的形态及绿色荧光蛋白的表达
4.检测Pdcd4的表达:转染24h后显微镜下可见细胞内有明显绿色荧光蛋白的表达,收集细胞,通过real-time PCR和Western blot法分别检测转染后细胞Pdcd4在mRNA水平与蛋白质水平的表达变化,在转染pEGFP-C1-Pdcd4质粒后,NR8383细胞Pdcd4的表达与对照空载体pEGFP-C1组比较明显上调(图5)。
讨 论
Pdcd4基因是1995年由Chen等[3]在小鼠体内发现的与细胞凋亡有关的基因,在细胞发生程序性死亡时被诱导产生。Pdcd4在不同的种属中有不同的名称,如在小鼠又名MA-3蛋白、拓扑异构酶抑制子抑制蛋白,在人类又被称为肿瘤性转化抑制剂、核抗原H731、197/15a蛋白,在大鼠被称为死亡上调基因蛋白[4]。

图5 转染后NR8383细胞Pdcd4的表达A.real-time PCR;B.Western blot法
Pdcd4蛋白质最显著的结构特征是在其C端有两个重要的螺旋结构域MA-3,Pdcd4 MA-3功能域通过一个保守表面区与真核翻译起始子eIF4A的N端功能域相互作用、发生结合,从而抑制核糖体复合物的形成和蛋白质的合成,促进细胞凋亡[5]。Waters等[6]对Pdcd4的三维空间结构进行了研究,解析了Pdcd4的C端MA-3结构域的结构,找到了它与eIF4A相互作用的特征,并且对比了来自单个功能域和串联的MA-3部位的核磁共振谱的特点,发现Pdcd4 MA-3(C)由三螺旋-转角-螺旋发卡结构组成。
本实验克隆了E3大鼠肺组织Pdcd4基因,将其CDS序列克隆至pEGFP-C1质粒中构建了重组真核载体pEGFP-C1-Pdcd4,通过酶切鉴定、基因测序和序列比对,验证了目的基因的正确性。pEGFP-C1-Pdcd4成功转染大鼠巨噬细胞系NR8383细胞并表达出绿色荧光蛋白,增加NR8383细胞中Pdcd4基因的表达。
有多种miRNA可以影响Pdcd4的表达,主要包括miR-21、miR-141、miR-16、miR-96、miR-503等[7~11]。这些miRNA通过对Pdcd4表达的调控,最终影响肿瘤细胞的增殖、浸润、转移及对化疗药物的反应等。近年来发现长链非编码RNA(long non-coding RNAs,LncRNAs)也通过对Pdcd4表达的干预参与影响肿瘤的进展。例如,LncRNA CASC15可以在Pdcd4基因的启动子区募集zeste基因增强子同源物、增加组蛋白 H3K27的水平,沉默Pdcd4的表达,进而促进黑色素瘤的进展[12]。
综上所述,目前关于Pdcd4基因功能的研究主要集中于以上这些促进凋亡、抑制肿瘤的方面,笔者之前的研究发现Pdcd4是抗原诱导肺部炎症上调表达的差异表达基因,其差异表达来源于肺泡的巨噬细胞[2]。对于该基因在炎症中的作用文献报道较少,关于其在巨噬细胞中作用的文献更少。本研究成功克隆获得E3大鼠Pdcd4基因编码序列,即可直接用于后期Pdcd4基因的功能探索及上调表达等研究。

