AAV6-hNGFβ转染对大鼠脑缺血再灌注损伤的保护作用与PI3K/Akt信号通路的关系
罗 荔 张 洁 张 丽 李晓岚
临床上缺血性脑损伤(cerebral ischemia injury)较常见,包括动脉粥样硬化引发的局灶性脑缺血、心跳骤停引发的全脑缺血等,脑卒中具有高发生率和高复发率,已成为世界第2常见死亡原因和主要致残原因[1]。神经生长因子(nerve growth factor, NGF)是一种非常重要的活性因子,近年来有研究发现,在脑缺血再灌注动物模型中,内源性NGF mRNA表达会显著增加,从而产生神经保护和修复作用,减轻脑缺血再灌注损伤[2]。在细胞的分化、增殖和凋亡等生命周期活动中,PI3K/Akt信号通路可以发挥调节作用,是一条十分重要的细胞通路[3]。PI3K/Akt信号通路中蛋白激酶B(Akt)磷酸化后处于活化状态,可以激活许多细胞保护调节机制[4]。本研究基于脑缺血再灌注大鼠模型,通过转染AAV6-hNGFβ后检测NGF、Akt、p-Akt、Bcl-2和Bax等蛋白及mRNA水平改变,探讨转染AAV6-hNGFβ减轻大鼠心肌缺血再灌注损伤作用与PI3K/Akt信号通路的关系,为脑缺血再灌注的治疗提供分子生物学依据。
材料与方法
1.实验动物及分组: 12周龄雄性SD大鼠72只,体质量250~300g,由新疆医科大学实验动物中心提供,实验动物许可证号:XJMU201700314。实验期间动物饲养于新疆医科大学动物房,每日光照约12h,自由饮食和饮水。为避免实验环境的改变对大鼠的影响,所有大鼠饲养2周后进入实验。72只SD大鼠随机方法分为4组(n=18),即假手术(sham)组、脑缺血再灌注(I/R)模型组、hNGFβ(I/R模型组+AAV6-hNGFβ-EGFP)组和阴性对照(I/R模型组+AAV6-EGFP)组,脑缺血再灌注模型成模后,模型组大鼠经股静脉注射0.3ml 0.9%氯化钠注射液,hNGFβ组大鼠股静脉单次注射0.3ml携带hNGFβ-EGFP基因的腺相关病毒(2×1010TU/ml),阴性对照组大鼠股静脉单次注射0.3ml携带EGFP(绿色荧光蛋白)基因的腺相关病毒(2×1010TU/ml),各组注射1周后取材进行脑组织荧光显色。
2.材料: hNGFβ过表达腺相关病毒AAV6-hNGFβ(中国上海吉玛制药技术有限公司),水合氯醛、多聚甲醛(中国成都科龙化工试剂厂),Akt、p-Akt、NGF、Bcl-2和Bax抗体(美国CST公司),TUNEL 凋亡检测试剂盒、反转录酶和荧光定量PCR试剂(中国上海生工生物工程有限公司)。
3.脑缺血再灌注模型的建立: 参照Longa法复制大鼠局灶性脑缺血再灌注动物模型[5]。大鼠用10%水合氯醛麻醉后,分离右侧颈总动脉、颈外动脉和颈内动脉,将制备好的线栓插入颈总动脉,推进约18~20mm,遇到阻力即可停止,阻断2h后,缓慢拨出线栓,扎紧动脉残端,逐层缝合组织和皮肤,缺血再灌注损伤模型制备成功。假手术组除不插线栓外,其余步骤同上。术后按照改良的神经功能缺损评分(modified neuro-logical severity scores,mNSS)进行评价,对动物进行运动实验、感觉实验(视觉、触觉和本体感觉等)、横杆平衡实验和反射检查,正常为0分,最高分为18分,分值越高神经系统损伤越严重。
4.脑梗死面积测定: 分别在1、2、4周对各组大鼠进行脑梗死面积的测定,每组6只,经水合氯醛麻醉后,迅速开胸进行心脏灌流,灌流后快速断头取脑,洗净后将脑组织在-20℃冰箱里冷冻20min,以2mm间距冠状切成5~6片,用2%的TTC磷酸盐缓冲液37℃避光染色30min,然后进行4%多聚甲醛固定24h,采用医用计算机彩色图像分析系统计算梗死体积。
5.免疫组化和TUNEL凋亡细胞检测: 用免疫组化方法检测NGF、Bcl-2、Bax和p-Akt的表达。石蜡切片常规二甲苯,乙醇脱蜡至水,水洗后分别滴加相应一抗,4℃静置过夜,HRP标记的二抗孵育30min,DAB显色后苏木精复染,常规脱水、透明、树脂封片,镜下观察,细胞核呈紫蓝色,阳性产物呈棕黄色或黄色。使用TUNEL 凋亡试剂盒进行凋亡细胞检测,按说明书中链霉抗生物素蛋白(SABC)步骤染色,石蜡切片经常规脱蜡,至水,蛋白酶K消化,TdT酶和DIG-dUTP混合液孵育2h,生物素偶联抗地高辛抗体孵育2h,SABC孵育2h,DAB显色,苏木精复染,脱水,封片,细胞核出现棕黄色颗粒为凋亡细胞。
6.Western blot法检测: 收集各实验组大鼠脑组织,匀浆处理后抽提总蛋白,BCA法测定蛋白浓度,取蛋白样品进行SDS-PAGE电泳,电转到硝酸纤维素膜,5%脱脂奶粉封闭,加入一抗后4℃孵育过夜,然后加入二抗室温孵育1h后显色曝光。采用图像分析软件Image J分析目的条带,分别计算目的条带与内参的灰度值,用两者比值表示目的蛋白的相对表达强度。
7.反转录-聚合酶链反应(RT-PCR)检测: 收集各实验组大鼠脑组织,总RNA 的提取及荧光定量PCR参照试剂说明书进行实验。
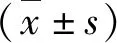
结 果
1.转染效率观察及脑缺血再灌注后神经功能评分比较: 大鼠脑缺血/再灌注术造模成功,治疗组和阴性对照组分别注射AAV6-hNGFβ-EGFP和AAV6-EGFP 1周后,荧光显微镜下观察脑组织神经元细胞中开始有绿色荧光表达,转染效率较高,其余各组则无荧光(图1)。治疗组开始注射AAV6-hNGFβ-EGFP后1、2和4周,神经功能评分同模型组及阴性对照组(模型组+AAV6-EGFP)比较,均出现明显降低(P<0.05,P<0.01),结果见表1。

图1 大鼠脑组织神经元绿色荧光表达(×200)A.阴性对照组; B.hNGFβ组

表1 各组大鼠神经功能评分比较
与假手术组比较,*P<0.01;与模型组比较,#P<0.05;与阴性对照组比较,△P<0.01
2.各组大鼠脑梗死体积比较:图2的TTC染色结果显示脑缺血再灌注损伤4周后脑梗死情况,除假手术组外其余各组均可见白色梗死部分。与假手术组比较,模型组大鼠的脑梗死体积明显增加,差异有统计学意义(P<0.01);与模型组及阴性对照组比较,hNGFβ组脑梗死体积明显减少,差异有统计学意义(P<0.05)。模型组与阴性对照组比较,脑梗死体积差异无统计学意义(P>0.05,图3)。

图2 各组大鼠脑组织TTC染色A.假手术组; B.模型组; C.阴性对照组; D.hNGFβ组
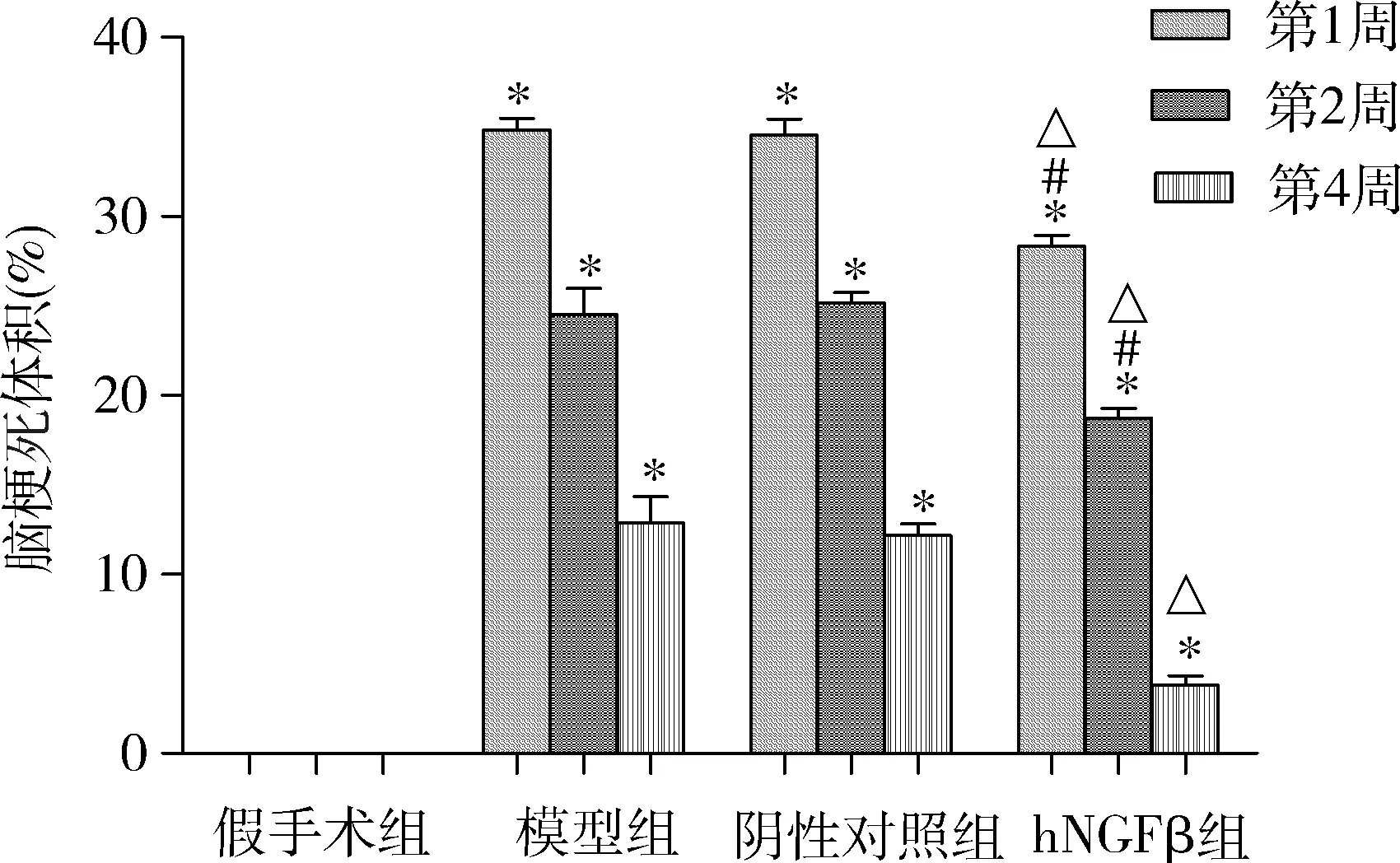
图3 各组大鼠脑梗死体积比较与假手术组比较,*P<0.01;与模型组比较,#P<0.05;与阴性对照组比较,△P<0.01
3.免疫组化检测NGF、p-Akt、Bcl-2和Bax表达变化: 假手术组大鼠脑组织皮质区NGF表达较多,p-Akt表达较少;造模成功后4周,与假手术组比较,模型组和阴性对照组皮质区NGF表达减少,p-Akt表达增加;hNGFβ组转染AAV6-hNGFβ-EGFP 4周后,与模型组和阴性对照组比较,大鼠脑组织皮质区NGF表达显著升高,p-Akt表达也明显增加(图3),Akt的磷酸化水平增强。另一方面,与假手术组比较,模型组大鼠皮质区Bcl-2蛋白表达显著减少,Bax表达明显增强;hNGFβ组转染AAV6-hNGFβ-EGFP 4周后,与模型组和阴性对照组比较, Bcl-2表达显著增加,Bax表达明显减少。
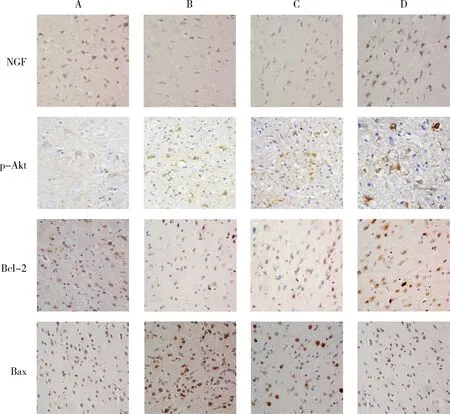
图4 大鼠脑皮质区NGF、p-Akt、Bcl-2和Bax免疫组化染色(×200)A.假手术组; B.模型组; C.阴性对照组; D.hNGFβ组
4.TUNEL凋亡细胞检测: 与假手术组比较,模型组大鼠的脑组织内神经元细胞出现棕褐色颗粒,不规则形态的凋亡神经元数量明显增加;与模型组及阴性对照组比较,hNGFβ组神经元细胞核染色变浅,凋亡细胞明显减少。模型组与阴性对照组比较,凋亡神经元数量接近(图5)。
5.转染AAV6-hNGFβ-EGFP对大鼠脑缺血再灌注后Akt磷酸化水平的影响: 收集各组大鼠脑组织,采用qPCR法和Western blot法检测脑组织皮质区不同病程(1、2、4周)NGF、Akt和p-Akt的mRNA和蛋白表达水平。与假手术组比较,脑缺血再灌注损伤发生后,模型组和阴性对照组大鼠脑组织NGF的mRNA和蛋白表达明显减少,Akt的mRNA表达水平显著升高,p-Akt蛋白表达显著增强,Akt磷酸化水平(p-Akt/Akt)明显升高(P<0.01,图6)。hNGFβ组转染AAV6-hNGFβ-EGFP后,与模型组和阴性对照组比较,大鼠脑组织NGF的mRNA和蛋白表达显著增强,Akt的mRNA表达显著升高,p-Akt表达也明显增加,Akt的磷酸化水平显著提升(P<0.01),见图6。
图5 TUNEL检测凋亡细胞(×400)A.假手术组; B.模型组; C.阴性对照组; D.hNGFβ组
6.转染AAV6-hNGFβ-EGFP对大鼠脑缺血再灌注后Bcl-2和Bax表达影响: 收集各组大鼠脑组织,采用qPCR和Western blot法检测脑组织皮质区不同病程(1、2、4周)Bcl-2和Bax的表达水平。Bcl-2和Bax的qPCR和Western blot法检测结果如图6所示,与假手术组比较,模型组Bcl-2的mRNA和蛋白表达显著减少(P<0.01),Bax的mRNA和蛋白表达显著升高(P<0.01),模型组和阴性对照组中,Bcl-2和Bax的mRNA及蛋白表达差异无统计学意义(P>0.05);与模型组比较,hNGFβ组Bcl-2的mRNA和蛋白表达表达显著升高(P<0.01),Bax的mRNA和蛋白表达显著减少(P<0.01)。
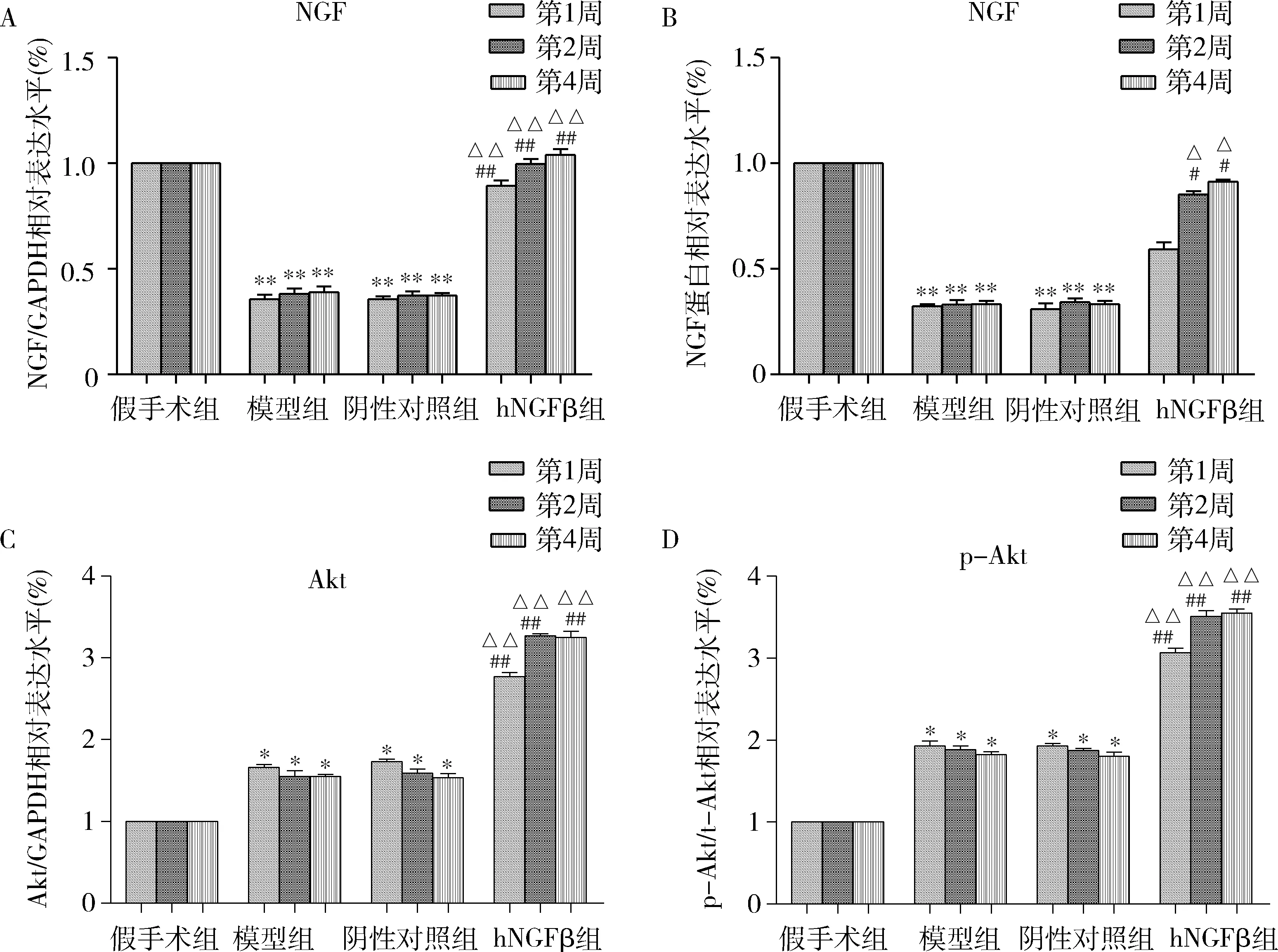
图6 大鼠脑皮质区NGF、Akt和p-Akt的mRNA和蛋白表达变化A.NGF mRNA变化; B.NGF蛋白变化; C.Akt mRNA变化; D.p-Akt蛋白变化; 与假手术组比较, *P<0.01,**P=0.000;与模型组比较,#P<0.05,##P<0.01;与阴性对照组比较,△P<0.05,△△P<0.01
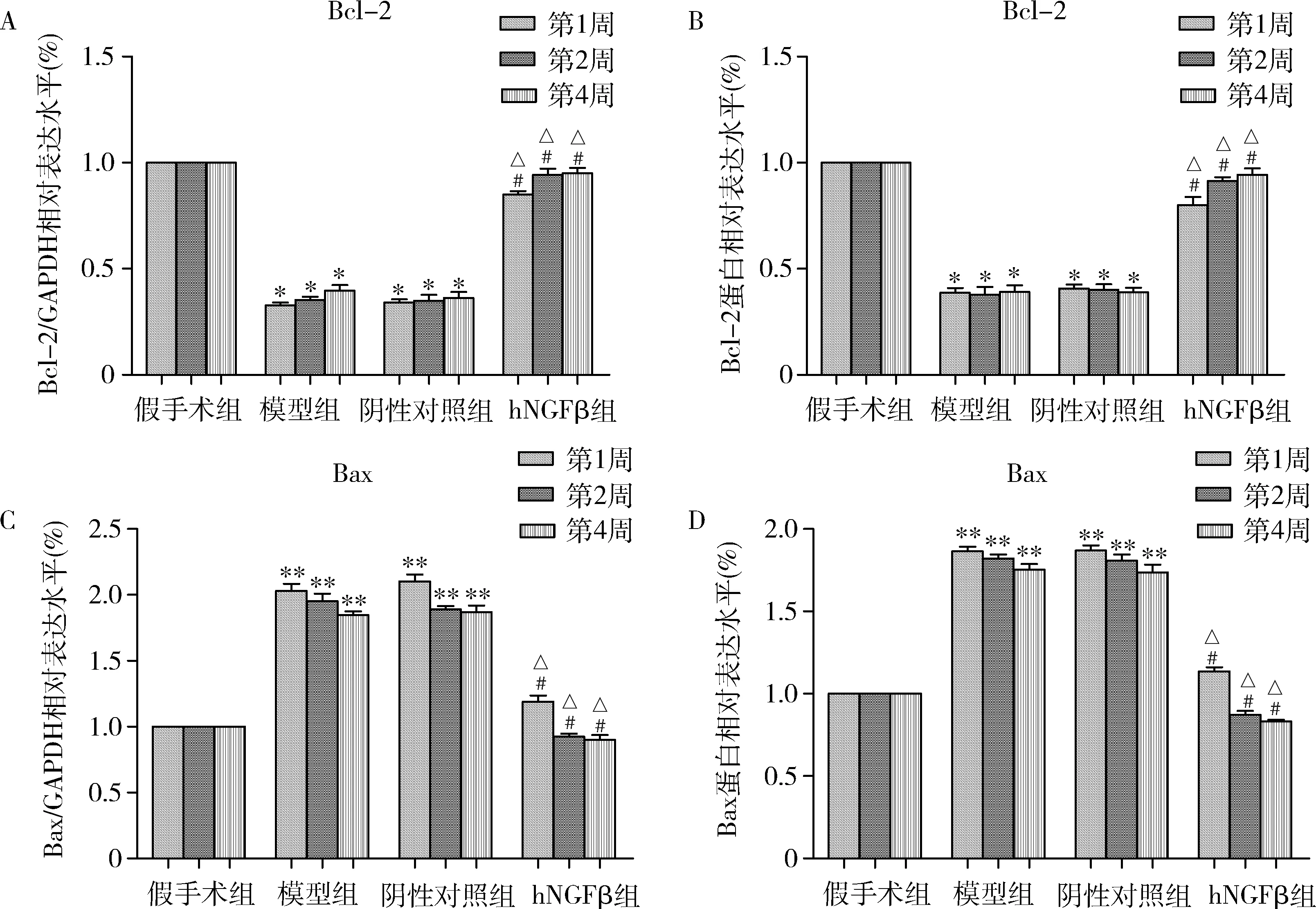
图7 大鼠脑皮质区Bcl-2和Bax的mRNA和蛋白表达变化A.Bcl-2 mRNA变化; B.Bcl-2蛋白变化; C.Bax mRNA变化; D.Bax蛋白变化; 与假手术组比较, *P<0.01,**P=0.000;与模型组比较,#P<0.01;与阴性对照组比较,△P<0.01
讨 论
大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)模型不需开颅,对脑损伤较小,脑病变范围与人体相近,部位恒定,梗死率高,是最常用的局灶性脑缺血动物模型[5]。模型制备完成后,可通过改良神经功能缺损评分和脑梗死体积对模型进行评价。本研究在脑缺血再灌注损伤大鼠体内注射AAV6-hNGFβ-EGFP,进行基因治疗,使合成产物 hNGFβ得到高表达,从而减轻大鼠脑缺血再灌注损伤。实验结果表明,治疗组开始注射AAV6-hNGFβ-EGFP后,神经功能评分同模型组与阴性对照组比较,均出现明显降低。此外,大鼠的脑梗死体积计算结果也表明,转染AAV6-hNGFβ-EGFP可以减少大鼠脑缺血再灌注损伤后的脑梗死体积。目前以改变细胞遗传物质为基础的基因治疗已得到广泛应用,席聪等[6]在I/R大鼠中注射rAAV-PR39-ADM过表达抗菌肽(PR39)和肾上腺髓质素(ADM)后,可改善大鼠脑缺血再灌注后局部供血,促进血管再生,保护神经元,减轻脑缺血再灌注损伤。
脑缺血再灌注损伤机制较复杂,包括细胞内钙超载、自由基生成及高能磷酸化合物缺乏等[7~9]。在脑缺血再灌注程中,能保护神经细胞的因子减少,损害神经细胞的因子增多(如氧自由基、炎性和凋亡因子等),从而严重影响脑缺血性脑卒中患者的愈后,而保护神经元细胞并减少其凋亡,可以防止脑卒中引起的神经功能障碍[10~12]。作为神经营养因子家族(NTFs)中一种非常重要的活性因子,NGF在脑内主要来源于神经元和胶质细胞。脑缺血性损伤发生后,NGF不仅可以保护和减少神经元损伤,还可以促进神经元的修复,提高神经元存活率。脑缺血损伤发生早期,NGF会出现短时反应性表达,发挥神经元保护作用,但表达水平和时间有限,难以发挥全面持久的神经元保护作用。
对于脑缺血后神经损伤的保护而言,能持续增强NGF表达的治疗方法,具有十分重要的意义。在细胞的分化、增殖和凋亡等生命周期活动中,PI3K/Akt信号通路可以发挥调节作用,该通路由许多靶点组成,其中蛋白激酶B(Akt)是最关键的一个,因为Akt磷酸化后处于活化状态,通过激活可作用于下游的B细胞淋巴瘤/白血病2(Bcl-2)家族等靶点,可降低下游Bax蛋白的表达,抑制凋亡,从而起到神经保护作用[13]。本研究结果表明,与假手术组比较,NGF表达显著下降,PI3K/Akt通路受到抑制,Bcl-2蛋白表达显著降低,Bax蛋白表达明显增加,差异有统计学意义(P<0.05);与模型组和阴性对照组比较,hNGFβ组NGF表达显著升高,PI3K/Akt通路得到激活,Bcl-2蛋白表达也显著升高,Bax蛋白表达明显降低,差异有统计学意义(P<0.05)。转染AAV6-hNGFβ-EGFP可提高NGF表达,激活大鼠PI3K/Akt通路,提高Bcl-2蛋白表达,抑制Bax蛋白增加,对大鼠脑缺血再灌注损伤起到保护作用。
在脑缺血再灌注动物模型中,提高NGF的表达,可激活PI3K/Akt通路的多个靶点,调控下游相关蛋白表达,发挥对脑缺血再灌注损伤的保护作用。Saito等[14]研究发现脑缺血损伤后,由于PI3K与NGF受到抑制,磷酸化PRAS(pPRAS)的表达出现下调,而加入NGF可以提高小鼠中pPRAS的表达,从而增强神经保护作用。远端缺血后处理可以通过上调内皮型一氧化氮合酶(eNOS),激活PI3K/Akt途径而产生神经保护作用,减轻全脑缺血再灌注损伤[15]。此外,NGF还可通过激活PI3K/Akt途径,减少内质网应激导致的心肌细胞凋亡,对心肌缺血再灌注损伤进行保护[16]。另一方面,NGF还可通过多种途径保护神经元损伤,如抵消兴奋性氨基酸毒性、调节神经元胞质内Ca2+水平和促进自由基的清除等。Rami等[17]研究发现,β2肾上腺素受体激动剂克伦特罗具有神经保护作用,其保护机制与上调NGF表达有关,NGF上调可增强钙蛋白酶抑制蛋白的表达而产生神经保护效应。
Zhang等[18]研究发现,在脑卒中早期阻断TRPV2表达后,可以通过MAPK/JNK途径诱导NGF分泌,促进星形胶质细胞的增殖而产生神经保护作用。NGF的神经元保护作用还与转录因子AP-1的激活有关,Shashoua等[19]设计了一种NGF的模拟短肽,可以通过激活转录因子AP-1来进行脑卒中的治疗。
综上所述,本研究基于脑缺血再灌注大鼠模型,通过神经行为学、梗死体积、免疫组化和分子生物学等方法,发现转染AAV6-hNGFβ可增强大鼠脑组织NGF表达,进而激活PI3K/Akt通路,提高Bcl-2蛋白表达,降低Bax蛋白合成,抑制凋亡,对大鼠脑缺血再灌注损伤起到保护作用,为脑卒中的临床治疗提供依据。

