白细胞介素-10基因修饰的兔脂肪来源间充质干细胞的构建及其对自体外周血Th17细胞的免疫调控△
赵璐 粘红 韦燕凯 金成成 李娜 陈思思 魏瑞华
干燥综合征(Sjögren’s syndrome,SS)是一种慢性自身免疫性干眼类型,主要侵犯唾液腺和泪腺,表现为口眼干燥[1]。SS发病机制尚未完全明确,目前仍缺乏有效的治疗方法,有研究表明,Th17细胞作为致炎细胞群在SS发病过程中起到了重要作用[2]。间充质干细胞(mesenchymal stem cells,MSCs)是来源于中胚层的多能干细胞,具有低免疫原性及免疫抑制特性。研究表明,MSCs可通过抑制Th17细胞的活化与增殖发挥免疫调节作用[3-6]。同时有研究表明,白细胞介素10(interleukin 10,IL-10)、吲哚胺2,3-双加氧酶(indoleamine 2,3-dioxygenase,IDO) 等基因可增强MSCs的治疗效能[7-8]。因此,本研究旨在构建IL-10 基因修饰的兔脂肪来源间充质干细胞(interleukin-10 gene-modified adipose mesenchymal stem cells,IL-10-ADSCs),探究其对兔外周血Th17细胞的免疫调控作用。
1 材料与方法
1.1 材料
1.1.1 实验动物SPF级雌性新西兰大白兔,体质量为2.5~3.0 kg(北京维通利华实验动物技术有限公司提供),实验前排除眼部炎症及其他异常,实验动物的使用及喂养遵循国家科学技术委员会颁布的《实验动物管理条例》。
1.1.2 主要试剂与仪器慢病毒包装细胞人胚肾293T细胞株(美国ATCC细胞库);ADSCs细胞(天津医科大学眼科医院眼科研究所);pHBLV-CMVIE-ZsGreen-Puro载体质粒及辅助包装质粒pSPAX2和pMD2.G(上海汉恒生物有限公司);大肠杆菌菌株DH5α、RNA提取试剂Trizol(美国Invitrogen公司);无内毒素质粒抽提试剂盒(北京康为世纪有限公司);胎牛血清(fetal bovine serum,FBS)、胰蛋白酶、DMEM培养基、DMEM/F-12培养基、聚乙二醇8000、I型胶原酶(美国Gibco公司);2×浓缩定量即时聚合酶链反应(quantitative real time polymerase chain reaction,Q-PCR)扩增混合液、逆转录试剂盒、限制性内切酶、T4连接酶(美国Thermo公司);小鼠抗兔DYKDDDDK Tag一抗、HRP标记马抗小鼠IgG二抗(美国Cell Signaling Technology公司);淋巴细胞分离液(美国GE公司);7900HTFAST Q-PCR仪(爱普拜斯应用生物系统贸易上海有限公司)。
1.2 IL-10重组慢病毒载体的构建及鉴定
1.2.1 IL-10基因片段的制备从GeneBank数据库中获得兔IL-10的mRNA序列,设计引物序列如下:上游引物:5’-ATATGAATTCGCCACCATGCTCAGCTCAGCTCT-3’;下游引物:5’-ATATGGATCCGCTTTTTATCTTCATTGTCATGTA-3’(引物说明:下划线为交换配对碱基,酶切位点)。聚合酶链反应(polymerase chain reaction,PCR)的反应体系为模板DNA 0.5 μL,上、下游引物各1.0 μL,10× PCR 缓冲液5.0 μL,脱氧核糖核苷三磷酸 5.0 μL,高保真PCR酶1.0 μL,硫酸镁2.0 μL,加超纯水至50.0 μL。PCR 反应条件为:95 ℃预变性5 min,94 ℃变性20 s,55 ℃退火20 s,72 ℃延伸90 s,25个循环。PCR 产物进行10 g·L-1琼脂糖凝胶电泳鉴定后,按照DNA 凝胶回收试剂盒说明书回收DNA 片段。
1.2.2 重组质粒pHBLV-IL-10的构建及鉴定用EcoR I和BamH I分别对IL-10 PCR产物和pHBLV-CMVIE-ZsGreen-Puro载体质粒进行双酶切,酶切完成后进行胶回收,用T4 DNA连接酶连接后,用DH5α感受态细菌转化,涂布含有氨苄抗性的琼脂培养基,37 ℃过夜培养后挑取单克隆菌落,37 ℃、250 r·min-1摇菌14 h后进行菌液PCR 鉴定,阳性克隆菌送铂尚生物技术(上海)有限公司测序。
1.2.3 pHBLV-IL-10慢病毒的包装质粒高纯度无内毒素大量抽提,在转染前1 d将培养至P3代的293T细胞接种于10 cm培养皿中,待细胞汇合度达70%~80%时用于转染,取两支灭菌离心管,分别加入质粒DNA(pSPAX2、pMD2.G、pHBLV-IL-10遵循摩尔比111,共24 μg)或LipoFiterTM(48 μL)与DMEM基础培养基的混合液于室温孵育5 min。将两支离心管中DNA溶液与LipoFiterTM溶液混合均匀,室温孵育20 min后共转染293T细胞。转染6 h后更换为完全培养基。分别收集培养48 h及72 h富含慢病毒颗粒的细胞上清。4 ℃、2000 r·min-1离心15 min去除细胞杂质,0.45 μm滤器过滤上清液后每30 mL加入高压灭菌5×聚乙二醇8000 NaCl母液7.5 mL,4 ℃摇床过夜,第2天7110 r·min-1离心20 min,DMEM/F-12基础培养基重悬沉淀分装于EP管中于-80 ℃储存。
1.2.4 重组慢病毒滴度检测将生长状态良好的293T细胞按每孔10×103个接种于96孔板。第2天取6个无菌EP管分别加入90 μL完全培养基,取10 μL病毒原液加入到第1个EP管中,吹打混匀后吸取10 μL加入到第2个EP管中,连续6次做10倍梯度稀释。将梯度稀释的病毒加入293T细胞孵育过夜,24 h后换液,72 h后荧光显微镜观察荧光表达情况。对荧光比例10%~30%的孔进行细胞计数并计算滴度。滴度计算:滴度(TU·mL-1)=细胞数×荧光百分比×103/病毒原液体积(μL)。
1.3 IL-10-ADSCs的构建与鉴定
1.3.1 重组慢病毒稳定转染ADSCsADSCs分离提纯及鉴定方法同前期文献[9],将生长状态良好的ADSCs细胞接种于24孔板,第2天细胞汇合度达50%~70%时进行慢病毒感染,24 h后换液,48 h后荧光显微镜下观察绿色荧光蛋白(green fluorescent protein,GFP)表达效率。
1.3.2 Q-PCR检测IL-10基因的表达提取感染慢病毒后ADSCs细胞总RNA,逆转录试剂盒逆转录为cDNA,Q-PCR检测细胞内IL-10 mRNA表达水平。384孔板中分别加入1 μL上游引物,1 μL下游引物(引物序列:上游引物:5’-CAACAGAGAGCAGGACGTGAGACT-3’,下游引物:5’-GCATCTTGGCTTTGGTACTGAGCT),4 μL 2×浓缩Q-PCR扩增混合液以及2 μL cDNA,封板膜封闭后涡旋离心,离心结束后,将384孔板放入Applied Biosystems 7900HT Fast Real-time PCR仪中,设置参数,反应条件:95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火 1 min,72 ℃延伸15 s,共40个循环。
1.3.3 Western blot检测IL-10蛋白的表达消化离心收集细胞,加入细胞裂解液提取细胞总蛋白。100 μg等量蛋白上样,经SDS-PAGE电泳、转膜、50 g·L-1脱脂牛奶室温封闭1 h。分别加小鼠抗兔DYKDDDDK Tag一抗(1500)及小鼠抗兔β-actin二抗(12000)4 ℃孵育过夜。TBST缓冲液洗膜3次,每次10 min;HRP标记马抗小鼠IgG二抗(12000)室温孵育1 h,TBST缓冲液洗膜3次,每次10 min;DAB显色检测蛋白表达(pHBLV-CMVIE-ZsGreen-Puro载体自带3×FLAG标签)。
1.3.4 逆转录聚合酶链反应检测感染慢病毒后ADSCs干细胞特性提取感染慢病毒后ADSCs细胞总RNA,逆转录试剂盒逆转录为cDNA。在冰浴中按次序分别将1.0 μL cDNA,2.0 μL上下游引物,12.5 μL 2×Taq逆转录聚合酶链反应(transcription-polymerase chain reaction,RT-PCR)预混试剂以及7.5 μL双蒸水加入至200.0 μL EP管中,将上述混合液离心后置于RT-PCR仪上,执行扩增。反应条件:94 ℃预变性3 min后进入循环阶段:94 ℃ 30 s,56 ℃ 30 s,72 ℃ 60 s,循环30~35次,最后 72 ℃ 保温5 min。反应结束后加样行琼脂糖凝胶电泳。加样:RT-PCR marker:1 μL marker+1 μL上样缓冲液+4 μL TAE电泳缓冲液,RT-PCR样品:5 μL样品DNA+1 μL上样缓冲液,混匀后依次加入琼脂糖凝胶孔中,100 V、50 mA电泳40 min,凝胶成像仪成像分析ADSCs中GAPDH、CD29、CD34、CD44、CD45、CD73、CD90基因的表达。RT-PCR引物序列:GAPDH:上游引物:5’-AACATCATCCCTGCCTCTA-CTG-3’,下游引物:5’-CTCCGACGCCTGCTTCAC-3’;CD29:上游引物:5’-CAAGAAGGAATGCCTACGTC-3’,下游引物:5’-CAATGCCACCAAGTTTCCCAT-3’;CD34:上游引物:5’-AGAACTTTCCAGCATGTTCCAGTTTATG-3’,下游引物:5’-GGCTTGCCACATCTTGCTCGGTGA-3’;CD44:上游引物:5’-CACCACGGATTTCTGACCAC-3’,下游引物:5’-TCCAAGC-CTCCATGTAATGT-3’;CD45:上游引物:5’-TTACCTGGACACCTCCTCAA-3’,下游引物:5’-TTCATCATCCCTTTCAACAA-3’;CD73:上游引物:5’-CCACTTCTCAAAGAGGCTAA-3’,下游引物:5’-GAAGAATAGGATTTCCGTGT-3’;CD90:上游引物:5’-CATTTCCCTGTGACTGGTTG-3’,下游引物:5’-CTGGCTTCCCTTGTCATAAA-3’。
1.4 IL-10-ADSCs对兔外周血Th17细胞分化相关基因mRNA表达的影响
1.4.1 建立泪腺上皮细胞与自体外周血淋巴细胞共培养体系分离兔泪腺上皮细胞及外周血淋巴细胞(peripheral blood mononuclear cells,PBMCs),方法同前期文献[9]。将兔泪腺上皮细胞于培养箱中培养2 d后进行γ射线照射(照射剂量为2500 RAD),使其丧失增殖能力但保留其抗原性(表达MHCⅡ分子)。将其与PBMCs以11的比例混合培养3 d后,按PBMCsADSCs为51的比例加入等量的ADSCs、IL-10-ADSCs和GFP-ADSCs(前期研究表明ADSCs可抑制外周血T淋巴细胞的增殖,ADSCs与T淋巴细胞混合培养比例为51时抑制效果最好[9]),同时以等量的成人真皮成纤维细胞-α作为实验对照,共培养2 d后,收集混合培养体系中细胞。
1.4.2 IL-10-ADSCs对兔外周血Th17细胞分化相关基因mRNA表达的影响将1.4.1中收集的混合培养的细胞加入适量Trizol进行总RNA的提取,逆转录制备cDNA,Q-PCR检测Th17细胞分化相关基因IL-17、维甲酸相关孤独受体C(retinoicacid orphan receptor C,RORC) mRNA表达水平,引物序列:GAPDH:上游引物:5’-GGGTGGTGGACCTCATGGT-3’,下游引物:5’-CGGTGGTTTGAGGGCTCTTA-3’;IL-17:上游引物:5’-GGAATGAGGACCACCACATGA-3’,下游引物:5’-CTGCGTAGGACCAGGATCTCTT-3’;RORC:上游引物:5’-GGCCTACCACGCCGA-3’,下游引物:5’-TCCATGCCACCGTATTTGC-3’。相对定量结果分析采用2-ΔΔCt法。
1.5 统计学方法采用SPSS 20.0统计学软件对数据进行分析,数据用均数±标准差表示,两组样本均数比较采用t检验,两组以上样本比较采用单因素方差分析(ANOVA)。检验水准:α=0.05。
2 结果
2.1 IL-10重组慢病毒载体的构建与鉴定
2.1.1 重组质粒pHBLV-IL-10的构建及鉴定兔IL-10目的基因经PCR扩增后产物经琼脂糖凝胶电泳分析,基因片段大小为534 bp,大小与预期结果相符,见图1A。挑取细菌培养皿单克隆菌落,过夜摇菌后进行菌液PCR鉴定,阳性转化子PCR产物大小约为900 bp(PCR扩增用的是载体上的一段通用引物,故应该比534 bp大300 bp左右),见图1B。将阳性克隆菌液送铂尚生物技术(上海)有限公司进行测序分析,测序结果显示基因序列正确,重组慢病毒载体构建成功,见图2。

图1 IL-10重组慢病毒载体的构建及鉴定。A:PCR扩增IL-10基因片段;B:IL-10过表达重组质粒菌液PCR鉴定。1-8代表的是挑取的8个单克隆菌落

图2 pHBLV-IL-10载体测序结果。阳性克隆菌基因测序结果表明重组慢病毒载体构建成功
2.1.2 慢病毒包装与滴度检测将pSPAX2、pMD2.G、pHBLV-IL-10共转染293T细胞进行慢病毒的包装,分别于转染后48 h及72 h荧光显微镜下观察GFP的表达情况,见图3。收集48 h及72 h病毒上清经5×聚乙二醇8000浓缩后获得的病毒颗粒进行滴度的测定,见图4。对荧光比例合适(10%)的孔进行细胞计数并计算滴度。滴度计算结果为1.2×109TU·mL-1。滴度满足后续实验需求。
2.2 IL-10-ADSCs的构建与鉴定用浓缩后的慢病毒颗粒感染ADSCs,48 h荧光显微镜下观察GFP表达效率约为80%以上,见图5A。应用Q-PCR对IL-10-ADSCs组及GFP-ADSCs组细胞中IL-10 mRNA表达水平进行检测,结果表明,与GFP-ADSCs组相比,IL-10-ADSCs组IL-10 mRNA的相对表达量显著升高,差异有统计学意义(P<0.001),见图5B。Western blot检测IL-10蛋白水平相对表达量,结果表明,目标蛋白相对分子质量大小约为22 000,与预期结果一致。与GFP-ADSCs组相比,IL-10-ADSCs组在蛋白水平过表达IL-10,见图5C。利用RT-PCR检测IL-10-ADSCs相关的细胞表面标志分子基因水平的表达,结果显示IL-10-ADSCs高表达CD29、CD44、CD73、CD90等MSCs标志物,不表达CD34、CD45等造血细胞标志物,说明IL-10-ADSCs仍然具有干细胞特性,见图5D。
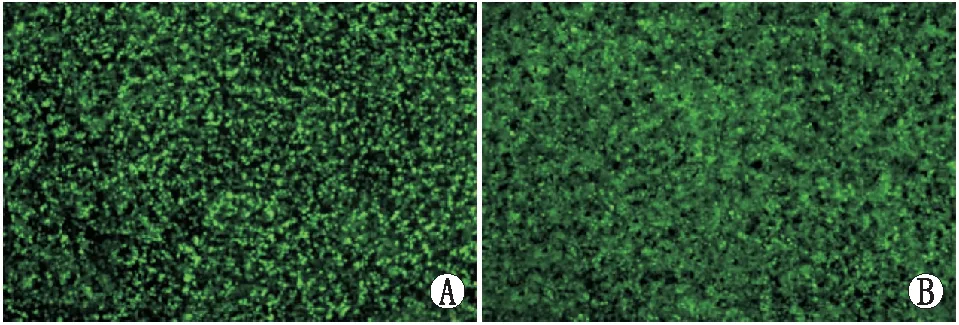
图3 IL-10重组慢病毒包装48 h(A)及72 h(B)GFP表达情况(×4)。荧光显微镜下观察慢病毒包装48 h及72 h GFP表达率可达90%以上
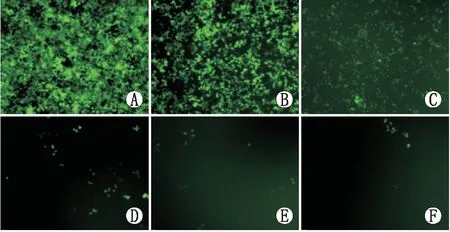
图4 梯度稀释病毒计算病毒滴度(×20)。对浓缩后的病毒连续6次行10倍梯度稀释后感染293T细胞进行滴度计算,每孔所加病毒量分别为A(10 μL)、B(10-1 μL)、C(10-2 μL)、D(10-3 μL)、E(10-4 μL)、F(10-5 μL),图为感染72 h后荧光显微镜下GFP表达情况,选取第3孔细胞(感染率约10%)消化计数进行滴度的计算(图4C)

图5 IL-10-ADSCs的构建与鉴定。A:慢病毒感染ADSCs 48 h GFP表达情况(×4);B:Q-PCR检测IL-10 mRNA表达水平;C:Western blot检测IL-10蛋白表达水平(载体自带3×FLAG标签,故目标蛋白采用小鼠抗兔DYKDDDDK Tag一抗);D:RT-PCR鉴定IL-10-ADSCs干细胞特性
2.3 IL-10-ADSCs抑制兔外周血Th17细胞分化相关基因mRNA表达Q-PCR检测混合培养体系细胞中Th17细胞分化相关基因IL-17、RORC mRNA表达水平。与对照组IL-17、RORC mRNA的表达量(IL-17:1.000±0.016;RORC:1.000±0.021)相比,IL-10-ADSCs组(IL-17:0.203±0.160;RORC:0.371±0.190)、ADSCs组(IL-17:0.508±0.296;RORC:0.632±0.061)及GFP-ADSCs组(IL-17:0.539±0.202;RORC:0.549±0.008)均显著降低,差异均具有统计学意义(均为P<0.05)。同时IL-10-ADSCs组对IL-17、RORC mRNA抑制效果大于ADSCs组和GFP-ADSCs组,差异均具有统计学意义(均为P<0.05),ADSCs组与GFP-ADSCs组差异均无统计学意义(均为P>0.05)。结果表明,MSCs可抑制反应体系中T细胞向Th17细胞方向分化,且IL-10-ADSCs组抑制效果较基因修饰前更加显著(图6)。

图6 IL-10-ADSCs抑制兔外周血Th17细胞分化相关基因mRNA表达。IL-10-ADSCs组与对照组比较,*P<0.05,***P<0.001;IL-10-ADSCs组与ADSCs组比较,$P<0.05,$$P<0.01;ADSCs组与GFP-ADSCs组比较,nsP>0.05
3 讨论
近年来干细胞疗法为SS等自身免疫性疾病的治疗带来了希望,研究表明MSCs对自身免疫性疾病的治疗效果很大程度上依赖于其免疫调节因子的分泌。因此,用特定的免疫调节因子对MSCs进行基因修饰可能会最大限度地发挥其治疗作用[4,10]。本研究预通过构建IL-10-ADSCs,探究其是否能增强ADSCs对Th17细胞的免疫调控作用。
众所周知,IL-10是一种多细胞源、多功能的细胞因子,调节细胞的生长与分化,参与炎症反应和免疫反应,是目前公认的炎症与免疫抑制因子[11]。Trittibach等[12]研究表明,IL-10可以有效减少葡萄膜炎模型小鼠前房及后房炎症细胞的产生。我们的前期研究通过腺病毒介导IL-10转基因的方式治疗自身免疫性干眼也取得了一定的治疗效果[13]。但无论是体外重组还是腺病毒介导都无法有效维持IL-10有效的治疗浓度,长期反复注射还易产生抗IL-10抗体。应用重组慢病毒载体对MSCs进行基因修饰很好地解决了上述问题,本研究中我们成功构建了稳定表达IL-10基因的IL-10-ADSCs,且在基因修饰后并未影响其干细胞特性。
研究表明,Th17细胞是参与自身免疫性干眼的主要细胞群[14-15]。IL-17作为Th17细胞的主要效应分子,已被证明与类风湿性关节炎、系统性红斑狼疮等多种自身免疫性疾病发生发展密切相关[16]。IL-17作为细胞诱导炎症反应的早期启动子,可刺激IL-6、IL-8、肿瘤坏死因子-α等细胞因子的生成,从而引起一系列的病理改变[17]。研究表明,SS患者血清中IL-17表达水平随病情的严重程度升高,在SS小鼠模型中也同样发现唾液腺及血清中IL-17表达水平升高[18-19]。Lin等[20]研究发现,IL-17基因敲除的小鼠无法诱导形成SS,而在过继转移Th17细胞后则出现显著的唾液分泌量下降、自身抗体产生增加等SS临床症状。RORC是Th17细胞分化过程中关键性的转录因子,在Th17分化及介导自身免疫性疾病中发挥重要作用。研究表明RORC缺失会阻止CD4+T细胞向Th17细胞分化,而过表达RORC的CD4+T细胞在不需要外来细胞因子的情况下即可产生IL-17;同时有研究表明RORC基因敲除的小鼠,自身免疫性疾病发生率下降,Th17 细胞数量也相应减少[21-22]。在前期的研究中,我们也发现Th17细胞参与了自身免疫性干眼模型中炎症反应的发生[9,23]。
基因修饰MSCs调控Th17细胞免疫反应已得到广泛的研究,Mohammadzadeh等[24]研究发现,在自身免疫性脑脊髓炎治疗过程中,与ADSCs相比,β干扰素基因修饰的ADSCs可更大程度降低IL-17的分泌。Wang等[25]探究IL-35基因修饰的MSCs在诱导心脏移植免疫耐受中的作用,结果表明IL-35基因修饰的干细胞在抑制Th17免疫反应及减少移植物排斥反应方面显示出更大的优势。与上述研究结果一致,本研究为探究IL-10-ADSCs对Th17细胞的免疫调控作用,我们观察了ADSCs、IL-10-ADSCs及GFP-ADSCs对体外激活T淋巴细胞相关炎性因子的影响,结果表明,与对照组相比,三组均可降低兔外周血Th17细胞相关细胞因子IL-17 mRNA及其转录因子RORC mRNA表达水平(均为P<0.05),值得注意的是,IL-10-ADSCs对Th17细胞的抑制效果较ADSCs进一步增强(P<0.05)。
综上所述,ADSCs在IL-10基因修饰后对Th17细胞免疫调控作用增强,这提示其对自身免疫性干眼可能具有更佳的治疗效果,为我们后期探索自身免疫性干眼发病机制以及优化治疗方案做了前期实验准备。但IL-10-ADSCs究竟通过何种途径对Th17细胞产生免疫调控,其他细胞因子是否也参与其中仍有待进一步研究。

