玉米转录因子ZmBES1/BZR1-7基因克隆及功能分析
冯文奇 孙福艾 丁 磊 郭 新 李晚忱 付凤玲 于好强
(四川农业大学玉米研究所,四川温江 611130)
油菜素内脂(brassinosteroid,BR)是植物特有的甾体激素,在植物生长发育及逆境应答中发挥重要作用。BR生物合成或信号转导相关基因突变会导致植株出现矮化、开花延迟、衰老等一系列缺陷表型[1-2]。研究表明,外源施用BR能提高作物的抗逆能力[3-4],增加作物产量[5-6]。高温条件下,BR处理可保护小麦(Triticum aestivum)叶片中蛋白正常合成[7];盐胁迫下,BR处理可降低植物叶片细胞核和叶绿体的损害,削弱盐胁迫对种子萌发的抑制作用[8]。此外,BR处理可增强水稻(Oryza sativa)和烟草(Nicotiana tabacum)对稻瘟病和白叶枯病的抗性[5],且BR能够促进光合作用,增加植株叶面积和可溶性蛋白的含量,增加产量[9];弱光条件下,外源BR可显著提高光化学效率、抗氧化酶活性,缓解弱光对幼苗的伤害[10]。
BR被其受体BRASSINOSTEROID INSEN-SITIVE 1(BRI1)、BRI1-ASSOCIATED RECEPTOR KINASE1(BAK1)等激酶接受后,经过信号级联传递,可调节BRI1 EMS SUPPRESSOR 1(BES1)及其同源蛋白BRASSINAZOLE RESISTANT 1(BZR1)的活性[11]。研究证实,BES1/BZR1是BR信号转导途径的唯一转录因子[12],二者相似性达88%,N端结构域相似性高达97%,均含有bHLH结构[13]。BES1/BZR1接受BR信号后,特异性结合到其靶基因启动子区的 E-box(CANNTG)或BRRE元件(CGTGT/CG),调控靶基因的表达,进而调控生长发育[14-15]。
模式植物拟南芥(Arabidopsis thaliana)和水稻中,BES1/BZR1作用机制及其在BR信号通路较为明确。Li等[16]研究发现,BES1/BZR1活性受可逆磷酸化调控,去磷酸化的BES1/BZR1进入细胞核调控靶基因表达,而磷酸化的BES1/BZR1进入细胞质发生降解。除介导BR信号,BES1/BZR1还参与脱落酸(abscisic acid,ABA)、赤霉素(gibberellin,GA)、光信号等信号转导途径。BES1抑制ABA响应因子ABI3编码基因表达,ABI3直接作用于ABI5转录因子,抑制ABA信号转导[17-18]。BES1/BZR1直接结合到GA合成关键基因GA20ox-2、GA3ox-2、GA2ox-3启动子区的 E-box或BRRE元件,调控其表达,进而调节 GA合成[19]。BES1/BZR1直接与GATA2互作并抑制其转录,促进下胚轴伸长,影响光形态建成[20-21]。此外,BES1/BZR1抑制RD26基因表达,而RD26蛋白又与BES1/BZR1蛋白结合,抑制其在干旱胁迫下的调节功能[22]。然而,在玉米(Zea mays)中,除个别BR合成基因及受体编码基因功能被鉴定外[23-25],鲜有ZmBES1/BZR1基因的研究报道。
在前期研究中,Yu等[26]鉴定到玉米基因组中有11个ZmBES1/BZR1转录因子,依次命名为ZmBES1/BZR1-1~ZmBES1/BZR1-11,其中ZmBES1/BZR1-7定位于叶绿体。本研究从B73克隆到ZmBES1/BZR1-7基因,并对其序列、表达模式、转录激活活性及靶基因进行分析,初步探究其功能,以期为后续深入研究ZmBES1/BZR1-7的功能提供参考依据。
1 材料与方法
1.1 材料及前处理
试验材料为玉米自交系B73,由四川农业大学玉米研究所提供。B73种子通过Hoogland营养液培养至三叶一心期后,分为3组:试验组1,选取10株幼苗用于DNA提取;试验组2和试验组3选择长势一致的幼苗各60株,分别用16%PEG-6000和100 mmol·L-1NaCl处理,在处理 0、3、6、9、12、24 h 时,分别取叶片和根系,研磨后液氮速冻并于-70℃保存,备用。
1.2 DNA、RNA提取及ZmBES1/BZR1-7基因扩增
采用CTAB法提取总DNA,用RNA提取试剂盒(Takara公司,大连)提取各样品总RNA,并反转录成cDNA。用Primer5设计扩增ZmBES1/BZR1-7全长引物 B7-F1:5′-ATGACGTCGGGAGCGGCGGCG-3′;B7-R1:5′-TCACTTGGCGCCGACGCCGAG-3′和扩增开放阅读框(open reading frame,ORF)引物 B7-F2:5′-CCACCCACC ACCCCTCCATCAA-3′;B7-R2:5′-GGTCTCACAGCAAT CGTCTCCTACTCCC-3′。用总 DNA作模板,扩增ZmBES1/BZR1-7全长,以 cDNA为模板扩增 ORF。PCR 扩增体系:2×PrimeSTAR Buffer(Mg2+)12.5 μL,dNTPmix 2.0 μL,上游引物 0.5 μL,下游引物 0.5 μL,DNA 0.5 μL,PrimeSTAR 0.25 μL,ddH2O 8.72 μL。扩增程序:94℃预变性3 min;98℃变性10 s;66℃退火10 s;72℃ 延伸 50 s;35 个循环;72℃ 再延伸 5 min;12℃保存。扩增产物用2%琼脂糖凝胶电泳分离,150Ⅴ·cm-1电泳30 min。将目的条带切割并用胶回收纯化试剂盒进行回收,并连接至亚克隆载体pMD19-T,转化大肠杆菌,PCR鉴定后送至生工生物工程(上海)股份有限公司完成测序。
1.3 ZmBES1/BZR1-7结构域及同源性分析
用DNAMAN比对克隆到的CDS和gDNA序列分析内含子和外显子结构。利用软件MEGA6比对ZmBES1/BZR1-7与拟南芥和水稻中BES1/BZR1氨基酸序列,并构建进化树分析同源性。
1.4 胁迫处理下ZmBES1/BZR1-7的表达模式分析
采用Primer5设计ZmBES1/BZR1-7表达检测引物,序列为 qB7-F:5′-GAAGAGCACCCGGACACCAT-3′;qB7-R:5′-GCCCCGATCTGGAAGCTGAT-3′,扩增片段长98 bp。以玉米ZmGAPDH作为内参,其扩增引物序列为 qG-F:5′-CCATCACTGCCACACAGAAAAC-3′;qG-R:5′-AGGAACACGGAAGGACATACCAG-3′,扩增片段长170 bp。采用 SYBR green法在 CFX96TMReal-Time System(Bio-Rad公司,美国)进行RT-qPCR。扩增体系为 10 μL:SYBR Premix Ex TaqⅡ(TakaRa 公司,大连)5 μL,上、下游引物各 0.4 μL,模板 1 μL,ddH2O 3.2 μL。 反应程序:95℃预变性 15 min;95℃变性 5 s;61.1℃退火 30 s,39个循环。采用 2-△△CT法分析ZmBES1/BZR1-7相对表达量。
1.5 ZmBES1/BZR1-7激活活性鉴定
采用Primer5设计ZmBES1/BZR1-7的ORF扩增引物,在上下游引物分别引入pGBKT7多克隆位点侧翼序列为B7-F:5′-TCAGAGGAGGACCTGCATATGATG ACGTCGGGAGCGGCG-3′;B7-R:5′-TCGACGGATCCC CGGGAATTCTCACTTGGCGCCGACGCC-3′,参照1.2 方法及体系进行扩增并纯化回收。用EcoRI和NdeⅠ限制性内切酶切割pGBKT7载体,使其线性化并纯化回收。采用同源重组酶Soso Mix Kit构建ZmBES1/BZR1-7的酵母表达载体pGBKT7-ZmBES1/BZR1-7。将pGBKT7-ZmBES1/BZR1-7和pGADT7共转化酵母AH109菌株作为试验组,pGBKT7-53和pGADT7-T同时转化酵母作为阳性对照,pGBKT7-lam和pGADT7-T同时转化酵母作为阴性对照,空载体 pGBKT7和pGADT7共同转化酵母作为阴性对照。转化后的酵母涂布在二缺SD/-Leu/-Trp和三缺SD/-Trp/-Leu/-His培养基上,28℃倒置培养3 d,观察菌落生长状况,分析ZmBES1/BZR1-7激活活性。
1.6 共相关分析
转录激活因子结合其靶基因的启动子后,调控靶基因表达,共相关分析可初步筛选转录因子的靶基因。从MaizeGDB数据库(https://www.maizegdb.org)下载B73的转录组数据,利用R语言编写程序,将ZmBES1/BZR1-7与玉米其他基因的FPKM值进行Spearman和Pearson相关性分析,选择相关系数大于0.6或者小于-0.6的基因作为ZmBES1/BZR7的候选靶基因。随后在MaizeGDB数据库下载候选基因起始密码子(ATG)上游2 000 bp序列,分析这些启动子区域是否包含ZmBES1/BZR1结合基序(E-box或BRRE元件)。利用在线软件AGRiGO(http://bioinfo.cau.edu.cn/agriGO/index.php)查找候选基因GO号,利用在线基因GO功能富集数据库WEGO(http://wego.ges.orgnomic.cn/)进行基因功能注释分类。
2 结果与分析
2.1 玉米ZmBES1/BZR1-7基因的克隆和序列分析
以cDNA和总DNA为模板对ZmBES1/BZR7进行PCR扩增,扩增产物大小一致,介于750~1 000 bp之间,测序证实其gDNA序列无内含子,ORF长度为975 bp(图1),GenBank登录号:ASX95006[23]。
2.2 玉米ZmBES1/BZR1-7蛋白的同源性及进化分析
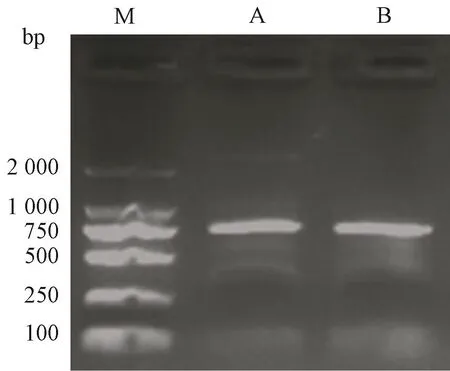
图1 ZmBES1/BZR1-7基因的扩增Fig.1 The amplification of ZmBES1/BZR7 gene
比对拟南芥、水稻BES1/BZR1与ZmBES1/BZR1-7氨基酸序列,发现玉米ZmBES1/BZR1-7蛋白的N端高度保守且具有BES/BZR1典型的bHLH结构(图2),此结构是 BES1/BZR1结合靶基因的关键部分[27-28]。进化树分析表明,ZmBES1/BZR1-7与水稻BES1/BZR1家族具有较高的同源性,与拟南芥BES1/BZR1同源性较低,其中与水稻OsBZR1-1的同源性高达 75.95%(图 3)。

图2 ZmBES1/BZR1-7蛋白多序列比对Fig.2 Multiple alignment of ZmBES1/BZR1-7 protein
2.3 渗透、盐胁迫条件下ZmBES1/BZR1-7的表达分析
16%PEG-6000胁迫处理12 h时,玉米叶片中ZmBES1/BZR1-7表达极显著上调,是对照(CK)的17.8倍;而玉米根中ZmBES1/BZR1-7表达在16%PEG-6000胁迫处理3 h时极显著下调,在胁迫处理24 h 时极显著上调(图 4-A、B)。 100 mmol·L-1NaCl胁迫处理12 h时,玉米叶片中ZmBES1/BZR1-7表达极显著上调,是CK的19.8倍;根中ZmBES1/BZR1-7表达在100 mmol·L-1NaCl胁迫处理1 h时极显著上调,随后降低,但在胁迫处理 9、12 h时,ZmBES1/BZR1-7表达又显著上调(图4-C、D)。上述结果表明,玉米ZmBZR1/BES1-7基因的表达受渗透和盐胁迫诱导,其可能参与干旱与盐胁迫应答过程。

图3 ZmBES1/BZR1-7的系统进化树Fig.3 The phylogenetic tree of ZmBES1/BZR1-7
2.4 转录激活活性分析
将pGBKT7-ZmBES1/BZR1-7和pGADT7转化酵母菌株AH109后,涂布于SD/-Leu/-Trp和SD/-Trp/-Leu/-His培养基上28℃培养。结果显示,在二缺培养基上,阳性组(pGBKT7-53+pGADT7-T)、阴性组(pGBKT7-lam+pGADT7-T、pGBKT7+pGADT7)及试验组菌落均可以正常生长,说明质粒转化成功。在三缺培养基上,阳性组和试验组菌落生长且变为蓝色,说明ZmBES1/BZR1-7具有转录激活活性(图5)。
2.5 共相关分析ZmBES1/BZR1-7的候选靶基因
共相关分析表明,玉米中有72个基因的表达与ZmBES1/BZR1-7表达相关性较高,相关系数大于0.6。其中,有35个候选基因被注释,主要涉及细胞、细胞组成成分、细胞过程及细胞生理代谢等过程(图6)。启动子序列分析发现,这35个基因的启动子区域均大量ZmBES1/BZR1-7结合基序E-box或BRRE元件,最少有2个,最多达17个。推测这些基因可能是ZmBES1/BZR1-7调控的靶基因。
3 讨论
本研究发现,ZmBES1/BZR1-7基因在玉米叶中受渗透和盐胁迫诱导表达,其可能调控的靶基因中包括很多与叶绿体发育、光合作用等参与光信号途径的基因,如叶绿素合成酶基因(GRMZM2G177432)、PPR(pentatricopeptiderepeat)家族蛋白编码基因(GRMZM2G336888)、光信号响应因子基因GATA15(GRMZM2G701448)等,推测 ZmBES1/BZR1-7蛋白可能主要在玉米叶中发挥作用,且参与应答渗透和盐胁迫过程。已有研究发现,油菜(Brassica campestris)中,大多数BcBES1/BZR1基因被干旱和盐胁迫诱导显著上调表达,个别成员受干旱和盐胁迫抑制[29]。桉树(Eucalyptus robusta Smith)中,ErBES1/BZR1基因的表达被盐胁迫显著抑制[30]。Fisk等[31]研究发现,PPR家族成员CRP1蛋白调控叶绿体相关基因pctA和pctD的表达,进而影响叶片发育。Yu等[26]研究表明,ZmBES1/BZR1-7蛋白定位于叶绿体。以上结果进一步表明,ZmBES1/BZR1-7基因可能参与渗透和盐胁迫下叶绿体发育和光信号途径,进而调控玉米应答渗透和盐胁迫。在拟南芥中,BES1/BZR1可促进转录因子CBF(C-repeat binding factor)和 WRKY6,以及 ABA受体PYL6等的编码基因表达,并与WRKY54转录因子直接互作,正调控拟南芥的耐寒性,负调控其耐旱性[32-33]。且BES1/BZR1通过拮抗NAC家族的RD26转录因子,抑制其在干旱应答方面的调节功能[22]。在小麦中,BES1/BZR1可促进谷胱甘肽硫转硫酶编码基因GST1表达,介导超氧阴离子清除和增强抗氧化酶活性,进而增强小麦的耐旱性[34]。此外,BES1/BZR1调节下游靶基因的表达,调控植物对高温、低氮、低磷等胁迫的耐受性[35-37]。综上表明,BES1/BZR1转录因子在调控植物应答逆境过程中发挥重要作用,推测玉米ZmBES1/BZR1-7可能通过调控叶绿体发育相关基因表达或介导光信号途径,进而调控干旱及盐胁迫应答过程。因此,后续研究需进一步证实此假设,并明确ZmBES1/BZR1-7调控渗透和盐胁迫应答机制。
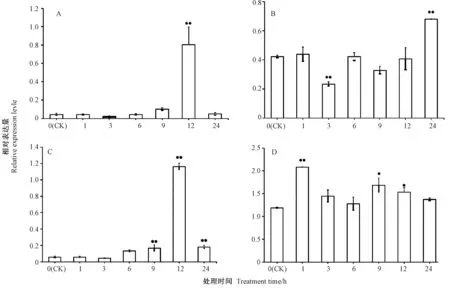
图4 ZmBES1/BZR1-7的表达模式Fig.4 The expression pattern of ZmBES1/BZR1-7

图5 ZmBES1/BZR1-7的转录激活分析Fig.5 Transcription activation ability assay of ZmBES1/BZR1-7

表1 与ZmBES1/BZR1-7表达共相关的候选靶基因Table 1 The candidate target genes of co-correlated with ZmBES1/BZR1-7 expression

表1(续)
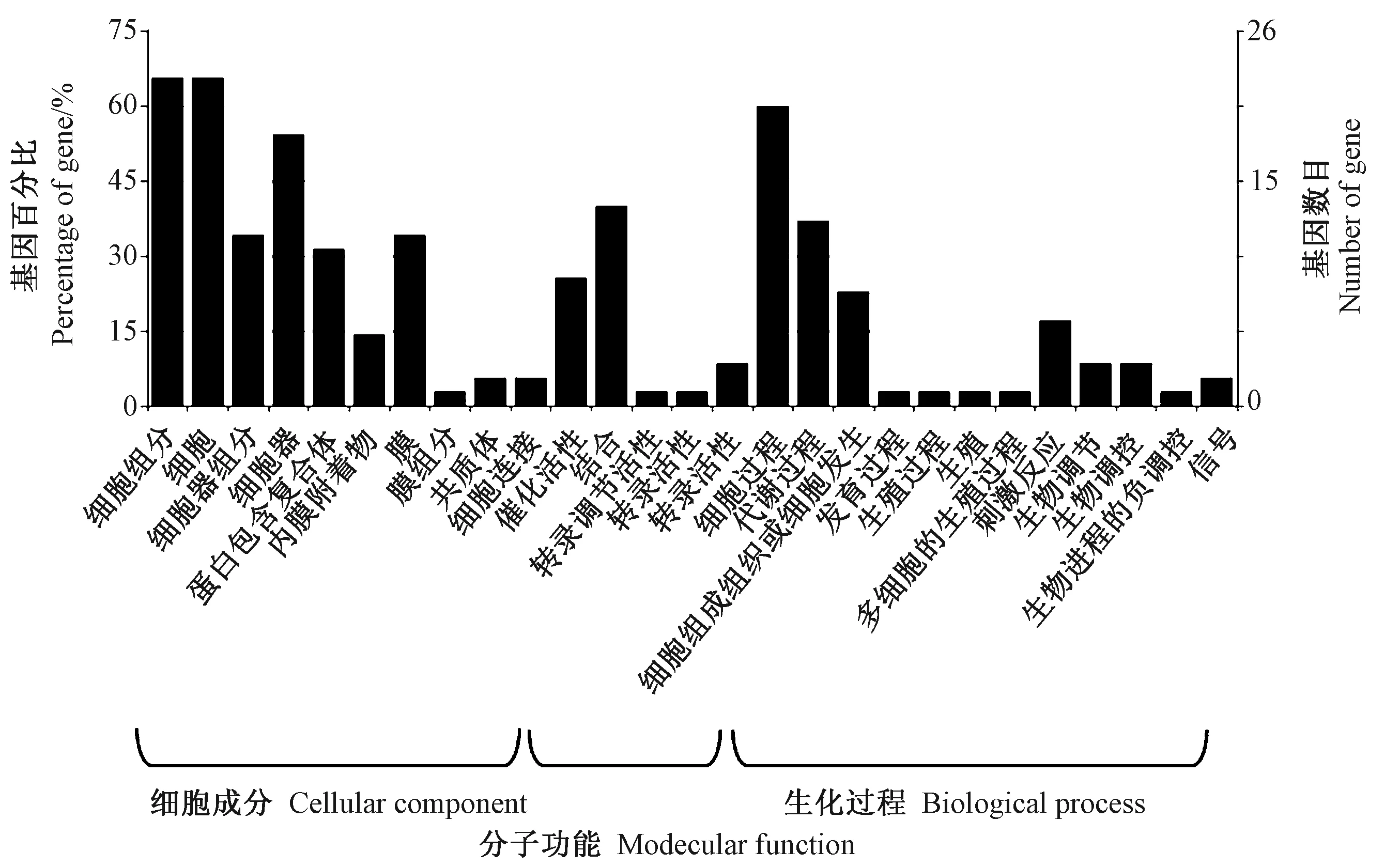
图6 候选靶基因的功能注释分类Fig.6 Functional annotation classification of candidate target genes
4 结论
本研究从玉米自交系B73中克隆到ZmBES1/BZR1-7基因,其表达受渗透(16%PEG-6000)和盐胁迫(100 mmol·L-1NaCl)显著诱导。 ZmBES1/BZR1-7氨基酸序列含有一个BES1/BZR1高度保守的bHLH结构域,与水稻OsBZR1-1具有较高的亲缘关系。进一步分析发现,ZmBES1/BZR1-7是转录激活因子,且分析筛选到72个ZmBES1/BZR1-7可能调控的候选靶基因。综上所述,ZmBES1/BZR1-7参与渗透和盐胁迫应答,与叶绿体发育及光信号途径相关。本研究结果为深入解析ZmBES1/BZR1-7的功能奠定了基础。

