食甲基菌吡咯喹啉醌生物合成相关基因的筛选及表型鉴定
薄明井,寇航,陈静,张惟材,葛欣,熊向华
1.河北大学 生命科学学院,河北 保定 071000;2.军事医学研究院 生物工程研究所,北京 100071
吡咯喹啉醌(pyrroloquinoline quinone,PQQ)是甲基营养菌合成的一种醌类化合物,是NAD和FAD之外的第三类氧化还原酶辅酶[1]。PQQ具有重要的生理功能,如清除氧自由基、增强线粒体功能、调节免疫、促进认知、防治辐射损伤和肝损伤、促进创伤愈合等[2]。PQQ作为促进认知的功能食品成分在美国已上市多年[3],显示其具有良好的药用保健价值和广阔的市场应用前景。
PQQ的化学合成工艺复杂、污染严重、成本高昂,生物合成是目前PQQ工业化制备的首选工艺。迄今发现只有某些革兰阴性菌能产生PQQ,如乙酸钙不动杆菌、肺炎克雷伯菌、扭脱甲基杆菌、氧化葡糖杆菌等[4]。本实验室前期通过山梨糖脱氢酶(sorbose dehydrogenase,SDH)活性电泳法从土壤中筛选得到一株PQQ产生菌MP688[5],已完成全基因组测序和基因组规模代谢网络模建[6-7]。MP688经过多轮物理和化学诱变后得到高产菌株J1-1,摇瓶培养PQQ产量达到100 mg/L左右。继续通过传统物理化学诱变来提高PQQ产量已经很难,J1-1菌株的代谢工程改造是另一种有效手段。代谢工程理性改造建立在PQQ生物合成相关基因的完整注释之上,但目前已知的PQQ生物合成相关基因功能并不能组成完整的PQQ生物合成路线,依然存在未知的PQQ生物合成相关基因等待发现。为筛选到新的PQQ生物合成相关基因,本研究对J1-1菌株进行Tn5转座诱变,筛选得到1株PQQ生物合成水平显著下降的突变株,经插入位点鉴定确认了突变基因,同源重组敲除对应基因后进一步验证表型。
1 材料与方法
1.1 材料
食甲基菌J1-1、大肠杆菌DH5α λ-pir感受态细胞、质粒pCM66和pGX由本实验室保存;大肠杆菌DH5α感受态细胞、快速质粒小提试剂盒、细菌基因组DNA提取试剂盒、琼脂糖凝胶DNA回收纯化试剂盒购自北京天根生化科技有限公司;限制性内切酶购自Thermo公司;T4DNA连接酶、pEASY-Uni Seamless Cloning and Assembly Kit、DNA标准分子量购自北京全式金生物技术有限公司;RNA提取试剂盒Bacteria RNA Extraction Kit、逆转录 HiScriptⅢ1st Strand cDNA Synthesis Kit(+gDNA Wiper)试剂盒购自南京诺唯赞有限公司;PCR引物(表1)合成及测序由北京擎科科技股份有限公司完成;其他生化试剂(分析纯)购自国药集团。

表1 PCR引物序列
低产培养基(LM):MgSO4·7H2O 0.2 g/L,KH2PO41.4 g/L,(NH4)2SO43.0 g/L,Na2HPO43.0 g/L,MnCl2·4H2O 5.0 mg/L,ZnSO4·7H2O 5.0 mg/L,CuSO4·5H2O 0.5 mg/L,柠檬酸铁 60.0 mg/L,甲醇10 mL/L,pH7.0,115℃灭菌30 min。
高产培养基(HM):MgSO4·7H2O 0.2 g/L,KH2PO42.8 g/L,(NH4)2SO43.0 g/L,Na2HPO46.0 g/L,MnCl2·4H2O 5.0 mg/L,ZnSO4·7H2O 5.0 mg/L,CuSO4·5H2O 0.5 mg/L,柠檬酸铁60.0 mg/L,甲醇10 mL/L,pH7.0,115℃灭菌30 min。
1.2 分子生物学操作
PCR、酶切、连接、转化等常规分子生物学操作参照文献方法[8]。
1.3 Tn5突变体库构建
从 EN-Tn5<R6Kγori/KAN-2>TNP Transposome Kit中取 1 μL Transposome加入 100 μL 食甲基菌J1-1感受态细胞混匀,冰浴5 min后转移到预冷的电击杯中,2.5 kV电压电击后迅速加入1 mL LM培养基,30℃、200 r/min复苏培养2 h,涂布于LM平板(含卡那霉素50 μg/mL),倒置培养2~3 d。挑取单菌落于5 mL LM液体培养基(含卡那霉素50 μg/mL)中,30℃、200 r/min培养3 d,连续传3代后仍有卡那霉素抗性,说明转座序列可以稳定传代,以此方法建立突变体库。
1.4 PQQ合成突变株筛选及PQQ合成水平检测
PQQ是棕红色小分子化合物,在食甲基菌J1-1发酵过程中被逐渐分泌到胞外[9],使发酵液呈红色,发酵液颜色深浅可直观反映PQQ合成水平高低。挑取1.3的单菌落于5 mL LM液体培养基(含卡那霉素50 μg/mL)中,以J1-1为对照,30℃、200 r/min振荡培养3 d,挑选与对照菌发酵液颜色差异较大的菌株,采用分光光度法[10]检测发酵液中PQQ合成水平。
1.5 质粒拯救法鉴定插入位点
按照质粒拯救法[11]进行。测序结果与J1-1基因组DNA序列进行比对,确定Tn5插入位点。
1.6 mpq-0708基因敲除
以J1-1基因组为模板,用引物0708-up-F/0708-up-R和0708-down-F/0708-down-R扩增上游及下游同源臂基因;以质粒pGX-Gm为模板,用引物0708-gen-F/0708-gen-R扩增庆大霉素(Gm)基因片段。扩增产物经琼脂糖凝胶电泳后切胶回收。将上、下游同源臂基因、Gm基因和经XhoⅠ、NotⅠ双酶切的载体pGX-Gm用pEASYUni Seamless Cloning and Assembly Kit重组转化,获得pGX-up-Gm-down重组质粒。
质粒构建成功后,以pGX-up-Gm-down质粒为模板,用引物0708-up-F/0708-down-R扩增片段up-Gm-down,纯化后电击转入J1-1感受态细胞,涂布LM平板(含Gm 50 μg/mL),30℃培养3 d,从平板上挑取单菌落,用引物0708-1700-F/0708-gen-R及0708-1700-R/0708-gen-F扩增2500 bp的up-gm及gm-down片段,用引物0708-gen-F/0708-gen-R扩增800 bp的Gm片段,验证是否敲除成功。
1.7 敲除菌株表型测定
挑取野生菌J1-1、敲除菌J1-1Δ0708单菌落于5 mL LM液体培养基中于30℃活化24 h,按1%的接种量分别接种至100 mL LM及HM液体培养基中,30℃同步培养,间隔12 h取样测定菌液D600nm值及PQQ相关指标,绘制生长曲线及PQQ生物合成曲线。
1.8 NADH/NAD+比率测定
采用CheKine NAD/NADH Assay Kit试剂盒测定野生菌J1-1和敲除菌J1-1Δ0708的NADH及NAD+含量,计算 NADH/NAD+比值。
1.9 转录组数据分析
试管活化野生菌J1-1后按1%接种量分别接种至100 mL LM及HM液体培养基中,30℃、200 r/min培养60 h后收集菌体,用试剂盒提取RNA并逆转录为cDNA,送擎科公司进行转录组测序,分析高产低产条件下相关基因的转录水平。
2 结果
2.1 Tn5转座突变体库构建、突变株筛选及表型鉴定
Tn5转座诱变构建的J1-1突变体库库容量为1.0×105,从中筛选到1株与野生菌J1-1发酵液颜色差异显著的突变株5-179,与野生菌J1-1发酵液呈红色相比,该突变株发酵液颜色接近白色(图1)。菌体量及PQQ合成水平定量检测结果表明,突变菌5-179的生长速度、PQQ生物合成速度、最终菌体量及PQQ产量都比野生菌J1-1低。到达平台期后突变菌5-179最终菌体量为野生菌J1-1的55.93%,最终PQQ产量仅为野生菌J1-1的23.76%(图2)。实验结果表明5-179突变菌的PQQ生物合成水平显著下降。

图1 野生型J1-1及突变株5-179发酵液
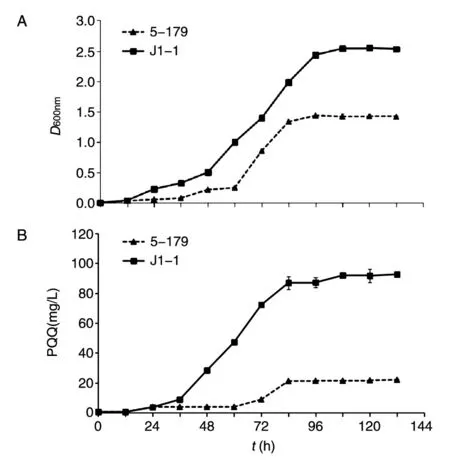
图2 突变株5-179在HM中的生长曲线(A)和PQQ合成水平曲线(B)
2.2 Tn5转座突变株插入位点鉴定
质粒拯救法扩增得到的片段测定序列经与J1-1基因组序列比对后,确定插入位点为染色体第705454位,位于mpq-0708基因内部(705337~705933)。如图 3,mpq-0708基因位于 NADH-醌氧化还原酶基因簇(nuoABCDEF)内,编码NADH-醌氧化还原酶(EC:1.6.5.3)C亚基。KEGG分析结果表明NADH-醌氧化还原酶的功能是将NADH转化为NAD+并产生能量。5-179突变株中nuoC基因为Tn5转座插入而失活,nuoC基因3′端其他基因转录也会受到影响,最终会导致NADH-醌氧化还原酶整体功能受损。
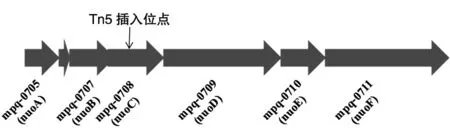
图3 5-179突变株Tn5插入位点
2.3 mpq-0708基因敲除
以敲除菌基因组为模板进行组合PCR鉴定,上游同源臂up-Gm基因、下游同源臂down-Gm基因和单独Gm基因3个组合分别扩增出2500、2500、800 bp的片段,而以野生菌J1-1基因组为模板时均为阴性,说明mpq-0708基因敲除成功。结果见图4。
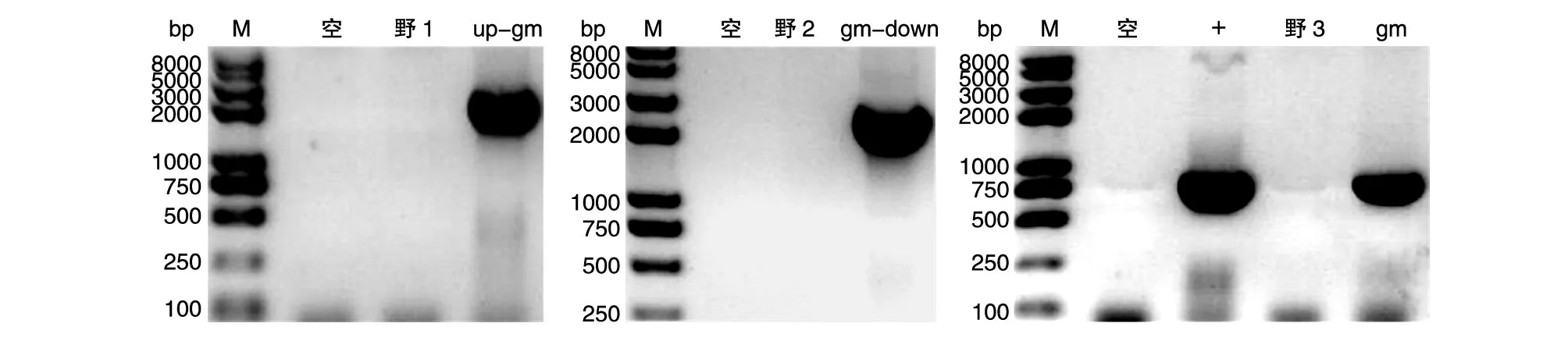
图4 敲除菌J1-1Δmpq-0708的组合PCR鉴定
2.4 敲除菌表型测定
定量检测高产HM培养基中敲除菌J1-1Δmpq-0708和野生菌J1-1的菌体量及PQQ合成水平,结果表明敲除菌生长速度和最终菌体量均低于野生菌,PQQ生物合成速度及最终PQQ产量同样如此。敲除菌到达平台期时最终菌体量仅为野生菌的14.87%,最终PQQ产量仅为野生型J1-1的3.15%(图5A)。敲除菌与Tn5转座诱变突变菌表型变化方向一致,相对于野生菌均下降,敲除菌下降幅度相对更大一些。
低产LM培养基中敲除菌及野生菌检测结果表明,前期敲除菌生长速度稍快于野生菌,后期生长速度和菌体量与野生菌均无显著差异。敲除菌PQQ生物合成速度显著低于野生菌,最终PQQ产量仅为野生菌的52.80%(图5B),变化趋势与在HM培养基中相同。
同时测定了低产LM培养基中敲除菌及野生菌的NADH及NAD+含量,前48 h敲除菌NADH/NAD+比值低于野生菌(图5C),推测是因为敲除了mpq-0708基因,导致NADH醌氧化还原酶将NADH转化为NAD+的能力下降。NADH/NAD+比值反映细胞的能量状态,比值越高表明细胞代谢越旺盛,低产LM培养基中敲除菌及野生菌的NADH/NAD+比值均在第48 h达到最大值,与菌体比生长速度及PQQ比生产速率相符(图5B、C)。
2.5 转录组数据分析
转录组数据分析结果显示,与低产培养基相比,在高产培养基中,mpq-0708基因所在基因簇的6个基因的转录水平是上调的(图6A),PQQ生物合成相关基因mpq-1589(pqqE)、mpq-1590(pqqD)、mpq-1591(pqqC)、mpq-1592(pqqB)的转录水平也是上调的(图6B),mpq-0708基因簇与PQQ生物合成基因簇及PQQ产量变化方向一致,证明能量代谢与PQQ生物合成正相关(图5A),提示mpq-0708基因的转座诱变和敲除有可能通过下调细菌能量代谢水平从而降低PQQ产量。
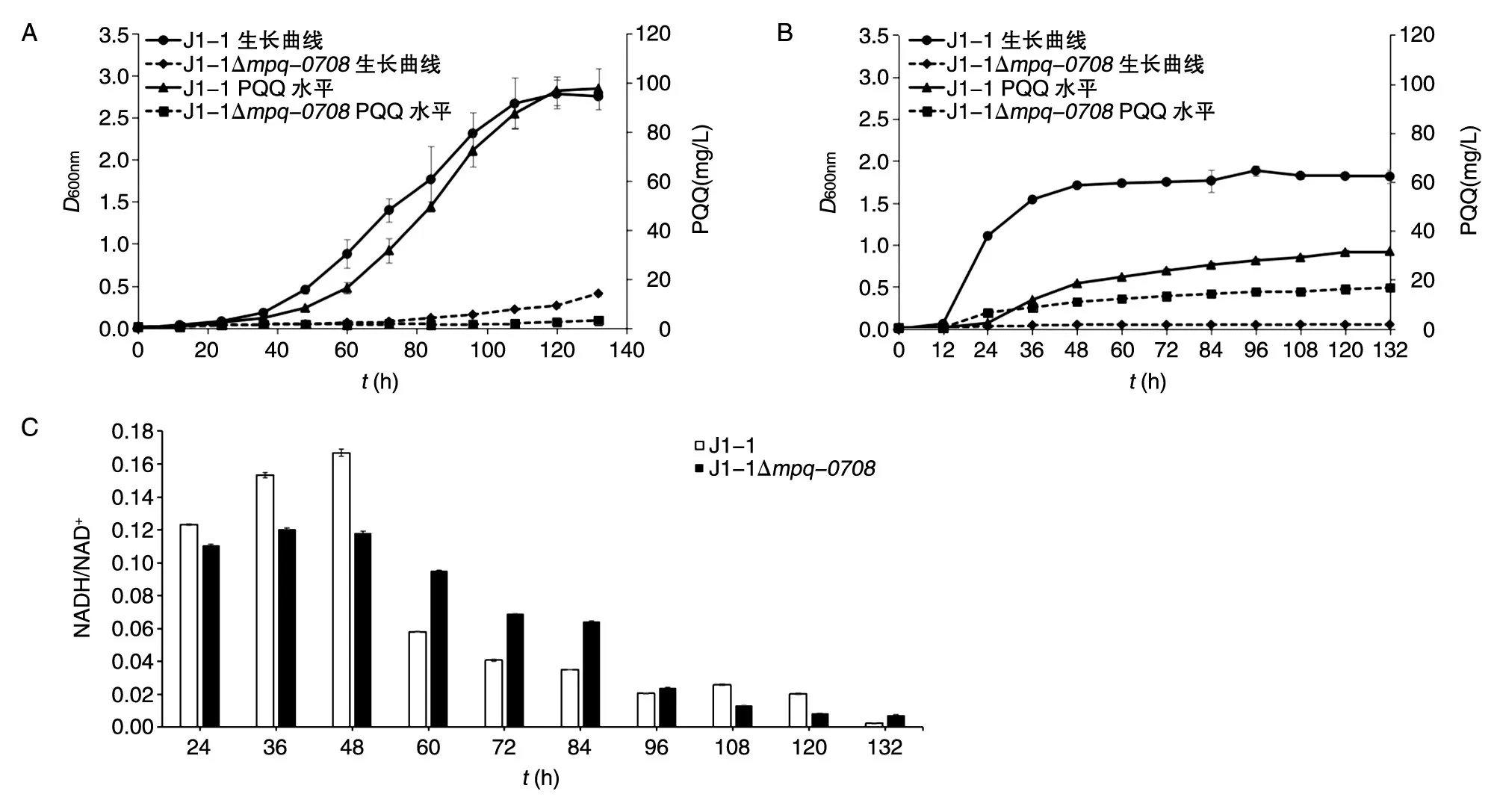
图5 野生菌J1-1、敲除菌J1-1Δmpq-0708在HM培养基(A)、LM培养基(B)中的生长曲线及PQQ合成水平曲线,以及在LM中的NADH/NAD+比值测定(C)
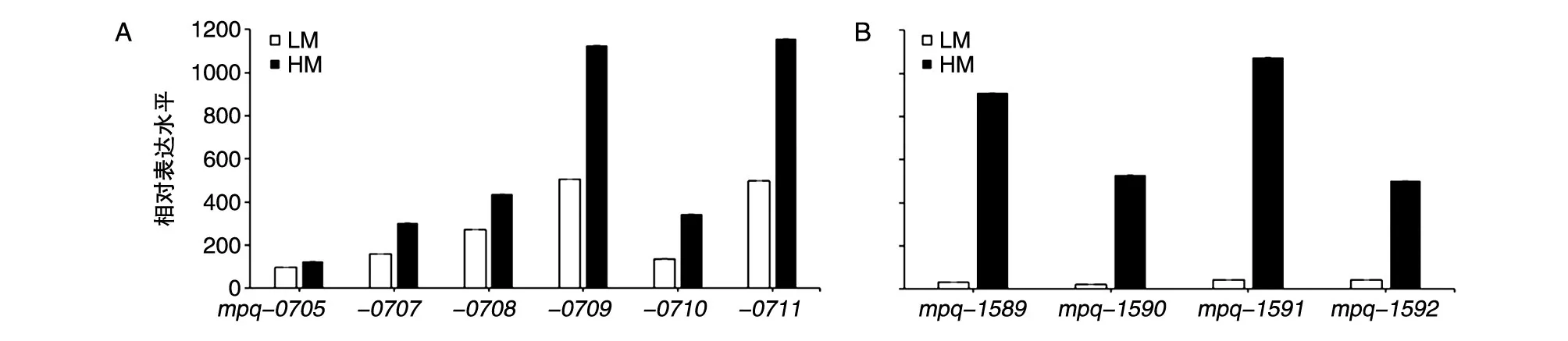
图6 野生菌J1-1在低产LM及高产HM培养基中NADH-醌氧化还原酶基因簇表达水平(A)和PQQ生物合成相关基因表达水平(B)
3 讨论
Tn5转座子属于复合型转座子,可通过抗性筛选。因在宿主中单拷贝复制,所以相比于常规的转座技术,Tn5具有突变性状稳定、突变位点易定位等优势[12];同时Tn5转座还有操作简单、转化效率高,能够快速获得大量稳定遗传的Tn5转座突变株等特点。本研究构建了库容量为1.0×105的Tn5突变体库,筛选到一株PQQ产量明显下降的突变株5-179,且其他文献报道也筛选出相应的PQQ产量下降的菌株[13],这些结果表明利用Tn5转座诱变技术筛选食甲基菌J1-1中PQQ合成基因的方法是可行的。
NAD是氧化还原酶辅酶,其氧化型(NAD+)和还原型(NADH)的比值是细胞能量代谢水平的重要指标,NADH/NAD+比值降低表明细胞新陈代谢能力下降,菌体生长进入衰退[14-15]。经鉴定发现本研究筛选到的突变株5-179其插入位点位于NADH-醌氧化还原酶亚基C(nuoC)编码区内。nuoC是NADH醌氧化还原酶周质空间的一部分,其部分氨基酸残基(Glu138、Glu140和Asp143)对NADH酶的组装及活性是必需的[16]。Tn5插入该基因簇内部,干扰了细胞能量代谢进而影响菌体生长和PQQ合成。同源重组敲除相应基因后表型与Tn5转座诱变表型一致。
此外,PQQ自身也是除NAD和FAD之外的第三类氧化还原酶辅酶,PQQ和NAD均与细胞能量相关,本研究结果提示PQQ合成水平和NADH/NAD+比值相互关联,具体机制有待进一步探讨。

