新型冠状病毒N蛋白优势表位区段抗原的克隆表达及其诊断价值初步评价
王坤,张玲,王超男,陈远哲,范占科,李垚,刘念,冯晓燕,付强,张贺秋,
1.滨州医学院,山东 烟台 264003;2.东方海洋(北京)医学研究院,北京 100071
2019年底,全球陆续出现了一系列原因不明的肺炎病例,2020年2月11日,国际病毒分类委员会(ICTV)将该病原体新型冠状病毒正式命名为严重急性呼吸综合征冠状病毒2(severe acute respiratorysyndrome coronavirus2,SARS-CoV-2),世界卫生组织(WHO)将这一病毒导致的疾病正式命名为新型冠状病毒肺炎(coronavirus disease 2019,COVID-19)[1]。SARS-CoV-2 属于冠状病毒β属,其遗传物质是单正链RNA,基因组包含29 891个核苷酸,与2003年暴发的SARS冠状病毒(SARS-CoV)的同源性为82%。SARS-CoV-2的结构蛋白主要包括棘突糖蛋白(S)、包膜糖蛋白(E)、膜糖蛋白(M)和核衣壳蛋白(N)。N蛋白与基因组RNA形成复合物,在病毒粒子组装过程中与病毒膜蛋白相互作用,在提高病毒转录和组装效率方面起关键作用。同时,N蛋白相对保守,在病毒的结构蛋白中所占比例最大,感染早期机体就能产生抗N蛋白的高水平抗体[2]。
血清学改变是COVID-19患者疾病发展过程中的普遍事件,会发生在感染的早期并一直持续至感染后期,甚至康复期。检测COVID-19患者血清中产生的抗体,可做到早诊断、早隔离、早治疗。病毒感染时,血清中出现的抗体主要是IgM和IgG。IgM抗体表明活跃或最近的感染;IgG抗体在感染中出现较晚,通常表明既往感染,但不排除最近感染的患者,这些患者可能仍然具有传染性,特别是当同时检测到IgM抗体时[3]。为了提高抗体检测试剂的性能,我们利用生物学软件分析了N蛋白氨基酸序列的B细胞表位分布及疏水性,选取含有优势表位的抗原区段进行克隆表达,并对其诊断价值进行了初步评价。
1 材料与方法
1.1 材料
23例经临床确诊的COVID-19患者血清标本、20例乙肝患者血清样本和40例健康体检者血清样本均由广州市第八人民医院提供。大肠杆菌BL21、质粒pColdi为本室保存;DNA限制内切酶BamHⅠ、EcoRⅠ购自Promega公司;HRP标记的抗人IgG、IgM二抗购自Bethyl公司。
1.2 N蛋白抗原性分析及优势表位区段筛选
采用BIOSUN生物信息学软件分析新型冠状病毒N蛋白氨基酸序列,首先输入全长序列,然后利用B细胞表位分析功能,根据表位峰值的高低筛选确定优势表位区段。
1.3 N蛋白优势表位区段抗原表达质粒构建
由北京诺赛生物技术有限公司合成N蛋白优势表位抗原的编码基因,采用BamHⅠ、EcoRⅠ酶切位点,通过双酶切,将N蛋白优势表位抗原的编码基因插入同样经BamHⅠ、EcoRⅠ双酶切的pColdi质粒,获得pColdi-NP重组质粒。
1.4 抗原纯化及制备
将测序正确的重组表达质粒转化大肠杆菌BL21感受态细胞,挑取单菌落于3 mL含氨苄西林钠的LB液体培养基中,37℃振荡培养过夜,次日接种于250 mL新鲜的LB液体培养基中,37℃、160 r/min培养4 h至对数生长期,加150 μL 1 mol/L 的 IPTG,15℃诱导12~14 h,4℃、6000 r/min离心10 min收集菌体;用25 mmol/L Tris-HCl(pH8.5)重悬菌体,冰浴超声,4℃、12 000 r/min离心10 min收集上清,过滤备用。Ni柱纯化,平衡后,将处理好的样品缓慢上样,待吸光度值开始上升时收集穿过液;平衡后,依次用含25、250 mmol/L 咪唑的 25 mmol/L Tris-HCl(pH8.5)溶液洗脱,分别收集蛋白峰,电泳分析纯化产物,验证纯化后的目的蛋白。
1.5 抗原纯度及相对分子质量测定
利用Gel-ProR Analyzer Version 3.0 for Windows软件分析纯化后N蛋白优势表位抗原的相对分子质量和纯度。
1.6 N蛋白优势表位抗原活性鉴定
采用Biocore结合实验检测抗原抗体的相互作用,分别用PBS以1∶100稀释阳性血清和阴性血清。传感器预处理后,以5 μL/min的速率通入血清进行抗体绑定,通入时间分别为1.2 min。随后将1 mg/mL N蛋白优势表位抗原以30 μL/min的速率通入进行结合,通入时间为6 min。解离时间与结合时间相同。
1.7 ELISA法鉴定N蛋白优势表位抗原活性和特异性
采用ELISA方法检测人血清样本中抗新型冠状病毒N蛋白IgM/IgG抗体。用碳酸盐包被缓冲液(pH9.6)稀释N蛋白优势表位抗原,浓度为2.5 μg/mL,每孔包被100 μL,4℃过夜;用洗涤液洗板2 次,200 μL/孔;加入 110 μL/孔封闭液(0.01 mol/L PBS,1%BSA,pH7.2),室温封闭6 h;用洗涤液洗板 5 次,200 μL/孔;真空干燥 4~6 h。检测时,每孔加入100 μL样品稀释液后,分别加入5 μL待测血清,37℃反应30 min,弃液,用洗涤液洗板 5 次,300 μL/孔,拍干,加入 100 μL/孔 HRP标记的抗人IgM/IgG抗体,37℃孵育20 min;用洗液洗板5次,200 μL/孔;加入TMB显色底物A、B液各50 μL,充分混匀,37℃避光反应10 min;加入 50 μL/孔 2 mol/L H2SO4终止反应,终止后 10 min内采用酶标仪测定各孔的D450nm值。
1.8 统计学分析
运用GraphPad Prism 5软件对检测结果进行t检验,以P<0.05为差异有统计学意义,绘制ROC曲线,以约登指数最大判断Cut-off值,≥Cut-off值判定为阳性,<Cut-off值判定为阴性,并计算灵敏度与特异性。
2 结果
2.1 新型冠状病毒N蛋白优势表位抗原区段的确定
利用BIOSUN生物学软件分析寻找B细胞表位,根据表位分布图最终确定N蛋白优势表位抗原区段为15~215 aa(图1)。

图1 新型冠状病毒N蛋白B细胞表位分析
2.2 抗原表达、纯化与鉴定
将测序正确的重组质粒转化大肠杆菌诱导表达,Ni柱纯化后获得纯化抗原,电泳分析纯化产物,验证纯化后的目的蛋白在250 mmol/L咪唑洗脱液中(图2)。Gel-ProR Analyzer Version 3.0 for Windows软件分析结果表明,纯化后N蛋白优势表位抗原的相对分子质量为28.10×103,纯度为96.23%(图3)。

图2 N蛋白优势表位区段抗原SDS-PAGE鉴定
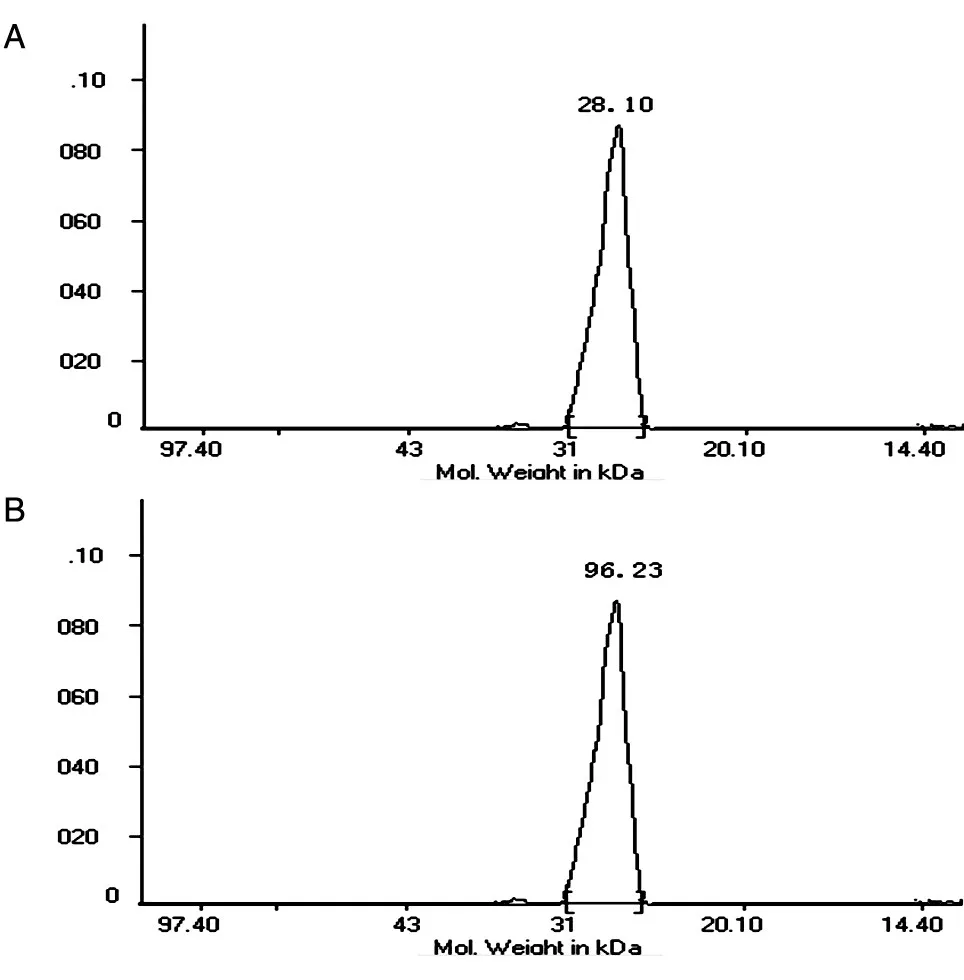
图3 N蛋白优势表位抗原相对分子质量(A)和纯度(B)分析
2.3 N蛋白优势表位区段抗原活性的初步评价
采用Biocore结合实验检测抗原抗体的相互作用,动力学数据见表1。ka为结合速率常数,反映大分子间的作用结合速度;kd为解离速率常数,反映分子复合物解离速度;KD为解离平衡常数(KD=kd/ka)。结果显示,阳性血清与N蛋白优势表位抗原的结合速率常数显著高于阴性血清,同时,阳性血清与N蛋白优势表位抗原的解离速率常数显著低于阴性血清。
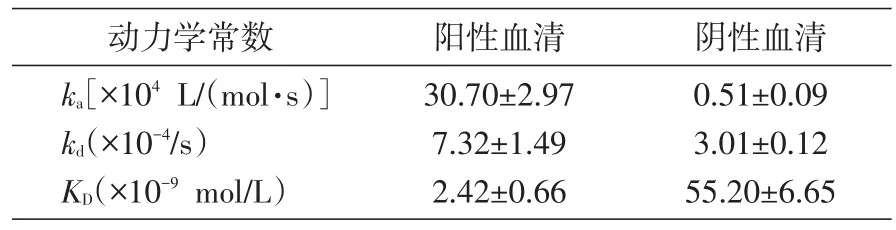
表1 抗原抗体结合力分析
2.4 COVID-19患者血清中的IgM、IgG抗体检测
用N蛋白优势表位区段抗原包被酶联板,间接ELISA法对23例经临床确诊的COVID-19患者血清标本、20例乙肝患者和40例健康体检者血清样本进行抗N抗原IgM和IgG抗体检测,结果如图4。COVID-19患者血清中IgM和IgG抗体水平均显著高于健康体检者和乙肝患者组(P<0.0001)。根据ROC曲线,IgM抗体诊断COVID-19的AUC值为0.797,IgG抗体诊断COVID-19的AUC值为0.998。对于IgM检测,以约登指数最大时的D450nm=0.123为临界值,IgM对COVID-19检测的灵敏度为 60.87%(14/23),特异性为 90%(36/40)。对于IgG检测,以约登指数最大时的D450nm=0.178为临界值,IgG对COVID-19检测的灵敏度为95.65%(22/23),特异性为100%(40/40)。

图4 N蛋白优势表位区段抗原血清学检测性能
3 讨论
2019年12月暴发的COVID-19感染性疾病在全球蔓延,成为国际关注的重大突发事件,据报道人与人之间的传播潜伏期为2~14 d,通过飞沫、受污染的手或物体表面传播[4]。随着SARSCoV-2感染的流行,迫切需要一种准确、快速、低成本的实验室病原学诊断方法。COVID-19流行数据表明,血清学反应,尤其是病毒特异性IgM和IgG,是有效的血清学辅助诊断标志物[5],有助于COVID-19的诊断,包括PCR结果阴性或无临床症状的感染者[6]。冠状病毒所编码的抗原中,N蛋白具有较高的免疫原性,可在早期感染时分泌到体液中,有可能作为抗原检测的生物标志物,同时抗N蛋白抗体可被用于检测冠状病毒感染[7]。
本研究为了获得高活性N蛋白抗原,通过生物学软件分析选取了优势表位区段抗原并获得了高效表达,采用Biocore结合实验初步确定15~215 aa优势表位区段抗原可以与COVID-19患者血清样本发生特异性抗原抗体反应。接下来放大样本进行检测,结果显示基于本研究优势表位区段抗原所建立的IgM和IgG检测方法可以很好地区分COVID-19患者和健康对照,尤其是IgG检测具有优异的检测性能。
在本研究中,抗NP-IgM(90%)和抗NP-IgG(100%)检测的特异性均较高,但本次实验检测的COVID-19患者中抗NP-IgG的阳性率(95.65%)却显著高于抗NP-IgM的阳性率(60.87%),这可能是由于IgM抗体出现在感染最早期,抗NP-IgM的血清转化发生在发病后7~12 d,而有些患者则发生在症状出现后1 d[8]。随着感染时间延长,一些患者的IgM抗体发生阴转,继而出现IgG抗体。血清中抗体的转化时间是因人而异的,同样,由于病情严重程度不同,患者的血清学反应也会有所不同[9]。本研究入组的COVID-19患者均已确诊并入院治疗,并非全部为早期感染者,所以NP-IgM的阳性率较低。根据本研究结果综合考虑,抗NP-IgG和抗NP-IgM对COVID-19的鉴别诊断都有价值,在早期筛查诊断中应该将两者联合使用,以提高诊断效率和筛查准确率。而在大规模流行病学调查中,由于IgG在患者体内存在时间更长久,NP-IgG是更好的检测标志物。
据报道,COVID-19抗体检测方法还可检测针对SARS-CoV-2中S蛋白的血清IgM/IgG抗体[10]。研究发现,抗N蛋白与抗S蛋白抗体联合检测可在发病后1周内将阳性率从41.7%显著提高至75%[11-12],将抗N蛋白抗体与抗S蛋白抗体检测相结合,是提高COVID-19筛查能力的更有效策略。因此,为了进一步提高抗体检测的灵敏度,我们在后期研究中设计将易表达的N蛋白优势表位区段与难表达的S蛋白优势表位区段构建成一个融合表达抗原,进一步提高检测的灵敏度和特异性。

