ACE2-mCherry融合基因表达载体的构建及功能验证
蒋晓祎,侯欣妤,张波,任禾,牛祖彪,郑幽,王雨琪,孙强,黄红艳
1.首都医科大学 附属北京世纪坛医院肿瘤内科,北京 100038;
2.军事医学研究院 生物工程研究所,北京 100071
2019年末暴发的新型冠状病毒肺炎(COVID-19),给全世界造成了巨大灾难。COVID-19由SARS-CoV-2病毒引起,其感染机体的关键环节之一是病毒表面的刺突蛋白(S蛋白)与宿主细胞表面的受体血管紧张素转化酶2(angiotensin-converting enzyme 2,ACE2)结合[1]。
人ACE2基因位于第17号染色体上,跨越18个外显子[2],编码一个含805个氨基酸残基的跨膜糖蛋白。该蛋白是一种与ACE同源的金属羧肽酶,具有明显的信号肽、单一的金属蛋白酶活性位点和跨膜结构域,可降解血管紧张素Ⅰ(angiotensinⅠ,AngⅠ)生成Ang1-9,降解血管紧张素Ⅱ(AngⅡ)生成Ang1-7[3-4]。Ang1-7作用于Mas受体,起到舒张血管和降低血压的作用[5-6]。
ACE2在SARS-CoV-2入侵人体时发挥关键作用。SARS-CoV-2的S蛋白在感染细胞时起主要作用,它主要包括S1和S2两个片段,S1片段识别细胞表面的ACE2并与之结合,介导病毒进入细胞,S2促进病毒与细胞膜间的融合[7-9]。
为了动态追踪ACE2的表达情况,我们拟构建ACE2与红色荧光蛋白的融合表达载体,并初步验证载体功能,以期为后续新冠病毒的研究奠定基础。
1 材料与方法
1.1 材料
人胚肾细胞293T、包含目的基因ACE2的质粒 pcDNA3.1-ACE2-3xFlag、pQCXIP-mCherry-Lamp载体、pSec-SARS-CoV-2-S质粒由本实验室提供;大肠杆菌感受态细胞Trans10、dNTPs、TaqDNA聚合酶购自北京全式金生物技术有限公司;pQCXIP-mCherry载体购自Promega公司;Q5超保真DNA聚合酶,限制性内切酶XhoⅠ、AgeⅠ及Cutsmart酶切缓冲液购自New England Biolabs公司;同源重组试剂盒购自中美泰和生物技术(北京)有限公司;PCR试剂盒、琼脂糖凝胶DNA回收试剂盒、无内毒素质粒小提中量试剂盒购自天根生化科技(北京)有限公司;Opti-MEM减糖培养基购自购自Thermo Fisher公司;脂质体LipofectAMINE 3000购自Invitrogen生命技术有限公司;胎牛血清(FBS)购自PAN-Biotech公司;高糖DMEM培养基、磷酸缓冲盐溶液(PBS)、化学发光检测盒、0.25%-EDTA胰酶购自中国迈晨科技公司;鼠源ACE2抗体、鼠源β-actin抗体购自Proteintech公司;鼠源SARS-CoV-2 spike抗体购自GeneTex公司;辣根过氧化物酶标抗鼠IgG、Hochest 33342购自CST公司。
1.2 基因测序与引物序列合成
单链向导 RNA(sgRNA)寡核苷酸(oligo)的DNA序列合成及基因测序由中美泰和生物技术公司完成。
1.3 PCR扩增目的基因
以pcDNA3.1-ACE2-3xFlag载体为模板设计PCR 扩增引物 ACE2-PQC-F(5′-GATCCGCGGCC GCACCGGGATCTATGTCAAGCTCTTCCTGGCTCCT TCTC-3′)、ACE2-R-mCh(5′-CTTGCTCACCATGG TGGCGACAAAGGAGGTCTGAACATCATCAGTGTT TTGG-3′)。引物的3′端包含能与模板DNA结合的碱基序列,以便扩增出目的DNA片段;引物的5′端包含与线性化载体末端同源的碱基序列,以便PCR扩增片段能与线性化载体进行重组反应。PCR反应条件:98℃预变性30 s;98℃变性10 s,60℃退火30 s,72℃延伸45 s,33个循环;72℃延伸2 min。扩增得到目的基因片段ACE2。扩增产物通过琼脂糖凝胶电泳进行检测,紫外线透射仪下观察电泳结果,后用胶回收试剂盒回收PCR产物。
1.4 重组载体的构建及鉴定
采用SnapGene 3.2.1软件设计载体pQCXIPACE2-mCherry(图1),用XhoⅠ、AgeⅠ限制性内切酶对pQCXIP-mCherry-Lamp进行切割,37℃水浴3 h,10 g/L琼脂糖凝胶电泳检测酶切结果,待DNA完全消化后(电泳显示单一条带),回收纯化酶切产物。

图1 pQCXIP-ACE2-mCherry载体构建示意图
将目的基因ACE2片段与酶切后的线性化载体用同源重组酶连接,重组产物用热激法转化大肠杆菌Trans10感受态细胞,用氨苄青霉素(Amp)筛选,37℃培养12 h后挑取单菌落到LB培养基中,37℃、180 r/min振荡过夜培养后测序鉴定,获得重组表达载体pQCXIP-ACE2-mCherry。
1.5 质粒转染
293T细胞按1.0×106/孔的密度接种于6孔板,用含10%胎牛血清的高糖培养基DMEM于37℃、5% CO2培养箱中常规培养12 h,待细胞生长至汇合度80%时进行转染。设置实验组和对照组。实验组,将 1 μg pQCXIP-ACE2-mCherry表达载体和1 μg pSec-SARS-Cov2-S表达载体共同稀释在100 μL Opti-MEM培养基中,用LipofectAMINE 3000脂质体作为瞬时转染介质,共转入293T细胞,6 h后换成DMEM培养基。对照组,将载体pQCXIP-ACE2-mCherry换成pQCXIP-mCherry,其他条件不变。
1.6 活细胞拍摄观察融合基因的表达
转染48 h后在培养基中加入Hochest 33342染料(稀释比为1∶1000)对细胞核染色,用荧光显微镜(Nikon Eclipse)同时采集实验组和对照组的293T细胞图像(DIC、DAPI及mCherry通道),观察荧光蛋白表达情况。
1.7 Western印迹鉴定瞬时转染细胞系中ACE2及S蛋白的表达
荧光显微镜采集图像后吸走培养基,PBS清洗后用RIPA裂解细胞,提取细胞总蛋白并用BCA法定量蛋白,每个样品各取50 μg总蛋白,和上样缓冲液混合后煮沸10 min变性,完成蛋白样本的制备。将样本进行SDS-PAGE,电泳结束后将蛋白转至PVDF膜上,用5%脱脂奶粉室温封闭1 h后加入鼠源ACE2抗体(稀释比为1∶3000)、SARS-CoV-2 spike抗体(1∶2000)、β-actin抗体(1∶8000),4℃或室温下孵育12 h后用二抗抗鼠IgG(1∶3000)常温孵育1 h,加入曝光底物进行曝光。以β-actin为内参,Western印迹检测实验组及对照组ACE2和S蛋白的表达水平。
2 结果
2.1 pQCXIP-ACE2-mCherry载体的鉴定
用引物ACE2-PQC-F和ACE2-R-mCh扩增所得产物为2459 bp(图2A),与预期相符,提示ACE2扩增成功。用XhoⅠ、AgeⅠ限制性内切酶对pQCXIP-mCherry-Lamp进行双酶切,共做2份,电泳显示2号酶切成功(图2B)。胶回收目的片段ACE2和切割完成的线性载体pQCXIP-mCherry,用同源重组方法将ACE2与线性载体连接,转化后挑取单克隆测序,结果显示插入序列正确无误(图2C),证明pQCXIP-ACE2-mCherry融合载体构建成功。
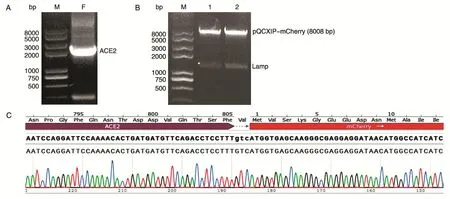
图2 ACE2的PCR扩增和表达载体构建
2.2 ACE2-mCherry融合蛋白在293T细胞中的表达
研究发现,SARS-CoV-2的S蛋白与ACE2受体结合后,S蛋白将裂解为S1和S2片段,其中S2片段能诱导胞膜融合[7]。在此,我们利用合胞体形成实验来观察是否出现膜融合现象,从而验证ACE2-mCherry是否发挥功能。如图3所示,载体通过脂质体法转染293T细胞,48 h后在荧光显微镜下可见293T细胞有红色荧光蛋白的表达。实验组中,当共转含ACE2和S蛋白的质粒时,有大量合胞体形成,而对照组无ACE2时几乎无合胞体产生,证明ACE2-mCherry融合蛋白在293T细胞中表达,并且和S蛋白结合,使其诱导膜融合。
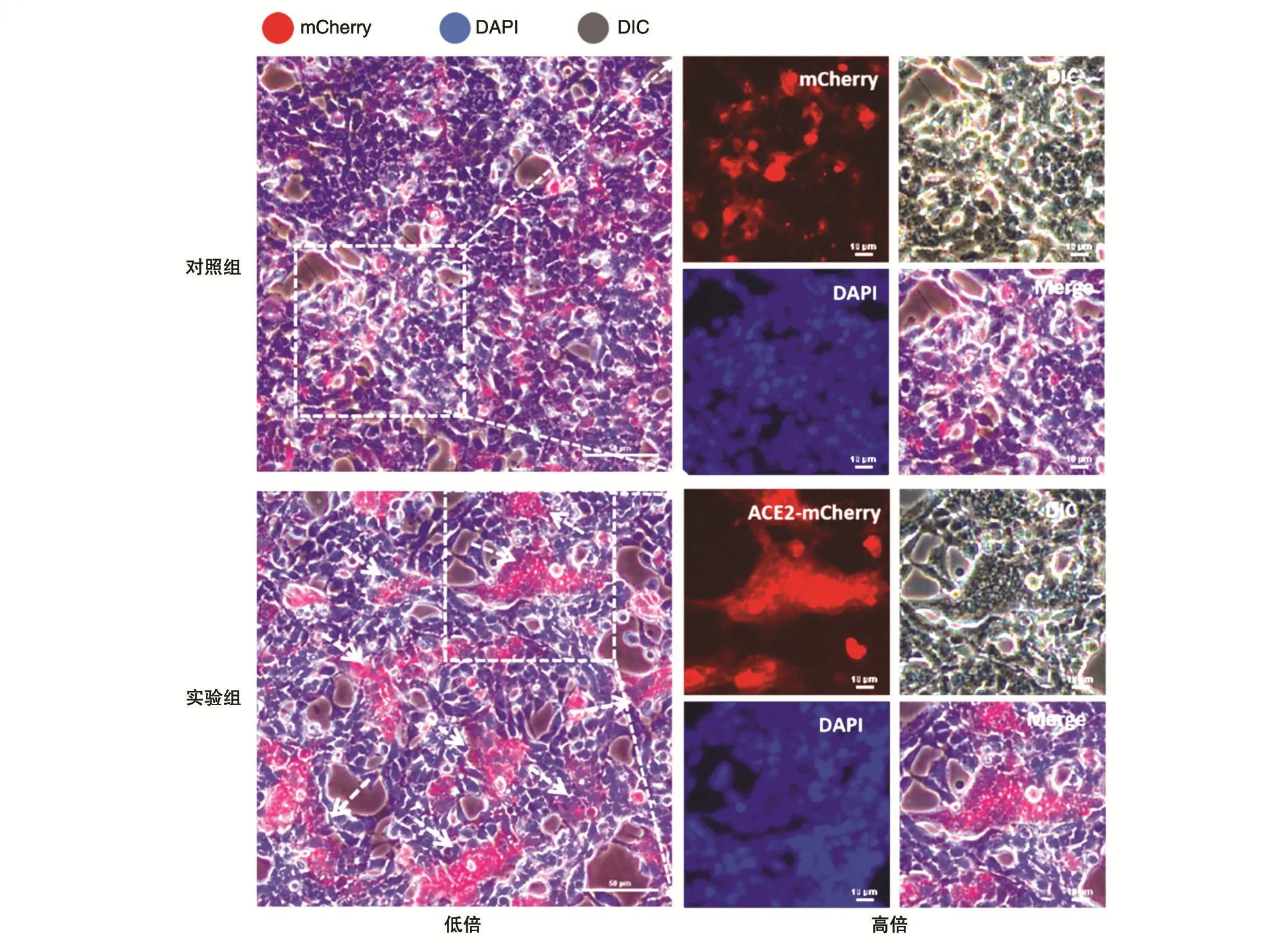
图3 ACE2-mCherry融合蛋白在293T细胞中的表达
2.3 Western印迹检测瞬时转染细胞系中ACE2及S蛋白的表达
为了再次验证ACE2是否成功表达且发挥功能,我们在蛋白水平检测ACE2、S及S2蛋白的表达情况。如图4,SARS-CoV-2的S蛋白全长在实验组和对照组均表达且无明显差别,证明pSec-SARS-CoV-2-S质粒均成功转染且表达量相差不大。实验组中S2表达,而对照组几乎不表达,证明ACE2-mCherry发挥其作为S蛋白受体的功能。
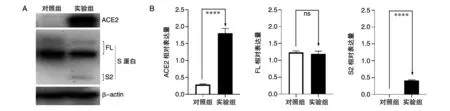
图4 Western印迹验证蛋白的表达量
3 讨论
ACE2是SARS-CoV-2入侵宿主细胞的关键受体,研究其表达谱具有重要意义。ACE2可在人体心脏、肺脏、肝脏、肾脏、睾丸、肠等多种组织中表达[4,10]。它在肺组织中主要分布于Ⅱ型肺泡细胞,少量分布于Ⅰ型肺泡细胞、气道上皮细胞、成纤维细胞、内皮细胞和巨噬细胞,表达量下调是急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)发生的重要原因之一[11-13]。系统和/或局部的ACE/ACE2活性失衡已被认为是许多疾病的重要致病因素。
SARS-CoV-2与ACE2的结合是病毒感染的重要环节和前提条件,因此阻断二者结合是抑制病毒感染的一种有效方法。目前能够阻止其与病毒结合发挥作用的药物正在被研发。Vanessa等[14]利用体外纯化的临床级人重组可溶性ACE2(human recombinant solubility ACE2,hrsACE2)将SARS-CoV-2感染的非洲绿猴肾细胞(Vero)中的病毒生长率降低至1/1000~1/5000;中国科学院生物物理研究所王祥喜团队在前期筛选到一株对冠状病毒β家族有广谱中和作用的人源化单克隆抗体H014的基础上[15],发现了一种高效的SARSCoV-2特异性中和抗体P17,可阻碍SARS-CoV-2的RBD蛋白与受体ACE2之间的相互作用,并能阻断病毒的膜融合过程[16];Kruse阐述了将可溶性ACE2与免疫球蛋白Fc域融合(ACE2-Fc),既可阻断SARS-CoV-2的进入,又可以帮助免疫系统建立持久的免疫[17]。
另外,由于ACE2参与人类疾病的多种病理生理过程,进一步了解它在疾病中的作用将有望引导探索新的治疗方向。使用ACE2抑制剂进行功能研究对于阐明ACE2的调控机制至关重要。
为了进一步研究ACE2基因在介导病毒感染中的功能,建立带有荧光标记的ACE2融合表达系统是有效方法之一。本研究利用同源重组方法构建了ACE2基因以及带有荧光标记蛋白mCherry的真核表达载体pQCXIP-ACE2-mCherry,通过活细胞荧光显微镜成像及Western印迹检测到目的荧光的表达及蛋白表达。在成功构建融合基因基础上,本研究进一步对该表达载体表达的目的蛋白ACE2的功能进行了初步验证。实验结果显示ACE2能够介导病毒与宿主细胞结合,进而导致细胞内大量合胞体的出现,与公认已知的ACE2参与病毒感染的研究结果一致,再次说明该系统的构建能够为进一步探讨ACE2功能提供有效的模型。本研究为深入了解ACE2在SARS-CoV-2感染治疗中的作用及相应机制奠定了实验基础。

