利用特异性抗体建立金黄色葡萄球菌肠毒素B快速检测方法
周刘忠,胡乃静,张丁木,王志宏,吴佳果,罗龙龙,石艳春
1.内蒙古医科大学,内蒙古自治区分子生物学重点实验室,内蒙古 呼和浩特 010058;
2.军事医学研究院 毒物药物研究所,重大疫情应急防控药物研究室,北京 100850
金黄色葡萄球菌(金葡菌)已经与人类共同生存了一万多年[1],是一种进化得非常成功的革兰阳性病原体,在自然界中广泛存在[2]。人体感染金葡菌主要有2种途径,即食源性感染与院内感染。近年来有证据显示,在新鲜食物和即食食品中,金葡菌是主要的食源性病原体之一,并且在世界各国均报道过中毒案例[3]。美国每年约有20万金葡菌感染病例[4];在中国的食物中毒事件中,微生物中毒占53.7%,其中多数为金葡菌感染所致。金葡菌对食品的污染非常广泛,例如鸡、鱼、乳制品、肉类、寿司和生鱼片等[5-10],极大地威胁消费者的健康。在金葡菌所致的食物中毒中,90%以上与金黄色葡萄球菌肠毒素(staphylococcal enterotoxin,SE)有关。据报道,金葡菌能够产生23种血清型的肠毒素[11],SEA~SEE被认为是引起中毒的主要毒素,其中SEB的毒性大且稳定性强,被认为是最强效的毒素之一[12]。
SEB为一条单链多肽,相对分子质量约28.5×103,包含2个结构域。结构域1在N端1~120位残基,包括2个β片层和3个α螺旋;结构域2位于C端127~239残基,含2个α螺旋、2个短β折叠和2个β片层[13]。SEB是一种超抗原,其主要作用方式是通过桥联抗原递呈细胞表面的主要组织相容性复合体(major histocompatibility complex,MHC)Ⅱ类分子与T细胞受体(T cell receptor,TCR)β链V区,形成MHCⅡ-SEB-TCR复合物,直接刺激T细胞活化与增殖,释放细胞因子,最终导致细胞死亡[14]。SEB中毒后会引起一系列中毒反应甚至产生中毒性休克综合征,临床表现为高热、低血压、红疹、体重减轻、多器官功能衰竭甚至死亡,病死率可达50%[15]。人体接触SEB后潜伏期仅4~6 h[16]。SEB热稳定性强,100℃煮沸30 min仍然不能使其失活[12],且毒素致死剂量低,据估计,SEB在人体半数致死剂量可能为0.02 μg/kg。因此,开发有效检测SEB的方法对临床诊断具有重要意义。
我们以3株具有自主知识产权的高亲和力抗SEB抗体LXY8、LXY9、LXY10为研究对象,探索不同抗体的配对组合在SEB检测中的潜在应用。首先,利用大肠杆菌原核表达系统制备SEB抗原,并借助哺乳动物细胞表达系统制备3株抗SEB抗体;然后,拟优化建立一种特异、灵敏的定量检测SEB的双夹心ELISA方法,通过抗体配伍试验获得检测灵敏度最低的配对抗体;最后,基于最佳配对的抗体开发胶体金检测试纸条,用于体外SEB的快速检测。
1 材料与方法
1.1 材料
SEB抗原和抗体LXY8、LXY9和LXY10由本实验室制备并保存;羊抗人IgG-HRP购自北京索莱宝科技有限公司;辣根过氧化物酶标记的链霉素(Streptavidin-HRP)购自安捷伦科技有限公司;TMB显色液购自Invitrogen公司;包被液(0.1 mol/L碳酸钠-碳酸氢钠缓冲液,pH9.6)、PBS购自Gibco公司;蛋白互作运行缓冲液或ELISA洗涤液PBST溶液(0.1%吐温20溶于PBS)和1.5%酪蛋白封闭液购自Sigma公司。
1.2 生物膜干涉法测定抗体亲和力
将联机电脑和Fortebio仪器打开,待指示灯停止闪烁,温度稳定后,打开软件连接系统。将3株抗体分别固定到Anti-Human IgG Fc Capture(AHC)芯片上,SEB用运行缓冲溶液梯度稀释为64.8、32.4、16.2、8.1、4.05、2.03、1.01 nmol/L,设置结合时间为300 s,解离时间为600 s。测试完成后将芯片用10 mmol/L甘氨酸-盐酸(pH1.7)溶液脉冲5 s,运行缓冲液再生5 s,重复3次。将原始数据导入分析软件进行动力学方法分析,计算结合解离常数并绘制动力学曲线。
1.3 间接ELSIA法测定抗体结合活性
用包被液稀释SEB抗原至1 μg/mL,将SEB抗原加入聚丙烯酰胺酶联板中(100 μL/孔),4℃包被过夜,用洗板机洗板3次;按200 μL/孔添加1.5%酪蛋白封闭液于酶联板中,37℃封闭1 h,用洗板机洗板3次;用PBS缓冲液将生物素化抗体(LXY8-Biotin、LXY9-Biotin、LXY10-Biotin)起始浓度稀释至5 μg/mL,并按1/3梯度稀释至12个浓度,按100 μL/孔将不同浓度的生物素标记抗体加入酶联板中,设置上下孔为复孔,37℃孵育1 h;用洗板机洗板3次,按1∶4000稀释Streptavidin-HRP,100 μL/孔加入酶联板,室温放置 45 min;用洗板机洗板3次,每孔加入100 μL TMB显色液,室温避光放置2 min;每孔加入100 μL 1 mol/L的H2SO4终止液终止反应;用酶标仪测定D450nm值。应用Graphpad Prism 5软件分析数据,以生物素化抗体浓度为横坐标、D450nm值为纵坐标绘制四参数方程拟合曲线,方程为y=(A-D)/[1+(x/C)^B]+D,其中B为斜率,C为EC50。
1.4 竞争ELISA法鉴定抗体表位交叉情况
用包被液稀释SEB抗原至1 μg/mL,按100 μL/孔将SEB抗原加入聚丙烯酰胺酶联板中并于4℃包被过夜,然后将酶联板用洗涤液洗涤3次;按200 μL/孔添加1.5%酪蛋白封闭液于酶联板中,37℃封闭1 h,然后将酶联板板用洗涤液洗涤3次;用PBS缓冲液分别稀释3种生物素标记抗体至0.25 μg/mL,以上述固定浓度的生物素化抗体溶液为稀释液,稀释未标记生物素的裸抗体LXY8、LXY9和LXY10至 5 μg/mL,并进行 1/2梯度稀释12个浓度,而生物素标记的抗体为固定浓度即0.25 μg/mL,将上述稀释产物加入对应的酶联板中并做好标记,设置上下孔为复孔,于37℃放置1 h;用洗板机洗板3次,按1∶4000稀释Streptavidin-HRP,按 100 μL/孔加入酶联板,室温放置45 min;用洗板机洗板3次,每孔加入100 μL TMB显色液,室温避光放置2 min;每孔加入100 μL 1 mol/L 的 H2SO4终止液终止反应;酶标仪测定D450nm值。应用Graphpad Prism5软件分析数据,以未标记的裸抗体浓度为横坐标、D450nm值为纵坐标绘制四参数方程拟合曲线,方程为y=(A-D)/[1+(x/C)^B]+D,其中B为斜率,C为EC50。
1.5 双夹心ELISA法检测SEB抗原
用包被液稀释抗体LXY8、LXY9或LXY10至2 μg/mL,按 100 μL/孔加入酶联板中并于 4℃包被过夜,然后将酶联板用洗涤液洗涤3次;按200 μL/孔添加1.5%酪蛋白封闭液于酶联板中,37℃封闭 1 h,然后将酶联板板用洗涤液洗涤3次;用PBS缓冲液将标准SEB抗原样品稀释至1 μg/mL,并进行1/2梯度稀释12个浓度,按100 μL/孔加入对应的酶联板中,设置上下孔为复孔,于37℃放置1 h;洗板机清洗酶联板3次,按100 μL/孔加入5 μg/mL生物素标记的抗体,固相化的LXY8、LXY9或LXY10分别与生物素标记的抗体配对,共设置6种配伍方案,酶联板在37℃放置1 h;用洗板机洗板3次,1∶4000稀释Streptavidin-HRP,按 100 μL/孔 加 入 酶 联 板 ,室 温 放 置 45 min;用洗板机洗板3次,每孔加入100 μL TMB显色液,室温避光放置2 min;每孔加入100 μL 1 mol/L的H2SO4终止液终止反应;用酶标仪测定D450nm值。应用Graphpad Prism 5软件分析数据,以标准SEB抗原浓度为横坐标、D450nm值为纵坐标绘制四参数方程拟合曲线,方程为y=(A-D)/[1+(x/C)^B]+D,其中B为斜率,C为EC50。
1.6 SEB检测试纸条的试制
SEB检测试纸条是基于LXY8和LXY10配对抗体制备的快速检测试纸条,其结构如图1所示。

图1 试纸条结构示意图
该试纸条的检测原理为:当将待测样本滴加到样品垫上,待测样品会向胶体金垫方向层析,如待测样本中含有SEB抗原,当待测样品层析至胶体金垫可与胶体金标记的抗体LXY8结合形成抗原-胶体金标记抗体复合物并继续向测试线(T线)方向层析,当复合物经过T线时会与T线上固相的抗体LXY10结合,形成抗体-抗原-胶体金抗体复合物,当胶体金颗粒在测试线大量聚集时,形成肉眼可见的红色或粉红色斑点,以测试线颜色的有无及深浅来判定检测结果,如形成红色线条则结果呈阳性,反之则为阴性。在控制线(C线)处包被羊抗人IgG,会与胶体金标记的LXY8结合形成红色条带,以此对测试反应进行质控。
以不同的溶剂配置不同SEB浓度来测试胶体金检测试纸条对不同溶剂中SEB的检测灵敏度,阳性对照为100 μg/mL SEB,阴性对照为PBS溶液。只有控制线(C线)形成肉眼可见的红色条带记为阴性结果,而测试线(T线)和控制线(C线)均形成肉眼可见的红色条带记为阳性结果。
1.7 数据处理
分析所有数据,并采用GraphPad Prism 5软件绘制图表。数据表示为x±s。
2 结果
2.1 抗体亲和力测定结果
利用生物膜干涉技术测定3株抗体的亲和力。表1给出了3株抗体与SEB抗原的结合常数(kon)、解离常数(kdis)以及最终的亲和力常数(KD)。结果表明,3株抗体均与SEB抗原具有较高的亲和力。

表1 抗体LXY8、LXY9、LXY10与SEB的亲和力
2.2 间接ELISA法测定抗体结合活性
利用间接ELISA法测定生物素标记的抗体LXY8-Biotin、LXY9-Biotin和LXY10-Biotin与SEB的结合活性,结果如图2。3株抗体均与SEB抗原具有良好的结合活性,且抗体的结合具有一定的浓度依赖性。LXY8、LXY9、LXY10与SEB抗原结合 半数 有效 浓度(EC50)分 别 为 0.021、0.040、0.029 μg/mL,实验结果与亲和力测定的数值一致。选取四参数曲线上平台最低饱和浓度,即LXY8-Biotin、LX9-Biotin和 LXY10-Biotin浓度约为0.25 μg/mL作为抗原表位竞争的最优浓度。
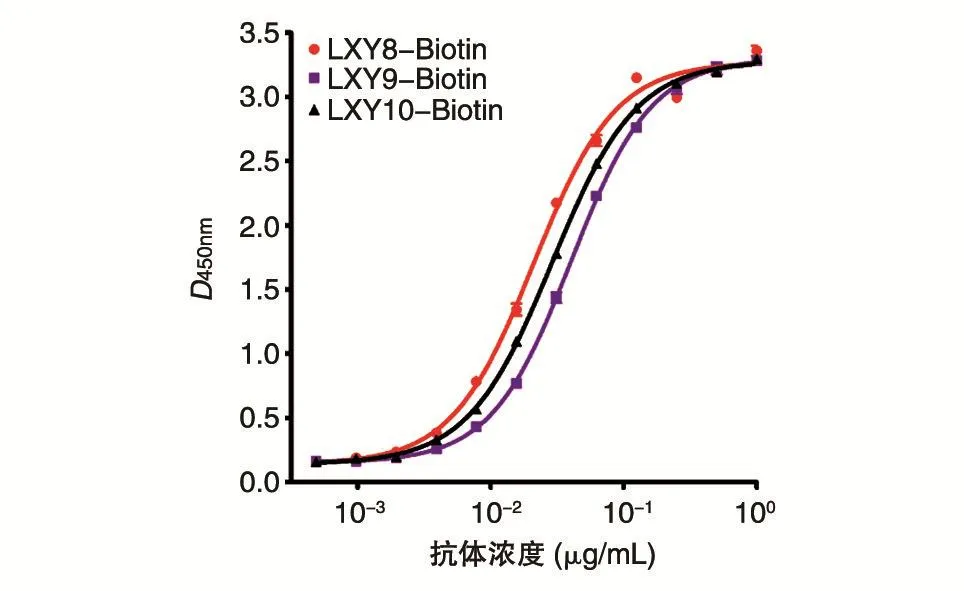
图2 间接ELISA法测定抗体结合活性
2.3 竞争ELISA法鉴定3株单克隆抗体识别表位交叉情况
根据2.2摸索的生物素标记的抗体浓度(即0.25 μg/mL)开展3株抗体识别表位交叉研究。理论上,生物素标记的抗体与固相SEB抗原结合饱和后,如加入的未经标记的抗体与生物素标记的抗体结合表位完全重叠或部分交叉,则未标记的抗体可以将生物素标记的抗体竞争下来。结果如图3。以图3A为例,SEB与LXY8-Biotin结合饱和后,分别加入梯度稀释的3种抗体,只有LXY8能够与LXY8-Biotin竞争结合抗原,表现为反应孔的吸光度值降低,即只有识别同一表位的LXY8能阻断SEB与LXY8-Biotin的结合,提示LXY9、LXY10与LXY8的抗原表位不重叠。类似结果如图3B、C。因此,LXY8、LXY9、LXY10抗体与SEB结合的表位并不交叉。
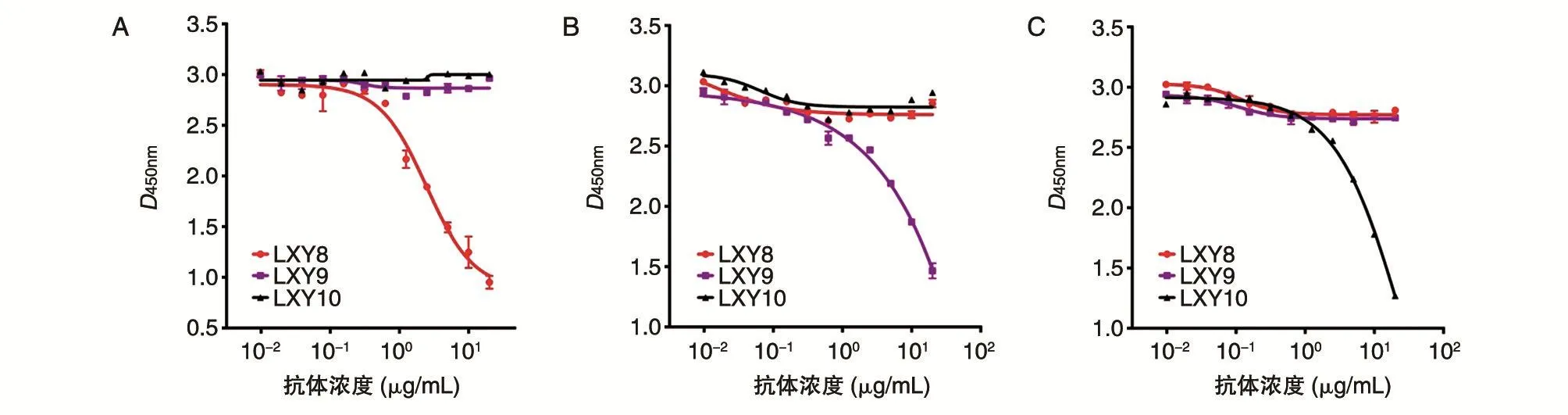
图3 竞争ELISA法鉴定3株抗体识别的抗原表位不重叠
2.4 双夹心ELISA法检测SEB抗原
根据2.3实验结果可判断3株抗体与SEB结合表位不重叠,因此可以固定其中一种抗体捕获SEB,同时用生物素标记的另一种抗体作为检测抗体,实现对SEB的检测。对3株抗体进行两两配对(配对方式见表2),结果如图4,任意2株抗体的组合均能有效检出SEB。同时,将大于本底2倍左右的吸光度值作为抗体对SEB的最低可检浓度。以LXY8为固定相,LXY9-Biotin和LXY10-Biotin作为检测抗体时最低检测限分别约为1630、290 pg/mL;以LXY9为固定相,LXY8-Biotin和LXY10-Biotin检测时最低检测限分别约为600、440 pg/mL;以LXY10为固定相,LXY8-Biotin和LXY9-Biotin作为检测抗体时最低检测限分别约为240、460 pg/mL。综合以上数据,LXY10(固定相)与LXY8-Biotin的配对相对最佳,可实现最低检测限为240 pg/mL,为后续SEB检测试剂的开发提供了有力支持。

表2 用于双夹心ELISA法检测SEB含量的抗体配对表

图4 3株抗体两两配对SEB检出图
2.5 SEB胶体金检测试纸条的试制
SEB胶体金检测试纸条基于LXY8和LXY10配对抗体开发。首先,以PBS为溶剂配制不同浓度的SEB样品测试胶体金检测试纸条最低检测限度,结果如图5A,当SEB浓度大于2 ng/mL时,试纸条的测试线(T线)和控制(C线)均显示条带,表明胶体金检测试纸条最低检测限度为2 ng/mL。其次,考查了SEB存在于不同溶剂中对检测结果的影响,溶剂与SEB的配置方法见表3,结果如图5B,配制5 ng/mL的SEB所选择的几种溶剂均未影响试纸条的检测限,测试线和控制线均出现红色条带。

图5 初步验证SEB胶体金试纸条的检出限以及对待测样品溶剂的耐受性
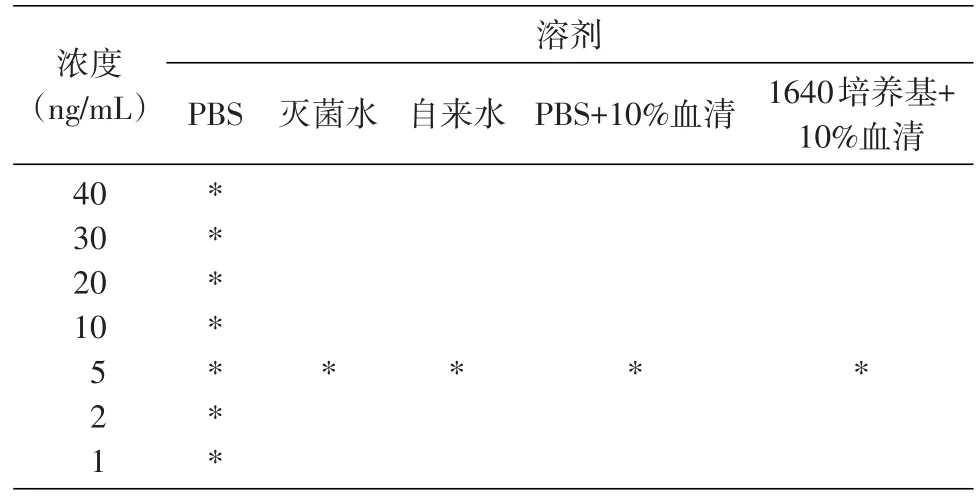
表3 用不同溶剂配制SEB浓度表
3 讨论
目前,SEB检测方法有分子生物学方法、仪器分析法、生物传感法及免疫学方法[18]。分子生物学方法,如聚合酶链式扩增(PCR)[19]、核酸杂交[20]等可以直接检测到金葡菌中SEB的基因序列。但这种检测方法只能基于金葡菌存在的条件下检测,且如果在核酸提取过程中受损会造成假阴性结果。仪器分析法主要是通过色谱法[21]或质谱法等精密仪器直接对SEB毒素分子进行检测。生物传感检测方法能够在原有检测技术上运用新型检测平台及检测原理有效提升SEB的检测速度和灵敏度,Panneerseelan等[22]开发了免疫PCR信号放大方法,通过PCR扩增检测毒素分子的DNA含量,该方法检测限低至7.5 fg/mL。尽管仪器分析法和生物传感检测方法能够更加精准灵敏地检测SEB,但两者对实验操作和实验环境的要求较高,不能满足快速检测的需求。
本研究以免疫检测方法为基础,首先通过抗体的表位竞争实验确定3株候选识别SEB抗原表位不发生交叉。基于此进行抗体两两配伍试验,以测试不同抗体配对的检测灵敏度。在双夹心酶联免疫实验中,将LXY10作为固定相捕获SEB,LXY8作为检测抗体是最优的一组配对,检测限约为240 pg/mL。为了实现现场快速检测,本研究基于酶联免疫实验结果,进一步开展了胶体金检测试纸条的试制,同样将LXY10作为固定相,以胶体金标记的抗体LXY8来抓取待测抗原。实验结果表明,胶体金试纸条能够在5~10 min内完成样品的检测,且检测限约为2 ng/mL。国内外已报道的公开数据显示,双夹心ELISA检测方法的检测范围为 0.078~10 μg/mL[23],胶体金检测试纸条能够达到1 ng/mL[24]。本研究中这2种方法的检测限也达到了相当的水平。
综上所述,本研究建立了2种体外快速检测SEB的方法,可以实现对SEB的快速检测,2种方法均能开发成有效的检测试剂,可用于食品安全检测及生物安全防控。

