CaCO3和CaSO4·2H2O共同作用下Ca2+对C3A水化浆体固化氯离子性能的影响
郭明磊, 肖 佳, 王佳雷
(中南大学 土木工程学院, 湖南 长沙 410075)
氯离子侵蚀导致钢筋锈蚀并引起混凝土结构破坏,破坏程度与混凝土孔溶液中的自由氯离子量相关[1].外界环境侵入混凝土内部的氯离子一部分自由存在于孔溶液中,另一部分被水泥水化产物固化,被固化的氯离子没有破坏作用[2].混凝土的氯离子固化能力不仅与其自身组成有关,还受氯盐环境如阳离子类型等影响[3-5],例如常用的除冰盐有NaCl和CaCl2等,海洋环境中有Na+和Ca2+等阳离子存在.许多研究表明,无论是内掺[6-11]还是浸泡[6,10,12-22]氯盐,与NaCl相比,CaCl2提高了水泥水化产物[19-21]、水泥单矿浆体[12,22]、水泥浆体[6-7,13-16,22]、水泥砂浆[8-9]和混凝土[10-11,17-18]等的氯离子固化能力;阳离子为Na+时氯盐溶液或水泥基材料孔溶液的pH值提高,而为Ca2+时pH值降低[3-5].氯离子固化分为物理固化和化学固化两种,前者主要指水化产物C-S-H凝胶等通过物理吸附方式固化氯离子[4-5],后者指氯离子与水化铝酸盐生成含氯铝酸盐,如Ks(Kuzel’s salt, C3A·0.5CaCl2·0.5CaSO4·11H2O)和Fs(Friedel’s salt, C3A·CaCl2·10H2O)[5]等.Yuan等[5]总结认为Ca2+的作用与氯离子的吸附点和含氯铝酸盐的溶解性相关,对氯离子的物理和化学固化都有影响.Henocq[23]和Elakneswaran等[24]采用双电层理论解释了C-S-H凝胶吸附氯离子的能力,认为在碱性条件下,C-S-H凝胶的表层SiOH会进行电解形成SiO-,使其表面带有负电荷[23],能吸附溶液中的Na+和Ca2+等阳离子而形成阳离子吸附层,该层所带的正电荷只有部分被SiO-基团平衡,还有部分通过吸附阴离子如OH-和Cl-等中和.可以看出,一方面,因阳离子不同而使C-S-H凝胶表面形成的阳离子吸附层不同,其吸附Cl-的能力也不同(C-S-H凝胶对不同阳离子的吸附性为Ca2+>Cs+>K+>Na+[25]),即Ca2+比Na+更易吸附到C-S-H凝胶表面,提高表面正电荷,吸附更多的氯离子[22];另一方面,OH-和Cl-属于竞争吸附的关系[6],有研究[6,14]认为,水泥浆体的氯离子固化能力取决于氯盐溶液的pH值,两者呈线性负相关关系[14],Ca2+降低了溶液的pH值而提高了C-S-H凝胶的氯离子固化能力[14].
但是,有关Ca2+对氯离子化学固化的影响及机理存在一定的争议.Arya等[10]认为氯盐为NaCl时固化能力较低的原因是NaCl必须经过一个前置反应形成CaCl2才能与铝酸盐反应;Zhu等[18]认为Fs的溶解度与孔溶液的pH值相关,pH值越高则Fs的溶解越大,氯离子固化量越小;Suryavanshi等[9]提出了Fs的离子交换形成机理,认为OH-和Cl-竞争吸附到AFm化合物的主要层结构[Ca2(Al,Fe)(OH)6]+上,Ca2+会降低孔溶液的pH值,减少OH-的竞争程度,提高氯离子吸附量;Weerdt等[14]和Shi等[15-16]则认为对于水泥净浆,Ca2+主要提高了C-S-H凝胶的氯离子固化能力,对Fs的生成量影响不大,但对于掺石灰石粉和偏高岭土的水泥浆体,Ca2+促进了Fs的生成[15-16].有研究[26]指出,普通硅酸盐水泥浆体中C3A水化生成的AFm物相对氯离子的固化量约占总固化量的70%.为了更加明晰Ca2+对水泥基材料固化氯离子的作用,有必要进一步研究Ca2+对氯离子化学固化的影响及机理.石灰石粉作为混凝土矿物掺和料已得到广泛研究和应用,欧洲、澳洲、美国和中国等都已出台相应的标准规范[27],而目前有关石灰石粉对水泥基材料固化氯离子的影响研究较少,不利于正确分析掺石灰石粉混凝土的抗氯离子侵蚀性能,因此有必要研究CaCO3存在时C3A水化浆体的氯离子固化特性;另外,为了调节凝结时间,一般硅酸盐水泥中掺有石膏,在CaCO3和CaSO4·2H2O的共同作用下导致C3A的水化更加复杂,不仅影响其氯离子固化能力,而且受Ca2+的影响也不同[16],而这方面的研究还较为匮乏.为此本文采用平衡法[15],研究了CaCO3和CaSO4·2H2O共同存在时Ca2+对C3A水化浆体的氯离子固化能力、生成产物和氯盐溶液pH值的影响,并分析了氯离子固化和氯盐溶液pH值变化的机理,以期为研究石灰石粉和石膏对水泥基材料氯离子固化性能的影响提供理论基础.
1 原材料和试验方法
1.1 原材料
分析纯CaCO3、Al2O3、CaSO4·2H2O、NaCl、NaOH和Ca(OH)2;去离子水.
C3A制备:用分析纯CaCO3和Al2O3按3∶1的摩尔比混合均匀,盛放于铂金坩埚并置于马弗炉中在1400℃下煅烧;取出后粉磨,再放入炉中烧制,如此反复进行,直至其中的游离氧化钙(f-CaO)质量分数低于1%.
1.2 试验方法
1.2.1试样制备
按照表1所示配合比制备浆体,经高速搅拌均匀后置于容积为100mL、质量为mb的圆柱形塑料瓶中,密封并用塑料薄膜包裹后,继续低速旋转24h以保持瓶中浆液不分离,然后置于标准条件下养护1个月;将塑料瓶中的浆体压碎并在常温下真空干燥2个月,干燥浆体与瓶子的总质量为md.干燥浆体经玛瑙研钵研磨后,过400m筛制得浆体粉末.称取5g浆体粉末置于100mL的塑料瓶中,加入 50mL 氯盐溶液(组成见表2),然后在20℃条件下密封存储在含有碱石灰的容器中,定时摇动;浆体粉末在氯盐溶液中浸泡2个月后,用布氏漏斗将悬浮液进行固液分离,溶液用于氯离子浓度和pH值测定,固体用异丙醇终止水化后,经真空干燥后粉磨制得待测试样.

表1 试验配合比

表2 氯盐溶液组成
1.2.2测试方法
溶液氯离子浓度采用电位滴定法测定,每份溶液进行3次滴定.pH值测定采用PHS-3C型台式数显精密pH计,精度为0.01pH.XRD分析采用日本理学D/max2500型X射线衍射仪.
1.2.3氯离子固化能力计算
浆体的氯离子固化能力通过定量测定氯盐溶液平衡前后的氯离子浓度变化得到,可表示为:
Ap=(Ci×Vi-Ce×Ve)×M(Cl-)/ms
(1)
式中:Ap为单位质量浆体的氯离子固化量,mg/g;Ci、Ce分别为氯盐溶液初始和平衡后的氯离子浓度,mol/L;Vi、Ve分别为氯盐溶液初始和平衡后的体积,Vi为50mL,Ve通过测定平衡过程中损失的氯盐溶液质量对Vi进行修正得到,本试验50mL氯盐溶液中水的平均质量损失为0.05g,因此Ve为49.95mL;M(Cl-) 为氯的摩尔质量,g/mol;ms为平衡试验中加入的浆体粉末量,5g.
C3A水化浆体干燥后损失的只有水,故干燥浆体中C3A的质量与试样制备时加入的C3A质量一致,则未水化C3A的氯离子固化能力可通过干燥浆体质量和试样制备时加入的C3A质量对Ap进行变换得到,计算式为:
Ac=[Ap×mp×M(C3A)]/[m(C3A)
×M(Cl-)×1000]
(2)
式中:Ac为单位摩尔未水化C3A的氯离子固化能力,mol/mol;mp为干燥浆体质量,mp=(md-mb);M(C3A)为C3A的摩尔质量,g/mol;m(C3A)为浆体成型时加入的C3A质量,g.
2 试验结果与分析
2.1 pH值

图1 C3A水化浆体在氯盐溶液中平衡后的溶液pH值Fig.1 pH values of chloride solutions after equilibrium for hydrated C3A pastes blended with CaCO3 and CaSO4·2H2O
图1为CaCO3和CaSO4·2H2O单独或共同存在时 C3A 水化浆体在氯盐溶液中平衡后的溶液pH值变化.由图1可见:平衡后溶液的pH值都有提高;CaCO3与CaSO4·2H2O都使得溶液pH值的提高程度降低,且相同摩尔比下CaSO4·2H2O对溶液pH值提高程度的降低效果较CaCO3明显; CaCO3和CaSO4·2H2O共同作用对溶液pH值提高程度的降低效果更为明显;n(CaCO3)/n(C3A)越大,平衡溶液pH值的提高程度越低.对比溶液2和溶液3的pH值可知,Ca2+存在时,溶液pH值的提高程度明显降低.
2.2 氯离子固化能力
图2为CaCO3和CaSO4·2H2O单独或共同存在时Ca2+对C3A水化浆体和未水化C3A氯离子固化能力的影响.由图2可见:CaCO3与CaSO4·2H2O都降低了C3A水化浆体的氯离子固化能力,相同摩尔比下CaCO3的降低效果更明显;n(CaCO3)/n(C3A)越大,降低程度越大,但n(CaCO3)/n(C3A)为0.5和1.0的差别较小;当CaCO3和CaSO4·2H2O共同存在时,C3A水化浆体的氯离子固化能力大幅度降低.


图2 存在CaCO3和CaSO4·2H2O时Ca2+对C3A水化浆体和未水化C3A氯离子固化能力的影响
对比溶液1和溶液2的Ap值可知,是溶液pH值的降低导致了C3A水化浆体的氯离子固化能力降低.比较溶液2和溶液3的Ap值可知,虽然Ca2+使得平衡溶液的pH值降低,但明显提高了C3A水化浆体的氯离子固化能力,且C3A水化浆体的组成不同,Ca2+提高其氯离子固化能力的程度也不同.试样PA、 PA· C0.25、PA·C0.50、PA· C1.00、PA·S1.00和PA·C1.00·S1.00在溶液3中单位摩尔C3A的氯离子固化能力较在溶液2中分别提高了8.67%、10.46%、28.92%、31.51%、25.23%和16.09%,说明CaCO3与CaSO4·2H2O都能提高C3A水化浆体的氯离子固化能力,但相同摩尔比下 CaCO3的作用更明显,且n(CaCO3)/n(C3A)越大,提升作用越大;CaCO3和CaSO4·2H2O共同存在时,Ca2+提高C3A水化浆体氯离子固化能力的效果却比两者单独存在时低,出现负协同作用.此外,CaCO3与CaSO4·2H2O都使得 C3A 水化浆体的氯离子固化能力受Ca2+的影响大于受溶液pH值的影响,且CaCO3掺量越大,作用越明显.
2.3 氯离子固化产物和机理分析
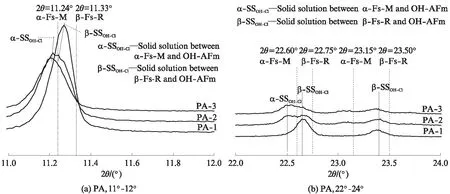
图3为CaCO3和CaSO4·2H2O单独或共同存在时, C3A 水化浆体浸泡氯盐溶液之前及其在3种氯盐溶液中平衡之后物相变化的XRD图谱,分析结果如 表3 所示.由表3可见:C3A的水化产物是 C3AH6;CaCO3单独存在时与C3A反应生成碳铝酸钙水化物:半碳铝酸钙(C3A· 0.5CaCO3· 0.5Ca(OH)2·11.5H2O)和单碳铝酸钙(C3A· CaCO3·11H2O),随n(CaCO3)/n(C3A)增大,C3AH6减少,生成的碳铝酸钙水化物类型发生变化,半碳铝酸钙只在n(CaCO3)/n(C3A)=0.5时生成,残留的微量CaCO3是由于其溶解度较低、反应不充分导致;CaSO4·2H2O与C3A反应生成了单硫型硫铝酸钙(C3A·CaSO4·12H2O),但同时存在CaCO3时,主要生成了单碳铝酸钙和钙矾石(C3A·3CaSO4· 31H2O),说明CaCO3使得硫酸根更多地形成为钙矾石.
经氯盐溶液浸泡后,试样中的C3AH6、碳铝酸钙水化物和单硫型硫铝酸钙的含量降低,都生成了层间距d在0.79nm附近的产物,为含氯铝酸盐(chloride-bearing AFm phases,含氯AFm物相的统称).Fs是最常见的含氯铝酸盐,分析表3可知,C3AH6[4,28]、半碳铝酸钙[14]、单碳铝酸钙[14,16]和单硫型硫铝酸钙[14,29-31]固化氯离子生成Fs的反应分别为:

(3)



图3 CaCO3和CaSO4·2H2O单独或共同存在时C3A水化浆体浸泡氯盐溶液前后物相变化的XRD图谱Fig.3 XRD patterns of phases assemblage for hydrated C3A pastes blended with CaCO3 and CaSO4·2H2O before and after immersion in chloride solutions

表3 CaCO3和CaSO4·2H2O单独或共同存在时C3A水化浆体浸泡氯盐溶液前后的物相组成
Note:HG is hydrogarnet(C3AH6);Mc is monocarboaluminate;Hc is hemicarboaluminate;C is CaCO3;Ms is monosulfoaluminate;E is ettringite;α-SSCl-OHis solid solution between α-Fs-M and OH-AFm;β-SSCl-OHis solid solution between β-Fs-R and OH-AFm;M-SSCl-CO3is monoclinic solid solution between Fs and CO3-AFm;R-SSCl-CO3is rhombohedra solid solution between Fs and CO3-AFm;AH is Al(OH)3.

(4)

(5)

(6)
钙矾石的结构较为稳定,许多研究[20,29,32]认为其不会与氯离子发生化学反应,无法化学固化氯离子,而且虽然能够物理吸附氯离子,但吸附能力较弱[20,24];同时有文献认为高浓度氯离子会导致钙矾石分解,生成Fs和石膏,从而固化氯离子[33-34].分析图3(f)可知,氯离子浓度为0.50mol/L时,钙矾石并没有与氯离子发生反应,故试样PA·C1.00·S1.00的氯离子固化能力较低.
Ca2+存在时,反应式(3)~(6)分别变为[4,14,16,28,30]:

(7)

(8)

(9)

(10)
Ca2+使得C3AH6、碳铝酸钙水化物和单硫型硫铝酸钙更容易结合氯离子生成Fs[16].在CaCO3和CaSO4·2H2O共同存在时,各水化产物提高氯盐溶液pH值的能力由小到大为:钙矾石<单硫型硫铝酸钙<单碳铝酸钙<六水铝酸三钙(C3AH6);单位摩尔水化产物的氯离子固化能力由小到大为:钙矾石<碳铝酸钙水化物<单硫型硫铝酸钙<六水铝酸三钙(C3AH6);Ca2+对单位摩尔水化产物的氯离子固化能力提高效果由小到大为:钙矾石 虽然水泥基材料固化氯离子时,NaCl导致氯盐溶液或孔溶液的pH值提高,而CaCl2降低溶液pH值这一结论已得到普遍认同,但是相关机理并不明确[14].Weerdt等[14]研究认为溶液pH值提高可能与氯离子固化导致铝酸盐的组成变化相关.根据反应式(3)~(6)可知,C3AH6、半碳铝酸钙、单碳铝酸钙和单硫型硫铝酸钙固化氯离子时会释放OH-,这是氯盐为NaCl时导致溶液pH值升高的原因[4,14,16,28];Ca2+存在时,发生如式(7)~(9)的反应,此时不会释放OH-,从而解释了图1中Ca2+存在时导致溶液pH值提高程度降低的原因.因此,氯盐为CaCl2时导致溶液pH值降低的原因一方面是由于C-S-H凝胶吸附Ca2+并释放H+[16,24],另一方面是Ca2+使得氯离子化学固化而不会释放OH-. Renaudin等[45]指出,Fs存在α-Fs-M(低温单斜晶系,d=0.79nm)和β-Fs-R(高温三方晶系,d=0.78nm)2种晶型,转变温度为35℃左右[43].Fs中部分Cl-被OH-[40]或CO3[43]替代形成固溶体时,由单斜晶系向三方晶系转变的温度降低,如AFm- [Cl0.75·(CO3)0.125]-25℃的转变温度为-15℃[43],故在常温下Fs与OH-AFm或CO3-AFm间固溶体存在2种类型.Hobbs[42]研究了铝酸钙在具有足够氯离子和氢氧根的溶液中生成的固溶体α-SSOH-Cl和β-SSOH-Cl;目前大部分研究认为OH-AFm(d=0.80nm)和α-Fs-M间的α-SSOH-Cl层间距d=0.79~ 0.80nm[40,46],但对于OH-AFm(d=0.80nm)和β-Fs-R间β-SSOH-Cl(d=0.78~0.80nm)的研究较少. Mesbah 等[43]在常温下合成的固溶体SSCO3-Cl存在稳定的三方晶系和亚稳定单斜晶系2种类型. 为了便于分析图3所示的含氯铝酸盐类型和含量,特别针对图3中的AFm物相进行了分析,如 图4 所示.根据文献[45]对α-Fs-M和β-Fs-R进行注释,在此基础上对生成固溶体的类型[42-43]进行标定,分析结果也列于表3.对比其中溶液1和溶液2的组成可知,氯盐溶液pH值降低使得含氯铝酸盐的生成量减少,这与氯离子固化量减少的结论一致.很多研究得出氯盐溶液的pH值越低,水泥浆体氯离子固化能力越高的结论[4-5,14],这是由于在吸附到C-S-H凝胶表面阳离子吸附层[6]和[Ca2Al(OH)6]+夹层空间[9]时,OH-和Cl-存在竞争关系,故OH-越少则Cl-的吸附量越高,物理和化学固化量越高.但溶液中OH-的浓度影响着含氯铝酸盐的溶解度,以固溶体[Ca2Al(OH)6]Cl1-x(OH)x·(2+x)H2O为例,其电解可以表示为[41]: 图4 Ca2+对CaCO3和CaSO4·2H2O存在时C3A水化浆体固化氯离子产物AFm物相的作用Fig.4 Impact of Ca2+ on the AFm phases as chloride binding product of hydrated C3A pastes in presence of CaCO3 and CaSO4·2H2O (11) 因此,平衡溶液的pH值降低使得含氯铝酸盐的溶解度增大[47],生成量降低.分析表3中溶液2、3的组成发现,Ca2+会降低平衡溶液pH值,使含氯铝酸盐的溶解度增大,但生成量却十分相近,特别是掺有CaCO3的试样.这证实了Ca2+有助于C3AH6、碳铝酸钙水化物和单硫型硫铝酸钙与氯离子反应生成含氯铝酸盐,且对碳铝酸钙水化物的作用最为明显的推论,也解释了Shi等[16]得出的Ca2+提高了掺石灰石粉和偏高岭土水泥浆体中Fs的生成量,对水泥净浆影响较小的结论. 碱性条件下,C3AH6固化氯离子生成固溶体SSOH-Cl,且溶液pH值和Ca2+都影响着生成SSOH-Cl的类型;CaCO3单独或与CaSO4·2H2O共同存在时, C3A 水化浆体固化氯离子并反应生成固溶体SSCO3-Cl,而不是SSOH-Cl或SSSO4-Cl,这是由于SSCO3-Cl的混溶范围极大,CO3极易取代Fs中Cl-[40],同时Ca2+改变了生成SSCO3-Cl的类型; CaSO4· 2H2O存在时,单硫型硫铝酸钙与氯离子反应生成了钙矾石,但没有SSSO4-Cl生成,而是生成了SSOH-Cl,这与SSSO4-Cl混溶范围有限相关[30].Ca2+虽没有提高C3A水化浆体中固溶体的生成量,但却使其氯离子固化能力明显增大,这与Ca2+改变了生成固溶体的类型相关.氯离子固化量的大小不仅与固溶体的生成量有关,还应与生成的固溶体中氯的比例,即x、y和z的大小相关. (1)C3A水化浆体固化氯离子后生成含氯铝酸盐并释放OH-,提高了氯盐溶液的pH值;CaCO3与CaSO4·2H2O单独作用都会降低C3A水化浆体的氯离子固化能力和氯盐溶液pH值的提高程度,CaCO3和CaSO4·2H2O共同作用则会显著降低 C3A 水化浆体的氯离子固化能力. (2)氯盐溶液pH值降低导致C3A水化浆体中含氯铝酸盐生成量和氯离子固化能力降低;Ca2+降低了氯盐溶液pH值的提高程度,但提高了C3A水化浆体的氯离子固化能力,CaCO3或CaSO4·2H2O单独存在能使Ca2+提高C3A水化浆体氯离子固化能力的效果更为显著,且CaCO3比CaSO4·2H2O的作用更加明显,但CaCO3和CaSO4·2H2O共同存在时出现了负协同作用. (3)在CaCO3和CaSO4·2H2O共同作用下,Ca2+促进各水化产物与氯离子反应生成含氯铝酸盐的效果由小到大为:钙矾石




3 结论

