外源环腺苷酸对玉米叶片和根系中酶含量和活性的影响以及差异蛋白分析
陈宁, 杜晗蔚, 杨少玉, 赵玉龙, 袁明慧, 石育蕾, 胡秀丽
(河南农业大学生命科学学院,河南 郑州 450002)
在玉米生长发育过程中,温度是极其重要的气象因子,适宜的环境温度是玉米获得高产所必需的先决条件之一。温度过低或过高都会对玉米的生长发育造成不良影响[1-2]。近年来,随着全球气候不断变暖,中国玉米主产区高温天气频发,使得玉米生产受到十分严重的危害。高温胁迫会对玉米的生长、发育、生理过程和产量等各个方面产生不利影响[3]。植物适应胁迫最早是感知胁迫并激起包括胁迫基因表达在内的多种生理和代谢反应信号转导途径[4]。在这些被调控的生理和代谢反应中,热休克蛋白(Heat shock protein)、环腺苷酸(Cyclic adenosine monophosphate,CAMP)、钙/钙调蛋白(Calcium / Calmodulin)以及抗氧化防护系统等起着重要的调节作用[5-7]。在高等植物中,cAMP由腺苷酸环化酶(Adenylate cyclase)催化合成,作为许多信号途径中的关键组分参与了很多生理反应,包括对生物和非生物胁迫的响应[8]。cAMP为细胞中的第2信使。对蚕豆叶片的研究显示,cAMP通过参与ABA调控的K+通道影响了气孔运动[9]。对拟南芥的研究显示,叶片中的cAMP在接种病原体后含量上升,同时伴随着细胞质内的Ca2+浓度升高,说明cAMP可能是通过调节细胞内Ca2+浓度变化,进而产生对病原菌的免疫应答[10]。研究显示,高温胁迫条件下,在镰刀霉菌(Fusariumverticillioides)腺苷酸环化酶缺失突变体中sHSP26基因表达增加,同时也增加了对高温胁迫的耐性[11]。利用细胞可渗透性的外源cAMP预处理血管平滑肌,显著抑制HSP27的积累[12]。但在高等植物体内,cAMP是否参与了高温诱导的HSPs的表达不清楚。本试验以郑单958为试验材料,用100 μmol·L-18-Br-cAMP预处理玉米植株,再进行高温胁迫处理,测定过氧化氢酶(H2O2)、丙二醛(MDA)含量、抗氧化防护酶活性和玉米叶片蛋白组的变化,以此来阐述环腺苷酸(cAMP)对高温胁迫的响应机制。
1 材料与方法
1.1 试验材料和胁迫处理
以玉米品种郑单958为试验材料。用质量分数为0.2%的次氯酸钠对玉米种子表面消毒10 min,蒸馏水缓慢冲洗,将种子放入蒸馏水中浸种8 h,平铺在潮湿的滤纸上,在28 ℃条件下催芽,其间保持滤纸湿润。发芽后选取萌发一致的种子种在盛有Hoagland营养液做培养介质的光照培养箱中培养。光照培养箱中的光合作用有效辐射为400 μmol· m-2·s-1,光周期为14 h/10 h(昼/夜),相对湿度为(75 ± 5)%,温度为28 ℃/22 ℃(昼/夜),每天更换一次营养液。当第1片叶片完全展开时,对幼苗进行胁迫处理。
把长势一致的幼苗平均分为4个处理(对照组,高温处理组,外源环腺苷酸预处理后的对照组,外源环腺苷酸预处理后进行高温处理组)。对照组的幼苗仍维持在28 ℃和相对湿度75%中,加与外源环腺苷酸等量的蒸馏水作对照。高温处理组,加与外源环腺苷酸等量的蒸馏水作对照,胁迫处理过程是将温度从28 ℃起每小时升高2 ℃至42 ℃,并在42 ℃维持8 h。外源环腺苷酸预处理后的对照组是用100 μ mol·L-1的8-Br-cAMP预处理5 h,一直维持在28 ℃和相对湿度75%中。外源环腺苷酸预处理后进行高温处理组是用100 μ mol·L-1的8-Br-cAMP预处理5 h,再进行胁迫处理。处理后,把玉米幼苗第2片叶片放在液氮中迅速冷冻,并在-80 ℃下保存备用。
1.2 主要试剂
pH 4~7,11 cm,非线性IPG预制凝胶条、硫脲、考马斯亮蓝R-250、碘乙酰铵、矿物油购自美国GE公司;DNA相对分子质量标准、蛋白相对分子质量标准购自天根生化科技(北京)有限公司;Tris-碱、十二烷基磺酸钠(SDS)、Tris饱和酚均购自Solarbio公司;0.5 mol·L-1Tris-HCl pH 6.8,1.5 mol·L-1Tris-HCl pH 8.8购自上海生工;丙酮、磷酸、乙醇、甲醇、乙酸、甘油、乙酸铵等其他试剂均为国产。
1.3 常用仪器
Nanodrop分光光度计购自美国Thermo公司,双向电泳仪Ettan III system购自美国GE Healthcare,紫外分光光度计UV-2550购自日本岛津,台式高速冷冻离心机3-18K购自德国Sigma,图像分析软件PDQUEST7.1.0,QUANTITY ONE4.62购自美国BLO-RAD,垂直电泳仪购自北京六一,水平摇床TS-1购自海门麒麟,质谱仪100-24-VAC来自GE Healthcare。
1.4 常用试剂的配制
Hoagland营养液:472.34 mg·L-1Ca(NO3)2.4H2O,160.21 mg·L-1MgSO4·7H2O,130.69 mg·L-1K2SO4,37.224 mg·L-1EDTA-Na2,34.022 mg·L-1KH2PO4,27.802 mg·L-1FeSO4·7H2O,7.456 mg·L-1KCl,0.288 mg·L-1ZnSO4·7H2O,0.169 mg·L-1MnSO4·H2O,0.062 mg·L-1H3BO3,0.025 mg·L-1CuSO4·5H2O,0.006 mg·L-1(NH4)6MO7O24·4H2O。
pH 7.8的0.1 mol·L-1K3PO4缓冲液:90.8 mL 1 mol·L-1K2HPO4,9.2 mL 1 mol·L-1KH2PO4,蒸馏水定容至1 L。
10%TCA/丙酮:称取10 g TCA,用冰丙酮(-20 ℃)定溶于100 mL,-20 ℃保存。
蛋白水化液:6 mol·L-1尿素,2 mol·L-1硫脲,65 mmol·L-1DTT,4% CHAPS,0.2% Bio-Lyte。
平衡液A:50 mmol·L-1Tris-HCl pH 8.8,6 mol·L-1尿素,30%甘油,2% SDS,0.002%溴酚蓝和1% DTT。
平衡液B:50 mmol·L-1Tris-HCl pH 8.8,6 mol·L-1尿素,30%甘油,2% SDS,0.002%溴酚蓝,2.5%碘乙酰胺。
1.5 不同处理条件下抗氧化保护酶活性的测定
1.5.1 H2O2含量的测定 采用KI法[13]测定H2O2含量。
1.5.2 MDA含量的测定 采用硫代巴比妥酸显色法[14]测定丙二醛含量。
1.5.3 抗坏血酸过氧化物酶(APX)含量的测定 采用NAKANO等[15]的方法测定APX含量。
1.6 蛋白质的提取及含量测定
称取0.5 g的玉米叶片在液氮预冷的研钵中,用研磨棒迅速研磨成粉末,直至呈白绿色,加10% TCA-丙酮,充分混匀,在-20 ℃静置2 h,或者过夜。4 ℃,12 000×g离心15 min,弃上清液,用丙酮清洗沉淀2~3次,至上清液为无色,沉淀于通风橱中晾干。在沉淀中加入约70 μL蛋白质水化液,振荡混匀,在水平摇床上孵育2 h左右,放入台式高速冷冻离心机中,4 ℃,12 000×g离心10 min,取上清液(若混浊,则重复1次),保存于-20 ℃备用[16]。采用BRADFORD法测定蛋白质的含量[17]。
1.7 双向电泳检测
2-DE采用WANG等[18]的方法。将800 μg的样品溶于200 μL水化液,采用pH 4~7的11 cm线性IPG预制胶条进行第一向等电聚焦。等电聚焦后,将IPG胶条放入平衡液A中平衡15 min后,再放入平衡液B中平衡15 min。然后进行第二向SDS-PAGE,分离胶体积分数为13.5%。电泳后,先用固定液进行固定,然后用染色液染色4 h,最后脱色。试验重复3次。
1.8 MALDI-TOF质谱分析
利用基质辅助激光解吸电离/飞行时间(Matrix-assisted laser desorption ionization time-of-flight mass spectrometry)质谱分析待测定的双向电泳蛋白点。制备好的样品在质谱仪上采用反射模式分析的正离子谱测定,飞行管长2.7 m,离子源加速电压为20 kV,反射电压为23 kV,N2激光波长为377 nm,脉冲宽度为3 ns,离子延迟提取100 ns,质谱信号单次扫描累加50次,胰蛋白酶自切降解峰作为内部标准校正,获得肽质量指纹图谱(Peptide mass fingerprint)。
1.9 数据分析
将质谱测试原始文件用 Mascot 2.2 (Matrixscience,http:// www. matrix science.com)软件检索与相应的数据库进行匹配,最后得到鉴定的蛋白质结果。数据库一般选择物种接近的数据库,主要用NCBI(http://www.ncbi.nlm.nih.gov/)和SWISS-PROT(http://www.expasy.org/sprot/) 两大数据库,进行搜索分析。
2 结果与分析
2.1 外源cAMP处理对高温诱导的玉米叶和根中H2O2及MDA含量的影响
8-Br-cAMP是一种膜可渗透的cAMP类似物。为了确定cAMP在玉米植株耐高温胁迫条件下的作用,用100 μ mol·L-18-Br-cAMP预处理玉米植株后,再进行高温胁迫处理来研究外源cAMP对高温胁迫条件下H2O2,MDA含量的影响。结果显示,与对照相比,高温胁迫均显著增加了玉米叶片和根系中的H2O2和MDA含量,而8-Br-cAMP预处理显著降低了高温胁迫增加的玉米叶片和根系中的H2O2(图1-A和图1-C)和MDA(图1-B和图1-D)含量。这些结果表明cAMP预处理有助于提高玉米植株对高温的耐性。
2.2 外源cAMP处理增加了高温诱导的玉米叶片和根中的APX活性
为了进一步确定外源cAMP在高温胁迫条件下的作用,用100 μ mol·L-18-Br-cAMP预处理玉米植株,再进行高温胁迫处理后,对玉米叶片和根系中的抗氧化防护酶活性进行了测定。结果显示,与对照相比,高温胁迫显著增加了玉米叶片和根系中的APX活性,且8-Br-cAMP预处理促进了高温胁迫增加的玉米叶片和根系中的APX活性(图2)。这些结果表明, cAMP预处理可能通过提高玉米植株在高温条件下的抗氧化防护酶活性来清除ROS。

A.外源cAMP处理对高温诱导的玉米叶片H2O2含量的影响;B.外源cAMP处理对高温诱导的玉米根中H2O2含量的影响;C.外源cAMP处理对高温诱导的玉米叶片MDA含量的影响;D.外源cAMP处理对高温诱导的玉米根中MDA含量的影响。
100 μmol ·L-18-B-cAMP预处理玉米根部5 h,然后进行高温处理2 h,CK加蒸馏水作对照。图1-A,B,C,D中的数值均为6次重复测定的平均值±标准差(SD)。
A. Effect of exogenous cAMP treatment on H2O2content in corn leaves induced by high temperature; B. Effect of exogenous cAMP treatment on H2O2content in corn roots induced by high temperature; C. Effect of exogenous cAMP treatment on MDA content of corn leaves induced by high temperature; D. Effect of exogenous cAMP treatment on MDA content in maize roots induced by high temperature.
The maize roots were pretreated with 100 μmol·L-18-Br-cAMP for 5 h, then subjected to high temperature treatment for 2 h. CK plus distilled water was used as a control. The values in Figures A, B, C, and D are the mean±standard deviation (SD) of the 6 replicates.
图1 8-Br-cAMP预处理对高温诱导的玉米叶片和根中H2O2和MDA含量的影响
Fig.1 Effect of 8-Br-cAMP pretreatment on H2O2and MDA contents in maize leaves and roots induced by high temperature

A.外源cAMP处理对玉米叶片中的抗氧化保护酶活性的影响;B.外源cAMP处理对玉米根中的抗氧化保护酶活性的影响。
A. Effect of exogenous cAMP treatment on the activity of antioxidant protective enzymes in corn leaves; B. Effect of exogenous cAMP treatment on the activity of antioxidant protective enzymes in corn roots.
图2 8-Br-cAMP预处理对高温诱导的玉米叶片和根中抗氧化保护酶活性的影响
Fig.2 Effect of 8-Br-cAMP pretreatment on the antioxidant protective enzyme activity in corn leaves and roots inducedby high temperature
2.3 外源cAMP处理对高温诱导的玉米叶片中蛋白质组变化的影响
2.3.1 外源cAMP处理对高温诱导的玉米叶片中蛋白质组变化2-DE分析 经外源cAMP预处理后,进行高温胁迫诱导的玉米叶片蛋白质组变化(图3-C和图3-D)及其对照(图3-A和图3-B)用2-DE鉴定。在4个处理之间,差异表达的47个蛋白点具有至少1.5倍的丰度变化(表1)。与对照相比,胁迫引起29个蛋白点丰度增加大于1.5倍,4个蛋白点丰度下降超过1.5倍,14个蛋白点无显著变化(图3-A和图3-B)。高温胁迫条件下,与无外源cAMP预处理的相比,外源cAMP引起12个蛋白点的丰度增加,27个蛋白点的丰度下降,8个蛋白点无显著变化(图3-B和图3-C)。

A.对照;B.高温;C.8-Br-cAMP;D.8-Br-cAMP+高温。
100 μmol·L-18-Br-cAMP预处理玉米根部5 h,然后高温胁迫处理4 h,在相同条件下用蒸馏水处理玉米根部作为对照。试验重复3次,结果相似。显示了来自3个独立试验的代表性的CBB染色凝胶。蛋白质上样量约800 μg.将差异表达的蛋白点(编号)的丰度(>2倍)进行质谱分析。
A. Control; B. High temperature; C. 8-Br-cAMP; D. 8-Br-cAMP + high temperature.
The roots of maize were pretreated with 100 μmol·L-18-Br-cAMP for 5 h, then treated with high temperature stress for 4 h. The corn roots were treated with distilled water under the same conditions as control. The experiment was repeated at least three times and the results were similar. Representative CBB stained gels from three independent experiments are shown. The protein loading was approximately 800 μg. Mass spectrometry was performed on the abundance (> 2 times) of the differentially expressed protein spots (number).
图3 2-DE分析8-Br-cAMP预处理对高温胁迫下的玉米叶片蛋白表达的影响
Fig.3 2-DE analysis of the effect of 8-Br-cAMP pretreatment on protein expression in maize leavesunder high temperature stress
2.3.2 外源cAMP处理对高温诱导的玉米叶片中蛋白质组的鉴定 为了鉴定差异性蛋白,切取这47个蛋白点,并进行分析鉴定。根据KEGG分析,鉴定的47个蛋白主要参与了与代谢途径、碳代谢及光合作用有关的信号转导途径。对KEGG_Pvalue进一步分析显示,最显著的信号转导途径是光合作用途径(图4)。

表1 8-Br-cAMP预处理对高温胁迫下的玉米叶片中差异蛋白的鉴定

续表1
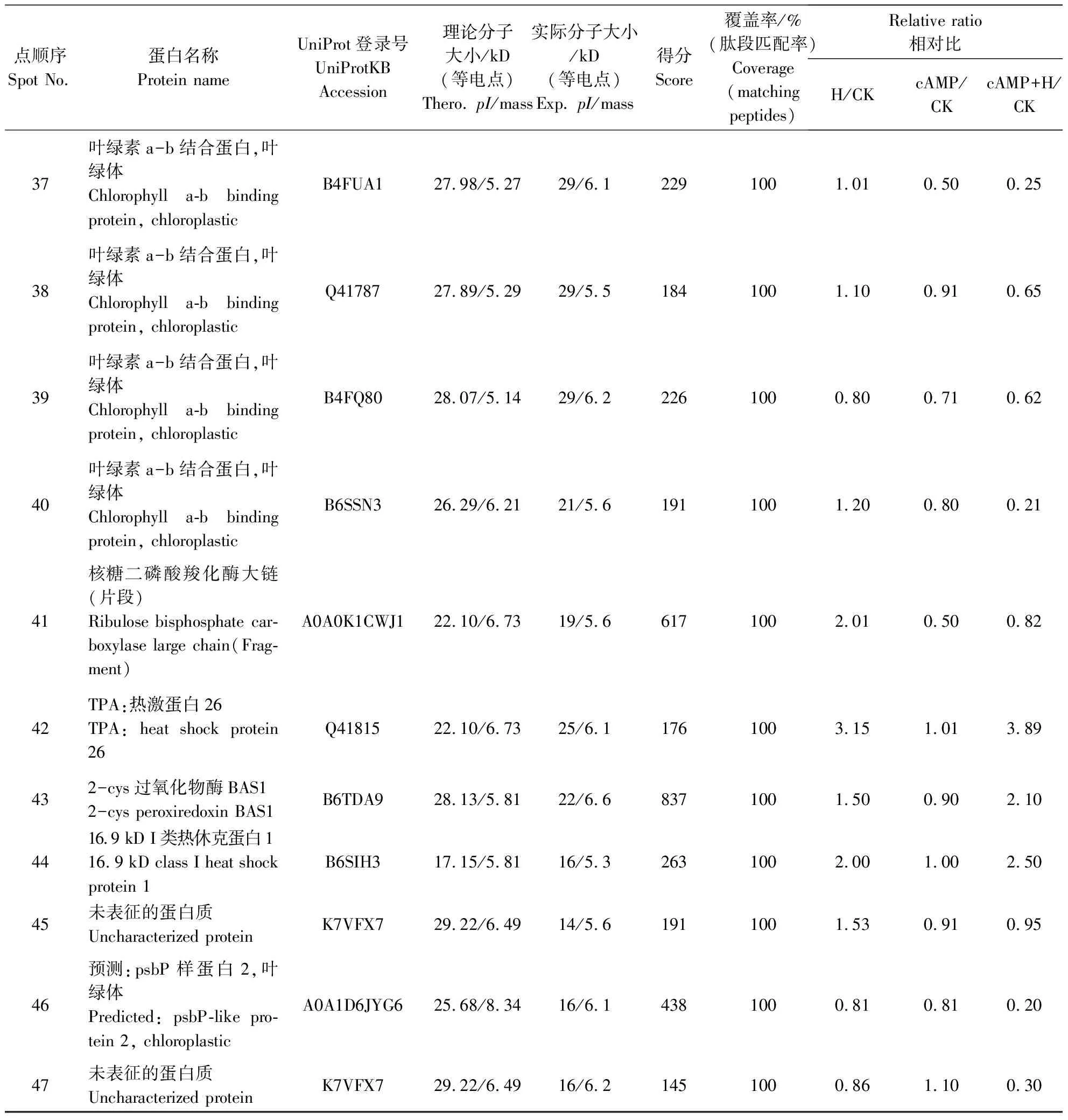
续表1
3 结论与讨论
3.1 外源cAMP处理降低了高温对玉米造成的氧化胁迫
H2O2是活性氧的一种,细胞内H2O2的过量积累,会导致细胞氧化损伤。丙二醛(MDA)是膜脂过氧化作用的产物之一,它在植物体内的积累是ROS毒害的表现[19],因此,MDA含量的多少可作为植物对逆境抗、耐性的间接指标。本研究表明,经8-Br-cAMP预处理后,在高温胁迫下玉米叶和根中MDA含量显著下降,显示了cAMP预处理有助于提高玉米植株对高温的耐性。
活性氧清除酶,包括SOD,APX等,植物对ROS清除能力,与其抗ROS伤害能力及抗逆性呈正相关。本研究表明,与对照相比,8-Br-cAMP预处理显著提高了高温胁迫增加的玉米叶片和根系中的APX活性。显示了cAMP预处理可能通过提高玉米植株高温条件下的抗氧化防护酶活性来清除ROS,从而提高了玉米植株对高温胁迫的耐性。

A.代谢;B.遗传信息处理;D.细胞过程;E.生物系统.A0.总览图;AA.碳水化合物代谢;AB.能量代谢;AC.脂质代谢;AE.氨基酸代谢;AF.其他氨基酸的代谢;AJ.其他次生代谢产物的生物合成;BA.转录;BC.折叠,分类和降解;DA.运输和分解代谢;EI.环境适应。
A.Metabolism;B.Genetic information Processing;D.Cellular Processes;E.Organismal Systems.A0.Global and overview maps;AA.Carbohyrate metabolism;AB.Enengy metabolism;AC.Lipid metabolism;AE.Amino acid metabolism;AF.Metabolism of amino acids;AJ.Biosynthesis of other secondary metabolites;BA.Transcription;BC.Folding sorting and degradation;DA.Transport and catabolism;EI.Environmental adaptation.

图4 根据KEGG分析在高温和cAMP处理下差异表达相关蛋白质的信号通路Fig.4 Signaling pathway for differential expression of related proteins under high temperature and cAMP treatment according to KEGG analysis
3.2 cAMP调控了高温胁迫下玉米相关蛋白的表达
在植物中,热损伤的主要指标之一是放氧复合体(OEC)和光合系统Ⅱ(PSⅡ)中的相关辅助因子及固碳作用中的Rubisco酶和ATP合成系统[20]。已有研究表明,在水稻和杨树中,高温胁迫显著增加了叶绿体ATP合酶CF1的α链[21]。叶绿体ATP合酶是一种F-型ATP合酶,在植物中容易受到ROS的影响,能够降低ATP水解与合成。在本研究中,高温胁迫增加了ATP合酶ɑ亚基(点2,3,8,9)的表达,且外源cAMP预处理后,同样增加了高温胁迫下ATP合酶ɑ亚基表达,表明高温胁迫下cAMP可能保护了ATP合酶的活性。此外,与对照处理相比,在高温胁迫下,8-Br-cAMP预处理和8-Br-cAMP预处理加高温中叶绿素a-b结合蛋白的表达量依次降低(点36,38,39,41,42),说明cAMP保护了叶绿素a-b结合蛋白。
核酮糖二磷酸羧化酶的蛋白水解在植物胁迫条件下起重要的应答作用。本研究结果表明,核酮糖二磷酸羧化酶大亚基(点1,13,43)在玉米高温胁迫条件下表达量增加,在cAMP预处理后的表达量与对照相比明显增加,cAMP预处理后高温比高温胁迫下的表达量增加,从而在高温胁迫下稳定地发挥着合成代谢水平的调节作用。
综上所述,cAMP能减缓高温对玉米造成的氧化胁迫,而且对差异蛋白分析显示,cAMP和高温胁迫处理影响最显著的生物学过程是光合作用过程,细胞组分是位于叶绿体组分,分子功能是与光合作用有关的生理功能。

