Toll样受体3激动剂在疫苗佐剂中的应用进展
曹晓亚, 徐福洲, 郭杰, 温彤, 苏霞, 周宏专, 杨兵, 崔一芳,郭芳芳*
1. 北京市农林科学院畜牧兽医研究所,畜禽疫病防控技术北京市重点实验室,北京 100097;2. 包头师范学院生物科学与技术学院,内蒙古 包头 014030
在人类对抗疾病的漫长历史中,疫苗发挥着不可替代的作用。从18世纪爱德华·琴纳医生通过接种牛痘预防天花,到现在大力研发应用于不同疾病领域的疫苗,疫苗的发展也是人类医疗水平不断提高的重要体现。传统的病毒疫苗主要是减毒疫苗或者灭活病毒疫苗,此类疫苗可引起宿主的强烈免疫应答,具有较好的免疫效果,但其抗原成分复杂、具有潜在的致病风险,易引发疾病[1]。因此,为了提高疫苗的安全性,避免因减毒疫苗恢复毒力引发潜在风险或灭活病毒疫苗引起机体不良反应,基于多肽或小分子蛋白质的第二代亚单位疫苗问世并迅速发展[2]。
大多数威胁人类的传染病(禽流感、沙门氏菌、狂犬病等)都是人畜共患病,这些疾病通过多种传播方式从动物传播到人类[3]。因此,动物疫苗的开发具有重要的功能,即通过疫苗免疫保护动物来防止病原从动物传递到人类。对经济动物的免疫可有效降低抗生素和药物在畜牧业使用的总量,进而提升畜禽产品的品质,有效降低生产成本。但是开发安全高效的动物疫苗仍存在困难,传统矿物油佐剂由于价格低廉在动物疫苗中的使用十分广泛,但是其不宜降解,对动物的副作用较大同时对肉质也具有一定影响,在食品安全方面存在隐患。对于动物来说,新技术和佐剂的开发应用,在保护人类、提升动物福利和促进畜禽业发展等方面具有重要的意义。目前亚单位疫苗最大的缺点是免疫原性差,部分是半抗原,需与合适的佐剂偶联使用。较为经典的佐剂(如铝佐剂)主要激活Th2介导的免疫应答反应,而新型疫苗佐剂Toll样受体(Toll-like receptor,TLR)激动剂可同时激活Th1和Th3介导的免疫通路[4],其中,关于TLR3激动剂的研究最热,并被认为是最强的Th1诱导佐剂之一[5]。本文主要对TLR3及其激动剂的作用机制以及TLR3激动剂在疫苗佐剂中的应用进行综述,以期为安全、有效的动物疫苗的研制提供参考依据。
1 TLR及其激动剂
先天免疫是否健全取决于能否充分触发获得性免疫反应。在病原体感染早期,先天免疫首先被激活,由模式识别受体(pattern-recognition receptors,PRRs)识别病原体相关分子模式(pathogen associated molecular patterns,PAMPs)。根据存在形式的不同,可将PRR分为定位在膜上的膜型PRR(如清道夫受体、甘露糖受体、TLRs)和分泌性PRR(如C反应蛋白、脂多糖结合蛋白、甘露糖结合凝集素)[6-7]。其中,TLRs信号通路可通过激活多种信号转导途径以激活补体产生抗感染免疫;也可激活树突状细胞分泌大量Ⅰ型干扰素(IFNα/β);还可激活专职性抗原提呈细胞(如树突状细胞、单核/巨噬细胞、B细胞等)呈递抗原给T细胞,进而激活适应性免疫应答等[4]。
TLRs是Ⅰ型跨膜蛋白,主要由胞外区、跨膜区和胞内区3个部分组成,广泛分布在免疫细胞的质膜表面或内体上[5]。不同的TLRs胞外区同源性较差,但是各TLRs种属间差异较小,如人和鼠的TLR4的胞外结构域有53%的同源性,而胞内区域的种属同源性高达83%[8]。这一现象提示,TLRs是一组结构保守的大分子,具有相似的生物学功能。在没有配体(激动剂)结合的情况下,TLRs以单体形式或者以非紧密结合的二聚体形式存在;在TLRs与配体结合后,可形成稳定的二聚体并启动信号传导[9],这也暗示了TLRs配体可作为免疫调节剂,具有治疗潜力[10]。
目前已鉴定的TLRs有10~15种,其中人类有10种,而TLR1~TLR9普遍存在于从鱼类到人类的各种脊椎动物中。TLR1、TLR2、TLR4、TLR5、TLR6和TLR10主要表达在细胞表面,识别包括脂蛋白、肽聚糖、鞭毛蛋白等在内的病原体细胞膜成分;TLR3、TLR7/8和TLR9是细胞内受体,又被称为抗病毒TLRs,分别识别细胞内外源双链RNA(double-stranded RNA,dsRNA)、单链RNA和非甲基化DNA。TLR3表达于多种细胞,如髓样树突状细胞(dendritic cell,DC)、巨噬细胞、自然杀伤(nature kill,NK)细胞、神经细胞、成纤维细胞、内皮细胞、肥大细胞和上皮细胞[11];虽然TLR7也在髓样DC、NK细胞、巨噬细胞和肥大细胞中表达,但其在浆细胞样DC(plasmacytoid dendritic cell,pDC)、B细胞和T细胞中的表达量较高[12];与TLR7相似,TLR9也主要在人类记忆B细胞、NK细胞和pDC中表达[13]。一旦被同源配体激活,TLRs通过下游髓样分化因子88(myeloid differentiation primary response protein 88,MyD88)或含Toll/IL1受体(Toll-like/IL-1 receptor,TIR)结构域诱导β干扰素的接头蛋白(TIR-domain-containing adaptor inducing interferon-β,TRIF)启动复杂的信号级联,最终导致炎症基因的转录诱导[14]。
TLRs激动剂是强有力的免疫佐剂。一般来说,其主要佐剂作用是通过激活免疫细胞(如NK细胞)和抗原呈递细胞(如DC)发挥功能。在TLRs激动剂诱导DC成熟的过程中,主要组织相容性复合体-Ⅰ(major histocompatibility complex-Ⅰ,MHC-Ⅰ)和MHC-Ⅱ的上调以及共刺激标记物(如CD40、CD80和CD86)的诱导是DC成熟的标志。TLRs活化还导致免疫细胞分泌细胞因子,如诱导DC分泌白细胞介素12(interleukin-12,IL-12),NK细胞分泌干扰素γ(interferon-γ,IFN-γ)[10]。TLRs激动剂最终效应是诱导T细胞激活和其他特异性或一般适应性免疫反应[15]。表1是目前已上市的TLRs激动剂佐剂的相关信息。
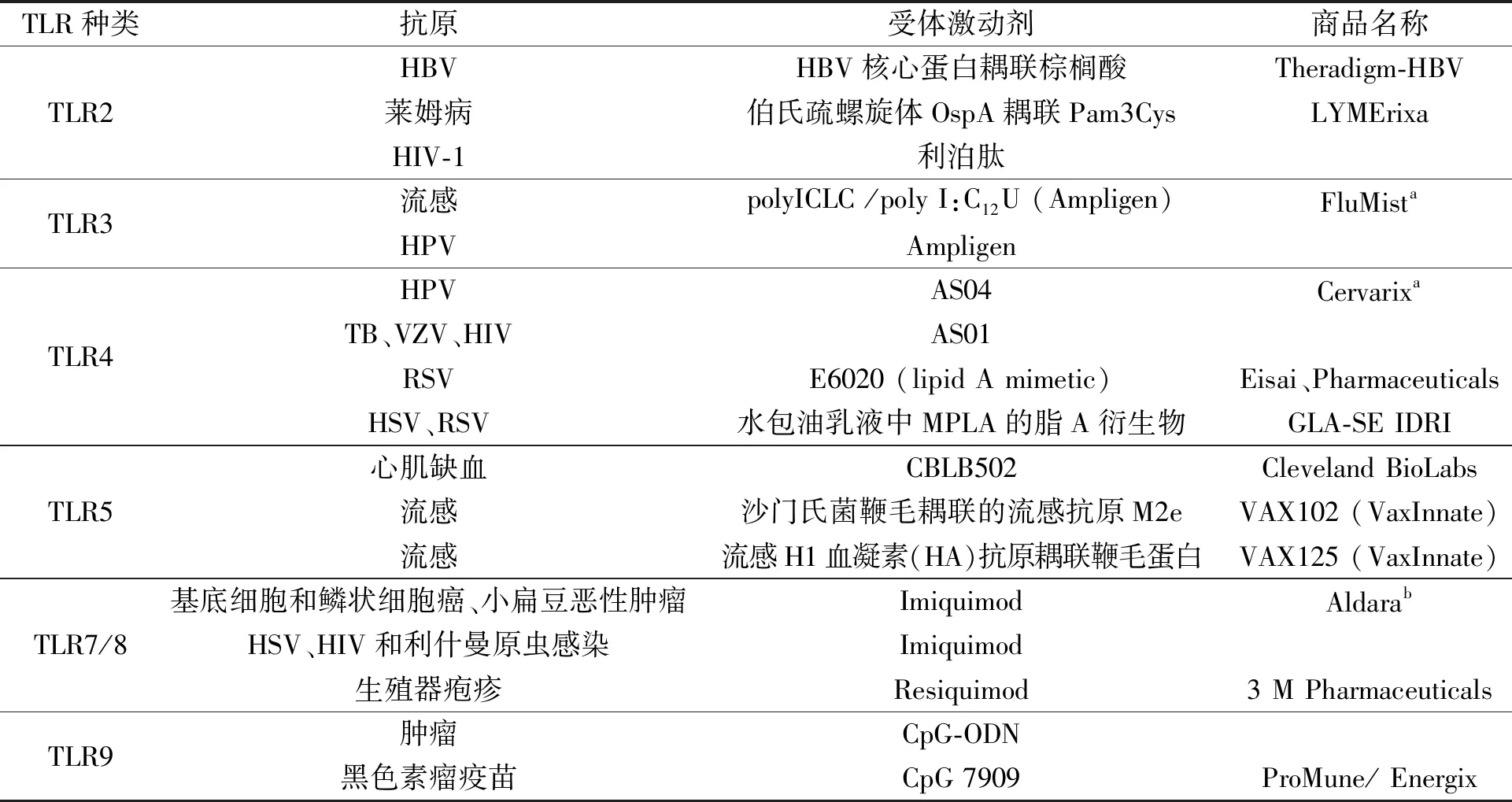
表1 TLRs激动剂在疫苗佐剂中的应用Table 1 The application of TLRs agonists in vaccine adjuvants
注:HBV:乙型肝炎病毒,hepatitis B virus;HIV:艾滋病病毒,human immunodeficiency virus;HPV:人乳头瘤病毒,human papillomavirus;TB:结核杆菌,tuberculosis;VZV:水痘-带状疱疹病毒,varicella-zoster virus;RSV:呼吸道合胞病毒,respiratory syncytial virus;HSV:单纯疱疹病毒,herpes simplex virus;a—临床使用的佐剂;b—用于HPV诱发的疣的局部治疗。
2 TLR3及其激动剂作用机制
与其他TLR不同,TLR3是唯一一种MyD88非依赖的TLR,其主要依赖TRIF。根据TRIF所激活的下游产物不同,可将TLR3介导的信号通路分为TRIF依赖的核转录因子(nuclear transcription factor-κB,NF-κB)通路和TRIF依赖的IFN-β通路。当外源dsRNA激活质膜上TLR3后,TRIF活化并分别与肿瘤坏死因子受体作用因子3(tumor necrosis factor receptor-associated factor,TRAF3)和TRAF6相互作用[11]。
在NF-κB通路激活的过程中,TLR3通过胞外亮氨酸重复(leucine-rich repeat,LRR)结构域识别dsRNA,引起胞内TIR结构域活化进而连接TRIF,TRIF通过N端与TRAF6结合并激活其活性。TRAF6与受体相互作用蛋白激酶1(receptor interacting protein kinase 1,RIPK-1)相互作用后激活转化生长因子激酶1(transforming growth factor β-activated kinase-1,TAK-1)(TLR信号通路中的关键分支点)[14]。TRIF还可以招募受体相互作用蛋白1(receptor-interacting protein-1,RIP-1),并与RIP-1和TRAF6结合形成TRIF-RIP-1-TRAF6复合物,复合体激活TAK-1进而引起Iκ-B激酶(inhibitor of nuclear factor kappa-B kinase,IKK)介导的NF-κB协同激活蛋白1(active protein-1,AP-1)和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路的激活[16]。在IFN-β信号通路中,TRIF激活TRAF3,进而激活IKK相关激酶,如TANK结合激酶1(TANK binding kinase 1,TBK1)、IKK i激酶(Iκ-B kinase-epsilon,IKK i)和核因子必要调节剂[nuclear factor (NF)-κB essential modulator,NEMO]等。IKK相关激酶催化干扰素调节因子3(interferon regulatory factor 3,IRF3)的羧基末端丝氨酸残基磷酸化,磷酸化的干扰素调节因子3(phosphorylated interferon regulatory factor 3,p-IRF3)形成二聚化后从细胞质易位至细胞核中,p-IRF3与干扰素刺激反应成分(IFN-stimulated response elements,ISRES)共同诱导IFN-β的转录和翻译。最新的研究发现,磷脂酰肌醇5-磷酸(phosphatidylinositol 5-phosphate,PI5P)可与IRF3和TBK1结合形成复合物,促进IRF3近TBK1端的磷酸化进而调节IRF3的活化[17]。TLR3信号通路如图1所示。

图1 TLR3信号通路Fig.1 Signal path of TLR3
TLR3激动剂主要是dsRNA,其在正常机体中是不存在的,只有特定种类的病毒复制时才会产生。当宿主细胞TLR3感应到dsRNA这一关键“危险信号”,宿主细胞就会反复提呈相应抗原,激活免疫细胞启动抗病毒免疫反应[18]。聚肌胞(Poly I:C)是人工合成的dsRNA复合物,作为一种TLR3激动剂,其可与TLR3结合,激活NF-κB和IFN-β前体,刺激相关免疫分子的表达,介导先天和适应性免疫应答,进而抗病毒感染。TLR3广泛表达于DC、T细胞、NK细胞及部分非免疫细胞中,这就表明Poly I:C具有作为疫苗佐剂的潜能[19]。需要注意的是,早期临床实验表明,Poly I:C作为疫苗佐剂,因其干扰素诱导效果差、无抗肿瘤活性、毒性高等缺点,应用一直受限[11]。
3 常用TLR3激动剂在佐剂中的应用
3.1 Poly I:C
Poly I:C作为病毒dsRNA的类似物,因其能够刺激Ⅰ型干扰素的分泌而被临床采用。此后,研究证实Poly I:C能激活DC和记忆T细胞的TLR3[19],从而引发对其在白血病和HIV等多种疾病中的潜在治疗作用的研究。然而,Poly I:C在一些患者中引起了严重的毒性副作用,包括休克、肾功能衰竭、凝血疾病和超敏反应,因此限制了Poly I:C在临床上的使用,但作为TLR3激动剂,Poly I:C在动物疾病疫苗中少量添加增强免疫效力的研究日益增多[20-21]。
Bardel等[21]研究发现,以Poly I:C为佐剂的HSV-2 gD亚单位疫苗抗原进行小鼠皮下免疫,可在小鼠阴道和粪便中诱导长效病毒特异性免疫球蛋白Ig-G和IgA抗体,保护小鼠免受致命性HSV-2攻击后引发的生殖器和神经相关症状。Thomas等[22]以Poly I:C为佐剂制成猪H1N1和猪H3N2双价灭活猪流感疫苗,鼻腔免疫疫苗后使抗原变异体MN08和异源NC10猪流感病毒感染的猪获得保护,结果提示,Poly I:C及其同系物可能是有效的疫苗佐剂,能在猪中产生针对抗原变异体/异源猪流感病毒的交叉保护性免疫。
国内关于Poly I:C作为疫苗佐剂的研究也较多。Wang等[23]以铝(Al)和Poly I:C为佐剂,与结核分枝杆菌抗原蛋白AEC制成新型结核分枝杆菌亚单位疫苗,结果显示AEC/Al/poly I:C免疫小鼠表现出明显的抗原特异性体液免疫应答和细胞免疫,并在潜伏结核分枝杆菌感染的豚鼠模型中证明了疫苗的保护作用。马立克氏病病毒(Marek’s disease virus,MDV)是一种α疱疹病毒,可引起鸡的免疫抑制和T淋巴瘤,研究发现,Poly I:C的预处理可以抑制MDV在鸡胚成纤维细胞(chick embryo fibroblasts,CEF)中的感染,提示Poly I:C或其他TLR3激动剂具有作为MDV疫苗佐剂的潜能[24]。
3.2 PIKA
PIKA也是一种TLR3激动剂,它是一种稳定的dsDNA结构,目前有较多研究显示PIKA可诱导机体的体液免疫和细胞免疫[25-26]。对于PIKA作为佐剂的研究最为深入的是PIKA狂犬病疫苗方面的研究,Zhang等[27]在评价PIKA狂犬病疫苗的有效性和安全性时发现,PIKA狂犬病疫苗可显著增强体液免疫和细胞免疫。在病毒攻击后,PIKA狂犬病疫苗组存活率能达到70%~80%,显著高于非佐剂疫苗组(对照组)(存活率为20%~30%)。同时,PIKA狂犬病疫苗在小鼠中表现出良好的耐受性,提示PIKA狂犬病疫苗是一种安全有效的疫苗,具有开发为下一代狂犬病疫苗的潜力。PIKA狂犬病疫苗和普通狂犬病疫苗的免疫原性和安全性的对比研究显示,PIKA狂犬病疫苗比普通狂犬病疫苗可引起更强的免疫原性反应,安全性和耐受性相当[28]。此外,在流感病毒H5N1亚单位疫苗的研究中,PIKA作为佐剂也表现出明显的效果[29]。
3.3 Poly ICLC
尽管Poly I:C在啮齿类动物的体内实验中具有较好的免疫原性,但在灵长类动物中,其诱导IFN-α表达的效果不佳,这很可能是与灵长类血清中表达较多的核酸酶有关,核酸酶的活性可能降低了Poly I:C的生物稳定性[30]。Poly ICLC为Poly I:C与聚赖氨酸和羧甲基纤维素的结合物,它对核酸酶的抵抗性是Poly I:C的5~10倍,在免疫原性方面也明显优于Poly I:C[15]。Poly I:C不能在猴子体内诱导干扰素的表达上调,但Poly ICLC在猴中可以诱导干扰素的上调。Poly ICLC可以引起Th1型免疫反应,诱导表达IL-12、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、IFN-γ和IL-6以及趋化因子Kc(Keratinocyte-derived chemokine,Kc)、单核细胞趋化蛋白1(monocyte chemoattractant protein 1,MCP1)、巨嗜细胞炎症蛋白1α(macrophage inflammatory protein-1α,MIP-1α)和巨噬细胞炎性蛋白1β(macrophage inflammatory protein-1β,MIP-1β)[31]。Poly ICLC在猴子和黑猩猩中对各种病毒都具有抗病毒特性,还可以抑制猕猴的疟疾感染[32]。此外,在感染委内瑞拉马脑脊髓炎病毒和猪流感病毒的非人灵长类动物模型中,Poly ICLC在诱导体液免疫反应上显示出强有力的佐剂活性[33]。
最近的研究表明,在小鼠黑色素瘤、肺癌和结肠癌模型中,即使在没有任何疫苗抗原的情况下,Poly ICLC和抗程序性死亡配体1(programmed death ligand 1,PD-L1)之间的显著协同作用也表现出明显的抗肿瘤特性[34]。目前这种协同作用的机制仍在研究,但可能与Poly ICLC诱导的细胞毒性T淋巴细胞(cyto-toxic lymphocyte,CTL)共刺激因子(如OX40和CD40)相关。近期,Saxena等[35]的研究发现,Poly ICLC可以安全地用于诱导治疗HIV(+)受试者的一过性先天免疫反应,表明Poly ICLC有望作为HIV治疗性疫苗的佐剂。与之类似的是,Poly ICLC在严重急性呼吸系统综合症冠状病毒(SARS-CoV)感染小鼠模型中也取得了较好的效果,在以致死剂量SARS-CoV感染小鼠8 h后,以剂量为5 mg·kg-1·d-1的Poly ICLC干预,可以保护感染的小鼠100%免于死亡,这说明Poly ICLC对SARS-CoV感染小鼠有实质性的预防和保护作用,具有类似病毒治疗的前景[36]。然而,在儿童和成人中进行的一系列Ⅰ和Ⅱ期研究中发现,Poly ICLC具有剂量依赖性的轻中度副作用[33]。
3.4 PolyIC12U
PolyIC12U是一种Poly I:C类似物,它是在Poly I:C聚C链上平均每12个胞苷酸的核糖残基插入1个不配对的碱基尿嘧啶[33]。PolyIC12U结构特点解决了Poly I:C的毒性问题,因为其分子骨架的错配降低了其结构稳定性,其与细胞接触5 min内就会被核酸酶降解。在免疫原性方面,PolyIC12U可激活TLR3信号,但不激活黑色素瘤分化相关基因5(melanoma differentiation-associated protein 5,MDA-5)信号;可激活IFN的表达,但激活水平低于Poly I:C[37]。体外研究证实了PolyIC12U通过上调MHC Ⅰ/Ⅱ类分子、CD40、CD83、CCR7和CD86等分子水平而诱导DC的功能成熟,可上调炎性细胞因子(Th1型)IL-2的产生,抑制抗炎细胞因子IL-10的表达[38]。
在佐剂研究方面,Poly IC12U被证实能增强H1N1流感疫苗在小鼠和非人灵长类动物(non-human primate,NHP)模型中的免疫原性,经鼻免疫Poly IC12U疫苗可提高小鼠IgA滴度[39]。Ichinohe等[40]的研究发现,用Poly IC12U作为佐剂联合H5N1灭活抗原免疫猴子,不仅可以诱导抗原特异性唾液IgA抗体,还可以诱导对同源病毒具有高中和活性的血清IgG抗体,攻毒实验结果显示Poly IC12U联合甲型H5N1流感疫苗经鼻免疫可以为猴子提供有力的交叉保护性免疫。在肿瘤的研究中发现,Poly IC12U能克服与荷瘤状态相关的任何免疫抑制因子,说明Poly IC12U可能成为癌症导向疫苗治疗方案中的理想佐剂[38]。
3.5 PolyAU
PolyAU也是一种病毒dsRNA的类似物,目前报道显示其仅与TLR3或TLR7发生相互作用,不结合 RIG-I样受体(RIG-I like receptors,RLRs)[41]。目前,PolyAU在体内的作用机制尚未明确,主要研究方向集中在肿瘤免疫方向,相关的临床研究较少。对体外骨髓树突状细胞(bone marrow dendritic cell,BMDC)的分析显示,PolyAU可刺激DC上TLR3和TLR7激活先天免疫,增加体内抗原特异性CD8+T细胞应答。在RNAase的作用下,PolyAU可特异性激活TLR7[42]。Nocera等[41]利用不同肿瘤细胞系诱导小鼠成瘤,随后注射PolyAU治疗,结果显示PolyAU通过激活转录因子IRF3诱导Ⅰ型干扰素的产生,促进髓系细胞浸润肿瘤的特异性Ag免疫反应,降低了肿瘤的生长,延长了小鼠生存期。
3.6 ARNAX
Matsumoto等[43]发现了一种新型TLR3特异性佐剂,命名为ARNAX。ARNAX可以特异性激活TLR3而不激活线粒体抗病毒信号蛋白(mitochondrial antiviral signaling protein,MAVS)途径,并且充分增强DC的交叉启动以激活/增殖T细胞。研究还发现,ARNAX鼻腔给药时可充分诱导IgA产生和T细胞增殖。此外,B细胞中的IgA的类别转换(class switch recombination,CSR)与DC中TLR3的活化相一致。目前,大多数佐剂具有炎症小体激活特性,导致接种后继发于细胞激素血症的副作用[44]。虽然通过佐剂进行DC-启动对于诱导T细胞增殖是必不可少的[45-47],但DC-启动的发生不会引起与辅助治疗副作用密切相关的全身性炎症[45]。鼻腔途径可以降低细胞因子的毒性水平,但具有非炎性特征的鼻用佐剂可以更好地启动DC进行T细胞和B细胞激活。ARNAX就可以在没有细胞因子毒性的情况下同时诱导T细胞增殖和IgA产生[48],因此,ARNAX作为新型TLR3激动剂,具有广阔的应用前景。虽然ARNAX的发现至今仅有四五年的时间,但这一领域的研究进展较快,势必会成为研究热点。
4 展望
新型佐剂在疫苗的研发中具有广阔的应用前景。目前研究领域所研究的TLR3激动剂主要是在PolyI:C的基础上进行化学修饰,进而改善化合物的RNase的稳定性或降低毒性,以期能够发现毒性低、免疫刺激性好的TLR3激动剂并应用于人类肿瘤治疗和传染病预防领域。已知的大部分TLR3激动剂能够激活Th1免疫通路,并能通过滴鼻和皮间免疫引发黏膜免疫,从而产生IgA抗体,是目前已知的能够激活黏膜免疫的少量药物之一,在工业化密集养殖产业,这对研发新的呼吸道和消化道病毒的动物疫苗具有重要意义。目前,有关TLR3激动剂的研究主要集中在人的传染性疾病预防和肿瘤治疗领域,大部分关于TLR激动剂的研究在进展到临床阶段时,由于实验动物和人类的巨大差异导致结果不佳,使得相当一部分的TLR激动剂的研究停滞不前。本课题组近期使用PolyAU修饰产物作为禽流感灭活疫苗的佐剂,实验结果表明PolyAU能够有效地激发鸡的体液免疫,PolyAU佐剂组对白油组的保护率高于传统组(数据未发表)。目前关于养殖动物疫苗佐剂的免疫机制研究相对稀缺,可通过借鉴TLR3激动剂在实验模式动物中的研究数据,进行养殖动物的相关免疫学研究,开发新型的高效低毒兽用佐剂。从提高畜牧业生产效率和产出品质方面来看,研发安全、可降解的养殖动物疫苗佐剂对于提升动物福利和畜牧业产品质量具有重要的意义。

