微生物糖基转移酶催化合成槲皮素糖苷及其抗炎活性评价
王程, 窦文芳, 何丽丽
江南大学药学院,江苏 无锡 214122
槲皮素(3,3′,4′,5,7五羟基黄酮)是一种以C6-C3-C6为基本碳架的黄酮类化合物,广泛分布在植物中的花、叶、果实中,多以糖苷的形式存在[1]。目前国内外有许多关于槲皮素药理活性的研究,发现其具有丰富的药理活性,包括抗氧化及清除氧自由基[2]、抗炎[3]、抗癌[4]、降低血糖和保肝[5-7]等作用。但槲皮素的水溶性很差,几乎不溶于水,在小肠吸收表面不易被主动吸收,生物利用度低[8];Stahlhut等[9]发现体外槲皮素不稳定,易降解,在培养基中所加入的槲皮素24 h内完全降解。为解决这一问题,目前主要利用糖基化、甲基化和羟基化反应来提高槲皮素分子的稳定性和水溶性,进而提高其生物利用度[10]。其中糖基化反应是应用最为广泛的化学反应。目前,槲皮素的糖苷化合物主要通过三种方式获得:从天然植物中提取、化学合成和酶法合成[11-12]。其中酶法合成因其具有催化效率高、专一性强、 副产物少且对环境污染小等优点逐渐受到关注,而酶法合成主要利用糖基转移酶进行催化。
糖基转移酶是一类能够催化单糖、双糖和糖复合物中糖链合成的一类酶。该类酶主要负责将活性供体(通常为NDP-糖)的单糖转移到糖、蛋白质、脂质及各种杂环化合物上,从而形成特异的糖苷键[13]。由于多数糖苷类化合物存在于植物中,植物来源的糖基转移酶研究较多。随着对糖基转移酶的研究不断深入,近年来也发现很多来源于微生物的糖基转移酶能够催化合成多种糖苷类化合物。Liang等[14]发现枯草芽孢杆菌中的糖基转移酶UGT109A1可以催化人参皂苷的C3-OH、C12-OH和C20-OH糖基化产生非天然人参皂苷。Pandey等[15]发现来自地衣芽孢杆菌DSM13的UDP-糖基转移酶 YjiC可在体外作用于23种类黄酮。
本文主要研究来源于大肠杆菌的糖基转移酶GT-1、GT-2以及苏云金芽孢杆菌BTGT-1 3种糖基转移酶对槲皮素的糖基化修饰,进而又对槲皮素及其糖苷的水溶性进行测定,并采用LPS诱导RAW264.7细胞作为体外炎症模型[16-18]研究槲皮素及其糖苷产物的体外抗炎活性作用,以期为以后槲皮素糖基化工业化制备提供新的思路,为槲皮素的深入研究以及新药研发奠定基础。
1 材料与方法
1.1 材料
1.1.1菌株与质粒EscherichiacoliBL21,重组表达载体pGEX4T-1/GT-1、pGEX4T-1/GT-2、pGEX4T-1/BTGT-1由实验研究前期构建完成。糖基转移酶GT-1、GT-2基因来源于大肠杆菌埃希菌,BTGT-1基因来源于苏云金芽孢杆菌。3种糖基转移酶的基因组数据来源于NCBI数据库(https.//www.ncbi.nlm.nih.gov/)。小鼠单核巨噬细胞RAW264.7由无锡怀信生物科技有限公司馈赠。
1.1.2试剂与仪器 槲皮素购自成都德锐可生物科技有限公司;其他实验试剂购自上海国药集团;UDP-葡萄糖、槲皮素-N-乙酰-氨基葡萄糖、UDP-N-乙酰-氨基葡萄糖均由实验室合成;异槲皮苷对照品、胎牛血清、高糖培养基DMEM、脂多糖LPS、CCK-8、NO试剂盒购自Sigma-Aldrich(中国)公司;IL-6、IL-1β 试剂盒购自杭州联科生物科技股份有限公司;高效液相色谱仪(安捷伦公司,规格:1260);超高相液相色谱串联四级杆飞行时间质谱联用仪(型号:MALDI SYNAPT MS,生产厂家:美国沃特世公司)。
1.2 方法
1.2.1重组蛋白的诱导表达与纯化 分别挑取实验研究前期构建的重组菌BL21/pGEX4T-1-GT-1、BL21/pGEX4T-1-GT-2、 BL21/pGEX4T-1-BTGT-1单菌落接种至50 mL 液体LB培养基中(氨苄终浓度100 μg·mL-1),37 ℃培养过夜。按1% 接种至500 mL 液体LB培养基中,37 ℃培养至OD600为0.6~0.8,加入终浓度为0.2 mmol·L-1的IPTG,25 ℃诱导过夜。离心收集菌体(8 000 r·min-1, 10 min,4 ℃),-80 ℃保存菌体备用。称取10 g菌体,加入Binding buffer(PBS:140 mmol·L-1NaCl,2.7 mmol·L-1KCl,10 mmol·L-1Na2HPO4,8 mmol·L-1KH2PO4)。采用超声波破碎后,离心收集上清,通过 GST标签柱,Elution buffer (50 mmol·L-1Tris-HCl,10 mmol·L-1还原型谷胱甘肽,pH 8.0)洗脱目的蛋白,蛋白纯化产物经SDS-PAGE电泳分析。
1.2.2酶法催化槲皮素的糖基化 以槲皮素为糖基受体,UDP-葡萄糖、UDP-N-乙酰-D-氨基葡萄糖为糖基供体。25 mL 反应体系包括:槲皮素0.5 mmol·L-1,糖基供体 1 mmol·L-1,MgCl2100 mmol·L-1,Tris-HCl 10 mmol·L-1,糖基转移酶0.13 mg·mL-1,DTT 15 mmol·L-1。30 ℃水浴6 h,槲皮素含量经HPLC检测,并且以异槲皮苷为对照品,对产物进行鉴定。
1.2.3槲皮素糖苷产物液相色谱-质谱联用(LC-MS) 对纯化的槲皮素糖苷产物进行质谱检测分析。采用负离子化方式,毛细管电压3.5 kV,加热温度100 ℃,检测槲皮素糖苷分子量。
1.2.4槲皮素和槲皮素糖苷产物的水溶性比较 分别称取槲皮素和槲皮素糖苷冻干粉各10 mg,加入50% DMSO溶液10 mL,配置成浓度1 mg·mL-1母液,按照浓度1.25、2.50、5.00、10.00、20.00、50.00 μg·mL-1浓度梯度稀释,通过HPLC检测,以峰面积为纵坐标,浓度为横坐标,绘制槲皮素和槲皮素糖苷的浓度标准曲线。称取过量槲皮素和槲皮素糖苷,加入蒸馏水,超声30 min,室温放置72 h,离心,取饱和溶液上清,HPLC检测上清槲皮素和槲皮素糖苷含量,根据标准浓度曲线,计算其水溶液溶解度。
1.2.5槲皮素和槲皮素糖苷产物体外细胞抗炎活性研究 探究槲皮素和槲皮素糖苷对脂多糖LPS 诱导小鼠巨噬细胞瘤细胞系 RAW264.7 分泌炎症因子NO、 IL-1β和IL-6的影响,评价其抗炎效果。
①CCK法[19]检测槲皮素和槲皮素糖苷产物对RAW264.7细胞毒性作用。细胞经过复苏和传代培养后,将对数生长期的RAW 264.7细胞接种于96孔板中,密度为0.8×104个·孔-1,每孔100 μL,不接种细胞组设置3个复孔作为空白对照。过夜培养待细胞状态稳定贴壁后去上清,分别加入100 μL终浓度为10、20、30、40、50 μmol·L-1的槲皮素和槲皮素糖苷样品(溶于细胞培养基),每个浓度3个复孔;不加药组和空白组各3个复孔,分别加新鲜细胞培养基,每孔100 μL,孵育24 h。每孔加入10 μL CCK-8,37 ℃,5% CO2孵育1~2 h。酶标仪450 nm测得吸光度(OD值)。并计算细胞存活率,计算公式为:
细胞存活率=(A加药-A空白)/(A不加药- A空白)×100%
②槲皮素和槲皮素糖苷产物对RAW264.7 分泌NO、IL-1β和IL-6的影响。取对数生长期的RAW 264.7细胞接种于24孔板中,密度为5×105个·孔-1,每孔0.5 mL。过夜培养待细胞状态稳定贴壁后去上清,分别加入0.5 mL终浓度为10、20、30 μmol·L-1的槲皮素和槲皮素糖苷样品(溶于细胞培养基),10 μmol·L-1地塞米松作为阳性对照(溶于细胞培养基),每个浓度3个复孔,不加药组3个复孔作为空白对照,孵育4 h,弃上清,每孔加入0.5 mL终浓度为1 μg·mL-1的LPS(溶于不含血清的细胞培养基),37 ℃,5% CO2孵育15 h。离心收集上清备用。分别用NO试剂盒和IL-1β、IL-6 ELISA试剂盒检测NO、IL-1β和IL-6含量。
2 结果与分析
2.1 重组蛋白的诱导表达与纯化产物的SDS-PAGE电泳分析
已知GST标签大小为26 kD, GT-1、GT-2、 BTGT-1 3种目的蛋白与GST标签的融合蛋白大小分别为54.8、60.5、56.4 kD。纯化产物通过SDS-PAGE电泳分析,3种纯化蛋白条带大小与预期一致;GT-1酶浓度较低,仅为0.32 mg·mL-1,GT-2和BTGT-1浓度分别为1.71、1.22 mg·mL-1。
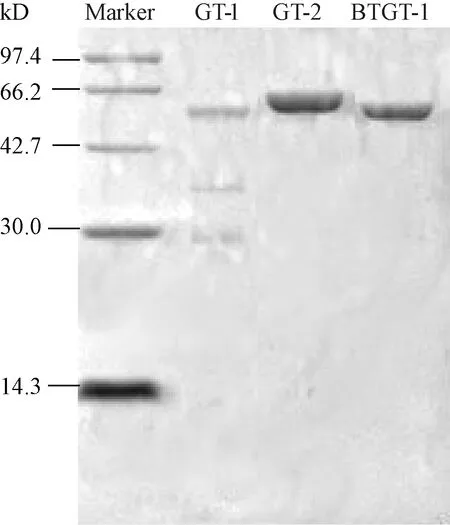
图1 3种糖基转移酶的纯化SDS-PAGE 结果Fig.1 Purification SDS-PAGE results of three glycosyltransferases
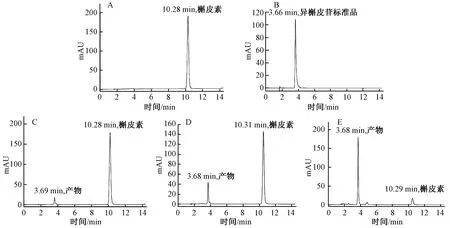
A:槲皮素与UDP-N-乙酰-D-氨基葡萄糖反应图谱;B:异槲皮苷标准品;C:GT-1催化槲皮素和UDP-葡萄糖反应图谱;D为:GT-2催化槲皮素和UDP-葡萄糖反应图谱;E:BTGT-1催化槲皮素和UDP-葡萄糖反应图谱。
2.2 槲皮素糖基化反应
HPLC检测结果显示,由图2 C、D、E可以看出,当以UDP-葡萄糖为糖基供体时,反应6 h,HPLC图谱显示在10.2 min左右为槲皮素,3.7 min左右出现新的吸收峰,表明酶促反应生成了新的物质。且3种糖基转移酶催化生成的产物吸收峰位置相同,表明生成同一物质。图2A显示当以UDP-N-乙酰-D-氨基葡萄糖为糖基供体时,没有新的物质生成。以上表明3种糖基转移酶仅能催化槲皮素和UDP-葡萄糖发生糖基化反应,表明3种酶的催化底物选择专一性强。经计算得出GT-1、GT-2和BTGT-1催化反应的产物生成率分别为5.33%、 15.18%和63.82%。整个反应过程中副产物少,且生成单一产物。另通过对比槲皮素-3-O-β-D-葡萄糖(异槲皮苷)对照品 (图2B),二者在370 nm下吸收峰的保留时间分别为3.66和3.68 min,可以判断反应生成的槲皮素糖苷为异槲皮苷。
2.3 槲皮素糖苷的质谱分析
为进一步确定酶催化槲皮素和UDP-葡萄糖发生糖基化反应,对酶促反应液做液相-质谱(LC-MS)检测分析。结果如图3所示,已知槲皮素分子量为302,葡萄糖分子量为180,当以UDP-葡萄糖为糖基供体时,槲皮素与葡萄糖结合形成糖苷键,生成1分子水(H2O),因此槲皮素糖苷的分子量为464。因检测使用负离子源会失去氢,分子量减1,而反应液中有槲皮素残留,故图谱上在463.2出现特异峰,为槲皮素-葡萄糖苷。检测结果证明酶催化槲皮素和UDP-葡萄糖生成槲皮素-葡萄糖苷。

图3 槲皮素糖苷产物的LC-MS检测Fig.3 Determination of quercetin glycoside by LC-MS
2.4 槲皮素和槲皮素糖苷产物的水溶性测定
水溶性检测结果如表1所示。在异槲皮苷和槲皮素-N-乙酰-D-氨基葡萄糖水溶性相对于槲皮素分别提高了13.8倍和15.4倍。由此可以得出槲皮素经糖基化后,其水溶性得到较大提高。

表1 3种化合物的标准浓度曲线Table 1 Standard concentration curves for three compounds
2.5 CCK法检测槲皮素和槲皮素糖苷产物对RAW264.7细胞毒性作用
如表2所示,3种化合物浓度低于30 μmol·L-1时对细胞毒性作用与不加药组相比无统计学差异(P>0.05)。当浓度大于30 μmol·L-1时,3组的细胞存活率极显著低于不加药组(P<0.01),同等浓度下2种槲皮素糖苷组细胞生存率高于槲皮素。表明在一定浓度范围内,槲皮素经糖基化后对细胞毒性具有一定的减弱作用。

表2 3种化合物对RAW264.7的毒性作用Table 2 The toxic of three compounds on RAW264.7
注:*和**表示与不加药组相比差异在P<0.05和P<0.01水平具有统计学意义。
2.6 3种化合物对LPS诱导RAW264.7细胞释放NO、IL-1β、IL-6 的影响
细胞经致炎药物LPS刺激15 h 后,NO、IL-1β、IL-6(表3)分泌量均极显著高于空白对照组(P<0.01)。3种化合物组细胞经4 h 不同浓度的保护后再经LPS刺激15 h 后,当浓度为10、20、30 μmol·L-1时,NO、IL-1β、IL-6分泌量显著低于LPS组(P<0.01),但显著高于空白对照组(P<0.01),且呈剂量依赖性。表明在一定浓度范围内,3种化合均具有一定的抗炎作用。
3 讨论
利用微生物来源的3种糖基转移酶GT-1、GT-2和BTGT-1对槲皮素进行糖基化修饰,发现3种酶仅能催化槲皮素和UDP-葡萄糖为底物生成槲皮素-3-O-β-D-葡萄糖(异槲皮苷),GT-1、GT-2和BTGT-1催化反应的产物生成率分别为5.33%、15.18%和63.82%。同时也对槲皮素、异槲皮苷和实验室保存的槲皮素-N-乙酰-D-氨基葡萄糖进行水溶性以及体外细胞抗炎活性评价。发现槲皮素经糖基化后其水溶性得到较大提高,异槲皮苷和槲皮素-N-乙酰-D-氨基葡萄糖水溶性分别是槲皮素的13.8倍和15.4倍。同等浓度下槲皮素糖苷对RAW264.7 细胞的毒性作用低于槲皮素。且3种化合物在一定浓度范围内对LPS诱导RAW264.7细胞释放NO、IL-1β、IL-6 都有显著的抑制作用,且呈剂量依赖性。表明3种化合物都具有一定的抗炎作用,该研究为槲皮素糖基化制备提供了新的思路,为槲皮素的新药研发奠定了基础。
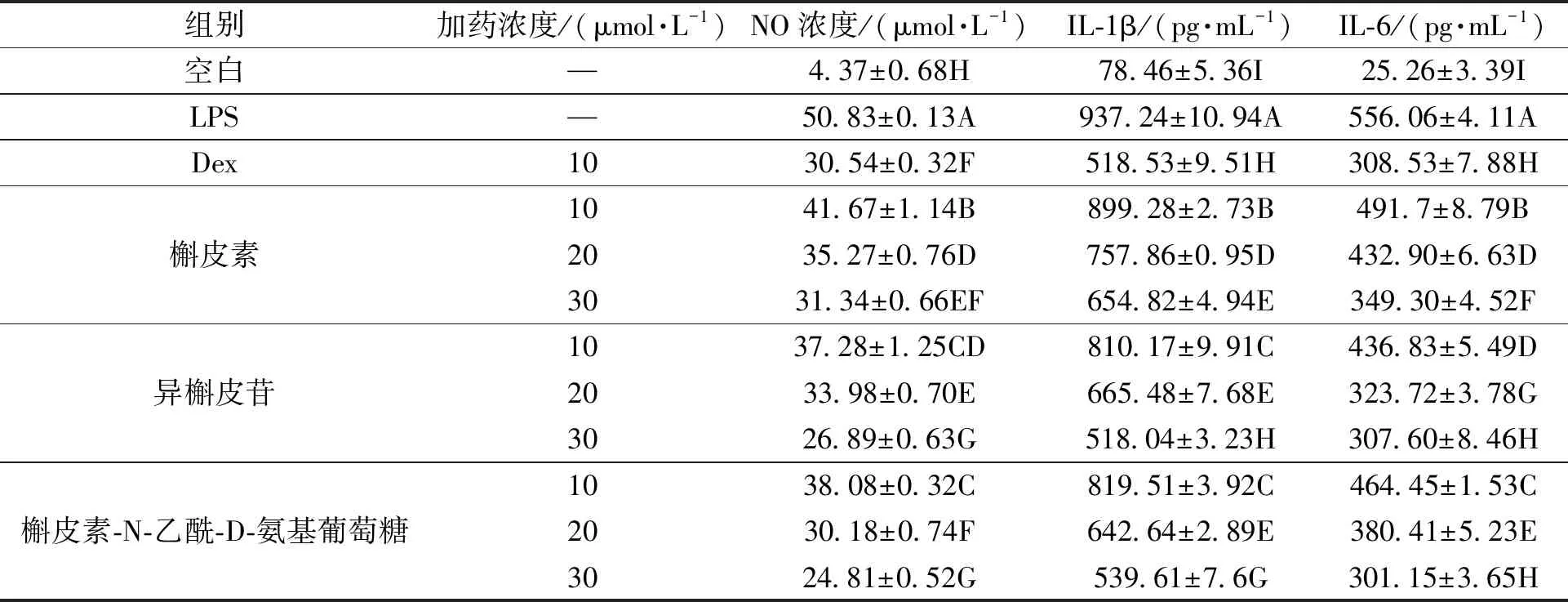
表3 3种化合物对LPS诱导RAW264.7细胞释放NO、IL-1β、IL-6 的影响Table 3 Effects of the three compounds on release of NO、IL-1β、IL-6 in LPS-reduced RAW264.7 cells
注:同列数据后不同大写字母表示差异具有统计学意义(P<0.01)
槲皮素作为黄酮类化合物中的代表化合物,广泛存在于红洋葱、茶和芸苔属蔬菜以及许多种子、棉花和叶子中,具有丰富的药理活性[1],包括抗氧化、抗癌、抗炎、抗肿瘤、降低血压等作用[2-5]。然而槲皮素的水溶性极差,几乎不溶于水,生物利用度差[6]。可以考虑对槲皮素进行糖基化修饰提高其水溶性,进而提高槲皮素的生物利用度。而酶法合成槲皮素糖苷是一种高效的方法。RAW264.7是小鼠巨噬细胞,经LPS刺激可以产生多种炎症因子如NO、IL-1β、IL-6等[20],通过探究槲皮素及其糖苷对炎症因子的影响评价其抗炎活性。
本研究利用基因来源于大肠杆菌的GT-1、GT-2以及苏云金芽孢杆菌的BTGT-1 3种糖基转移酶催化合成槲皮素糖苷,经诱导表达和纯化获得3种糖基转移酶。研究发现3种糖基转移酶都能够催化以槲皮素和UDP-葡萄糖为底物生成槲皮素-3-O-β-D-葡萄糖(异槲皮苷),但不能催化槲皮素和UDP-N-乙酰-D-氨基葡萄糖发生反应,结果表明3种酶的底物选择专一性强。另通过对槲皮素及槲皮素糖苷水溶性和体外抗炎活性评价,发现槲皮素经糖基化后其水溶性得到较大提高。而体外细胞抗炎活性实验发现槲皮素具有一定的抗炎活性,且经糖基化修饰后仍能保持其抗炎活性。

