铜藻岩藻黄素提取及纯化工艺研究
李红艳, 王颖*, 刘天红, 姜晓东, 李晓, 孙元芹, 纪蕾, 唐欢欢
1. 山东省海洋生物研究院,山东 青岛 266104;2. 山东省大型海藻资源保护与应用工程技术研究中心,山东 青岛 266104
岩藻黄素(fucoxanthin)又称岩藻黄质、褐藻素,是一种类胡萝卜素,广泛存在于藻类、海洋浮游植物和水生贝壳类动物等海洋生物组织中[1],尤以褐藻和硅藻中含量最为丰富[2]。国内外许多研究表明,岩藻黄素具有多种生物学活性,包括抗炎、抗肥胖、抗肿瘤、抗氧化、调节血糖含量以及保护皮肤和脑血管等[3-9],因此,其在保健品、护肤美容和医药等领域具有广阔的应用前景。
铜藻(Sargassumhorneri),属褐藻门(Phaeophyta)、圆子纲(Cyclosporeae)、墨角藻目(Fucales)、马尾藻科(Sargassaceae),又名丁香屋、草茜、竹茜菜,是北太平洋西部特有的暖温带浅海区海藻。铜藻具有较高的生态价值,是藻床重建、浅海生态修复的重要物种之一,可为鱼、贝类等提供繁育场所[10]。铜藻富含膳食纤维、褐藻糖胶、褐藻淀粉、褐藻胶、多酚等活性物质[11-12],在食品、饲料、有机肥料、藻胶工业和医药等行业具有良好的应用前景,经济价值较高。铜藻中岩藻黄素含量较高[12],但是国内目前提取岩藻黄素多采用海带、羊栖菜、裙带菜、鼠尾藻等[13-15],对以铜藻为原料提取岩藻黄素的研究较少[16-19],且以铜藻鲜藻作为原料进行提取的报道更为少见[20]。岩藻黄素的提取多采用超声辅助有机溶剂法、超临界CO2法等,提取率一般为0.37~0.83 mg·g-1DW[13-19],提取率相对较低;纯化多采用硅胶柱层析法,纯度最高可达80%以上[14,21],但缺乏对更高纯度岩藻黄素的研究报道。基于此,本研究以铜藻鲜藻为原料,利用有机溶剂进行提取,并对岩藻黄素的提取工艺进行优化,随后采用硅胶柱层析法进行纯化,并对硅胶柱床高度、上样量和洗脱流速进行优化,最后采用制备液相法对经层析纯化的岩藻黄素进一步纯化,以期为铜藻资源的开发利用提供新方向,并为高纯度岩藻黄素的工业化生产提供参考。
1 材料与方法
1.1 实验材料
实验所用铜藻于2018年5月采自山东省威海市荣成市俚岛湾海域,用过滤海水洗刷干净,置于-20 ℃保存备用。岩藻黄素标准品购自美国Sigma公司;甲醇、乙醇、石油醚、乙酸乙酯、正己烷均为国产分析纯;制备液相纯化所用的甲醇和液相色谱检测所用的乙腈均为色谱纯。
1.2 仪器与设备
LC-20AT高效液相色谱仪(日本岛津仪器公司);Milli-Q Reference超纯水系统(美国密理博公司);FA1 604 N电子分析天平(上海精密仪器有限公司);DF-101S集热式恒温磁力搅拌器(巩义市予华仪器有限公司);BUCHI C-605梯度快速色谱系统(层析柱15 mm×230 mm)(瑞士步琦公司);1260Infinity制备液相色谱仪器(色谱柱Agilent Prep C18 Column 30 mm×100 mm,10 μm)(美国安捷伦公司)。
1.3 样品处理
将冻存的铜藻自然解冻,滤纸吸取其表面水分,剪碎后用多功能粉碎机破碎至长度约3~5 mm。另外,根据《GB5009.3-2016食品中水分的测定》[22]第一法直接干燥法测定铜藻的水分含量,以便后续将岩藻黄素提取率、得率由鲜重计算折合为干重,具体按照下式进行计算:
(1)
1.4 岩藻黄素粗提液制备
称量3 g处理过的铜藻鲜藻,加入提取溶剂,再加入转子,密封后包裹锡箔纸避光,磁力搅拌,恒温水浴提取一定时间,过滤,留取滤液为岩藻黄素粗提液,待硅胶柱层析分离。按照以下公式计算提取率:
(2)
从提取的工艺流程可以看出,提取溶剂及其浓度、料液比、提取时间和提取温度对于岩藻黄素提取率至关重要,因此,对上述因素进行单因素实验和正交实验,以确定最佳工艺参数。
1.4.1单因素实验 采用单因素实验对提取溶剂及其浓度、料液比、提取时间和提取温度等因素进行考察。提取所用的有机溶剂为:甲醇、乙醇、正己烷、石油醚、乙酸乙酯;最适有机溶剂的浓度水平设置为:60%、70%、80%、90%、100%;料液比水平设置为:1∶5、1∶10、1∶15、1∶20、1∶25;提取时间水平设置为:1、2、3、4 h;提取温度水平设置为:35、40、45、50、55、60 ℃。过滤后按公式(2)计算岩藻黄素提取率,考察各因素的不同水平对岩藻黄素提取率的影响。
1.4.2正交实验 在单因素实验的基础上,以最适有机溶剂的浓度、提取时间、提取温度、料液比为因素,以岩藻黄素提取率为考察指标,采用L9(34)正交表对岩藻黄素提取条件进行优化,各因素的实验水平见表1。
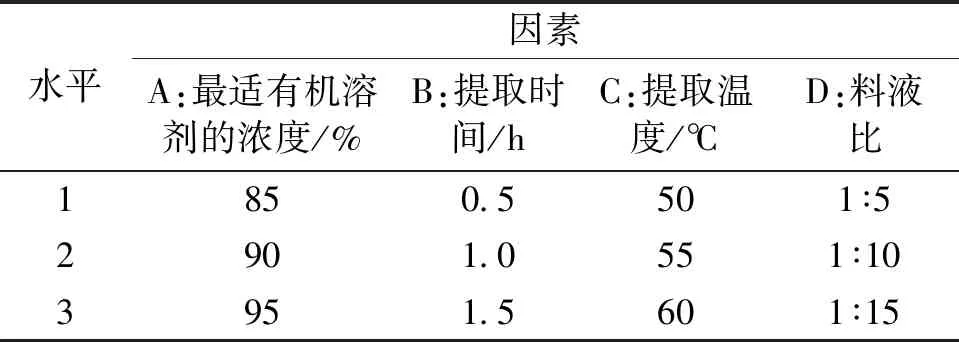
表1 L9(34)正交实验因素水平表Table 1 Factors and levels of L9(34) orthogonal test
1.5 硅胶柱层析纯化
1.5.1硅胶柱层析纯化的基本工艺流程 层析硅胶样品制备:为了保证实验的平行性,批量制备一定量层析硅胶样品保存备用。取体积为V0的粗提液(岩藻黄素浓度C0)38 ℃减压浓缩,除去溶剂后,加入等质量的100目硅胶拌匀,继续旋蒸至硅胶粒干燥,称量总重m0,4 ℃密封避光保存,根据实验需求取用。
柱层析:称取一定量活化后的硅胶,石油醚溶胀30 min,湿法装柱,干法上样量为mf,以不同浓度梯度的石油醚∶乙酸乙酯(体积比分别为10∶0、9∶1、8∶2、7∶3、6∶4)混合溶剂为洗脱液,分别洗脱2个柱体积。收集各部分洗脱液,通过薄层层析法与岩藻黄素标准品进行比较,确定橙黄色部分为目标岩藻黄素,收集该部分洗脱液,测量其体积Vf和岩藻黄素浓度Cf。减压浓缩10倍,密封4 ℃避光储存,留待制备液相纯化。通过下式计算岩藻黄素回收率:
(3)
式中:R—回收率;Vf—岩藻黄素洗脱液体积,mL;Cf—洗脱液中岩藻黄素浓度,mg·mL-1;V0—层析硅胶样品制备所使用粗提液体积,mL;C0—粗提液中岩藻黄素浓度,mg·mL-1;mf—上样量,g;m0—层析硅胶样品制备所得样品总重,g。
1.5.2岩藻黄素硅胶柱层析纯化工艺条件优化 分别考察硅胶柱床高度(8、10、15、20 cm)、上样量(2、4、6、8、10 g)、洗脱流速(6、8、10、12 mL·min-1) 3个因素对岩藻黄素硅胶柱层析纯化效果的影响,计算相应的岩藻黄素纯度(峰面积比)和回收率。研究某一单因素影响效果时,其他条件为固定值,分别为硅胶柱床高度10 cm、上样量6 g、洗脱流速10 mL·min-1。
采用优化得到的最佳提取工艺,批量提取质量为m1的铜藻鲜藻中的岩藻黄素,在最佳硅胶柱层析工艺条件下,将粗提取的岩藻黄素进行纯化,收集橙黄色部分洗脱液,减压浓缩,记录浓缩液体积V1,取样上机检测岩藻黄素浓度C1,根据下式计算岩藻黄素的硅胶柱层析得率Y1,文中数据为多批次收集纯化样品后测定。
(4)
式中:Y1—得率,mg·g-1;V1—柱层析后岩藻黄素浓缩液体积,mL;C1—柱层析后岩藻黄素浓缩液浓度,mg·mL-1;m1—铜藻鲜藻质量,g。
1.6 制备液相纯化
以经层析纯化的岩藻黄素为样品,进样量为5 000 μL,流动相为甲醇∶水=90∶10(体积比),检测波长为450 nm,流速为10 mL·min-1,收集橙黄色部分为岩藻黄素,减压浓缩,浓缩液氮吹得到粉末状岩藻黄素。
将质量为m1的铜藻鲜藻经有机溶剂提取、硅胶柱层析后得到的岩藻黄素样品,采用上述制备液相纯化工艺进一步纯化,得到高纯度岩藻黄素浓缩液体积V2,取样上机检测岩藻黄素浓度C2,根据下式计算岩藻黄素制备液相纯化得率Y2,文中数据为多批次收集纯化样品后测定。
(5)
式中:Y2—制备液相纯化得率,mg·g-1;V2—岩藻黄素浓缩液体积,mL;C2—岩藻黄素浓缩液浓度,mg·mL-1;m1—铜藻鲜藻质量,g。
1.7 岩藻黄素的高效液相色谱检测
色谱条件:色谱柱为Agilent TC-C18 (5 μm×4.6 mm×250 mm);检测波长为448 nm;柱温为35 ℃;流动相为乙腈∶水=90∶10(体积比);流速为1 mL·min-1;进样量为20 μL。
精确称取5 mg岩藻黄素标准品,用色谱级甲醇定容到10 mL,配制成浓度为500 μg·mL-1的标准液。分别取0.1、0.3、0.5、0.7、0.9、1.0 mL标准液,以色谱级甲醇定容到5.0 mL,配制成浓度分别为10、30、50、70、90、100 μg·mL-1的梯度液,配制过程避光操作。取不同浓度梯度液过0.45 μm有机滤膜,采用高效液相色谱检测,将岩藻黄素峰面积(x)与其浓度(y)进行线性回归,根据标准曲线计算样品中岩藻黄素含量。随后,分别取1.4、1.5、1.6中得到的岩藻黄素与标准品岩藻黄素一同进行高效液相色谱(high-performance liquid chromatography,HPLC)检测,并计算各自的纯度(峰面积比)。
1.8 数据处理
所有数据(除特殊说明外)均为3次平行实验结果的平均值±标准偏差,采用SPSS 16.0和Microsoft Excel 2010进行数据分析(方差分析,one-way ANOVA)和图形绘制。
2 结果与分析
2.1 岩藻黄素有机溶剂提取工艺条件优化
2.1.1提取溶剂对岩藻黄素提取率的影响 根据相似相溶原理提取铜藻中的岩藻黄素,本研究选择了5种不同极性的有机溶剂(甲醇、乙醇、正己烷、石油醚、乙酸乙酯),结果如图1所示。岩藻黄素提取率依次为甲醇>乙醇>乙酸乙酯>正己烷=石油醚=0。甲醇的提取率最高,正己烷与石油醚由于极性较低且水溶性差,未能从铜藻中提取出岩藻黄素。因此,选择提取率最高的甲醇作为铜藻鲜藻的提取溶剂。

注:不同小写字母表示不同处理间岩藻黄素提取率的差异在P<0.05水平具有统计学意义。.
2.1.2甲醇浓度对岩藻黄素提取率的影响 在料液比1∶20、提取温度55 ℃、提取2 h的条件下,研究不同甲醇浓度对岩藻黄素提取率的影响。由图2可知,随着甲醇浓度的升高,岩藻黄素的提取率呈先上升后下降趋势,当甲醇浓度为90%时,提取率达到最大值,为0.241 9 mg·g-1。因此,提取岩藻黄素时甲醇的最佳浓度为90%。
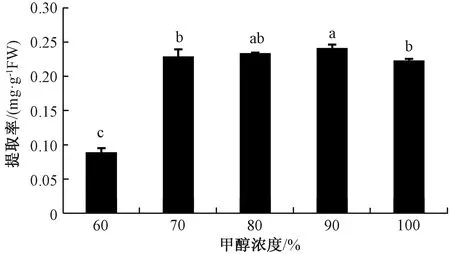
注:不同小写字母表示不同处理间岩藻黄素提取率的差异在P<0.05水平具有统计学意义。
2.1.3料液比对岩藻黄素提取率的影响 在以90%甲醇作为提取溶剂、提取温度55 ℃、提取2 h的条件下,研究不同料液比对岩藻黄素提取率的影响。由图3可知,随着料液比增大,提取率呈先上升后下降趋势,料液比1∶10时提取率最高。这可能是由于料液比升高可使岩藻黄素与甲醇的接触更加充分,并升高铜藻细胞内外岩藻黄素的浓度差,有利于岩藻黄素的扩散,从而提高岩藻黄素提取率。因此,选择1∶10为提取的最佳料液比。
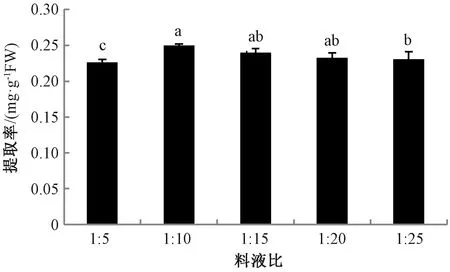
注:不同小写字母表示不同处理间岩藻黄素提取率的差异在P<0.05水平具有统计学意义。
2.1.4提取时间对岩藻黄素提取率的影响 在以90%甲醇作为提取溶剂、料液比1∶10、提取温度55 ℃的条件下,研究不同提取时间对岩藻黄素提取率的影响。由图4可知,随着提取时间延长,岩藻黄素提取率呈略有下降后基本不变趋势。这是由于随着提取时间的延长,岩藻黄素自身不稳定易分解,导致提取率略有下降。考虑到提取效率和能耗,最终选择1 h为最佳提取时间。
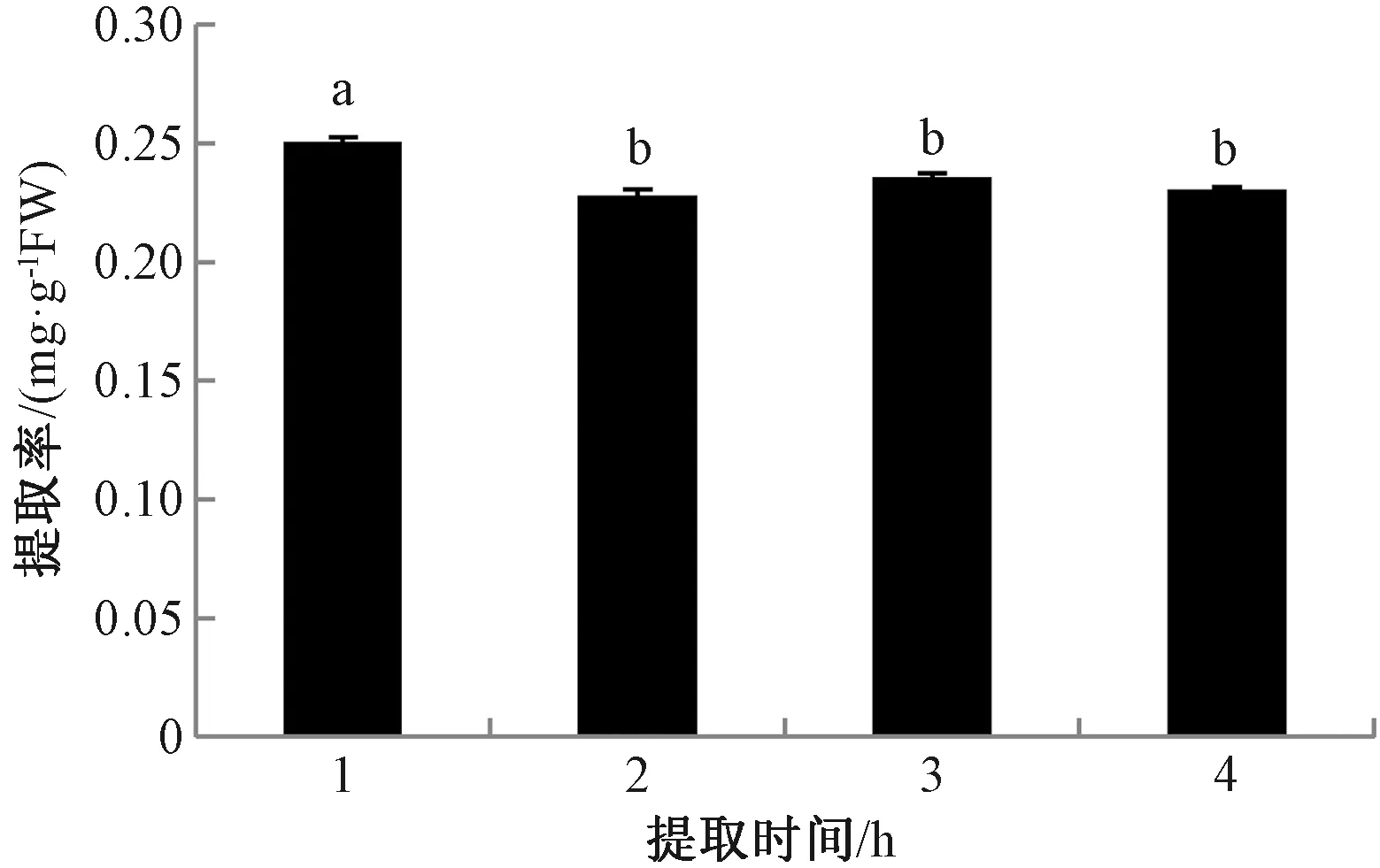
注:不同小写字母表示不同处理间岩藻黄素提取率的差异在P<0.05水平具有统计学意义。
2.1.5提取温度对岩藻黄素提取率的影响 在以90%甲醇作为提取溶剂、料液比1∶10、提取1 h的条件下,研究不同提取温度对岩藻黄素提取率的影响。由图5可知,提取温度升高至55 ℃前,岩藻黄素的提取率呈上升趋势,60 ℃时提取率略有下降。温度升高有利于加快铜藻细胞光合膜的溶解,从而促进色素的释放溶出,提高提取率;但是温度过高时,岩藻黄素可能被破坏,使岩藻黄素提取率下降。因此,选择55 ℃为最佳提取温度。
2.1.6正交实验结果分析 在单因素实验的基础上,以最适有机溶剂的浓度、提取时间、提取温度、料液比为因素,以岩藻黄素提取率为考察指标,采用L9(34)正交表对岩藻黄素提取条件进行优化,结果如表2所示,各因素对岩藻黄素提取率的影响程度由高到低依次为D>A>C>B,即料液比对岩藻黄素提取率的影响最高,其次为甲醇浓度。最优工艺组合为A2B2C1D2,即甲醇浓度90%、提取时间1 h、提取温度50 ℃、料液比1∶10。
2.1.7验证实验 采用最优工艺条件,即甲醇浓度90%、提取时间1 h、提取温度50 ℃、料液比 1∶10,开展3组平行有机溶剂提取试验,得到岩藻黄素提取率为(0.258 9±0.003 6) mg·g-1FW [(1.078 8±0.015 0) mg·g-1DW],该条件下岩藻黄素的提取率高于表2中任一结果,该优化工艺为最佳选择。

注:不同小写字母表示不同处理间岩藻黄素提取率的差异在P<0.05水平具有统计学意义。

表 2 正交实验结果Table 2 Results of orthogonal test
2.2 岩藻黄素硅胶柱层析纯化工艺条件优化
2.2.1硅胶柱床高度对岩藻黄素纯化效果的影响 在上样量6 g、洗脱流速10 mL·min-1的条件下,研究不同硅胶柱床高度对岩藻黄素纯化效果的影响。从图6可以看出,随着硅胶柱床高度增加,岩藻黄素纯度呈先迅速升高后基本不变的趋势,回收率呈先升高后缓慢下降趋势,硅胶柱床高度为10 cm时纯度和回收率最高。洗脱过程中,不同色素由于脂溶性不同,洗脱顺序也不相同,岩藻黄素洗脱顺序较为靠后,先于岩藻黄素洗脱的色素在硅胶柱中有一定的残留,影响岩藻黄素纯度。当硅胶柱床高度偏短时,色素之间未能充分分离,使岩藻黄素的纯度偏低;硅胶柱床高度增长至可以使色素充分分离后,继续增加硅胶柱床高度对岩藻黄素纯度无明显效果;而硅胶柱床高度过长,则会使已经分离的岩藻黄素被多余的硅胶再次吸附,导致回收率下降。综合考虑回收率和纯度,选择10 cm为最佳硅胶柱床高度。
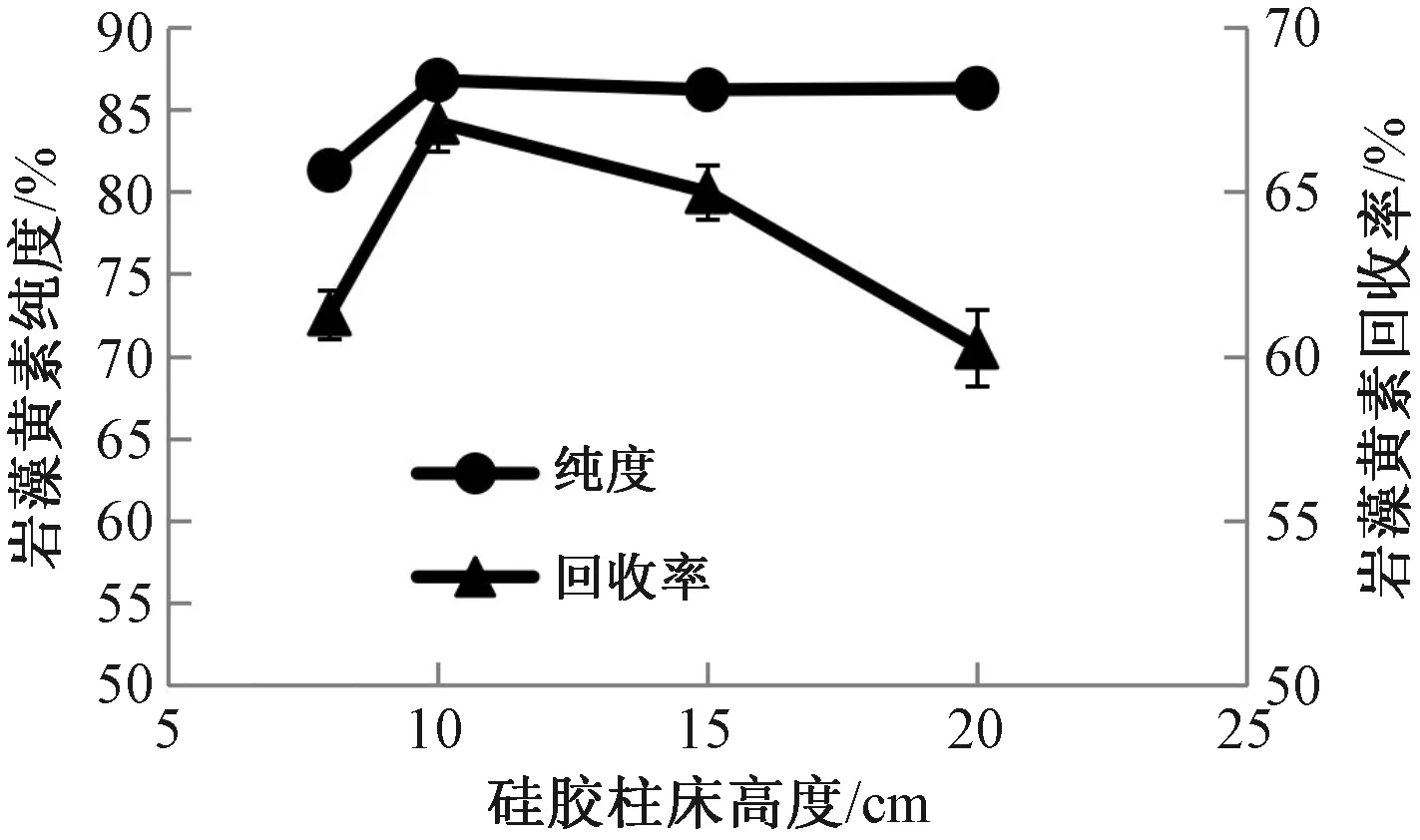
图6 硅胶柱床高度对岩藻黄素纯化效果影响Fig.6 Effect of silica column bed height on the purification effect of fucoxanthin
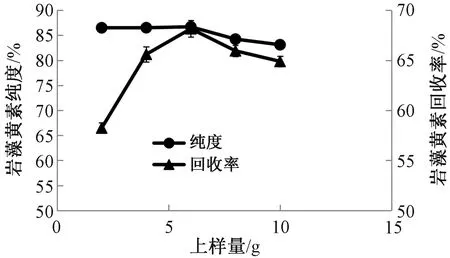
图7 上样量对岩藻黄素纯化效果影响Fig.7 Effect of loading amount on the purification effect of fucoxanthin
2.2.2上样量对岩藻黄素纯化效果的影响 在硅胶柱床高度10 cm、洗脱流速10 mL·min-1的条件下,研究不同上样量对岩藻黄素纯化效果的影响。从图7可以看出,上样量小于6 g时,岩藻黄素纯度基本不变,超过6 g后,纯度不断下降,而回收率则呈先升高后下降趋势,上样量6 g时回收率最高。在硅胶柱长确定的情况下,上样量增加,岩藻黄素在硅胶中的残留比有所降低,因此回收率有所提高;但是上样量进一步增大,硅胶柱床高度也有所增加,使得岩藻黄素发生二次吸附,回收率有所降低。同时,上样量过大时,可能会导致硅胶吸附达到饱和,部分色素带洗脱时发生重叠,导致岩藻黄素纯度降低。因此,综合考虑选择6 g作为最佳上样量。
2.2.3洗脱流速对岩藻黄素纯化效果的影响 在硅胶柱床高度10 cm、上样量6 g的条件下,研究不同洗脱流速对岩藻黄素纯化效果的影响。从图8可以看出,随着洗脱流速增加,岩藻黄素纯度和回收率均呈先升高后下降趋势。洗脱流速较低时,柱层析时间较长,由于岩藻黄素自身不稳定,易分解,可能会在柱层析过程中部分降解,使岩藻黄素回收率偏低;且流速低时,色素条带存在拖尾现象,也导致岩藻黄素的纯度和回收率降低。而洗脱流速过快时,各色素条带之间未能充分分离,导致岩藻黄素纯度下降。综合考虑选择10 mL·min-1为最佳洗脱流速。
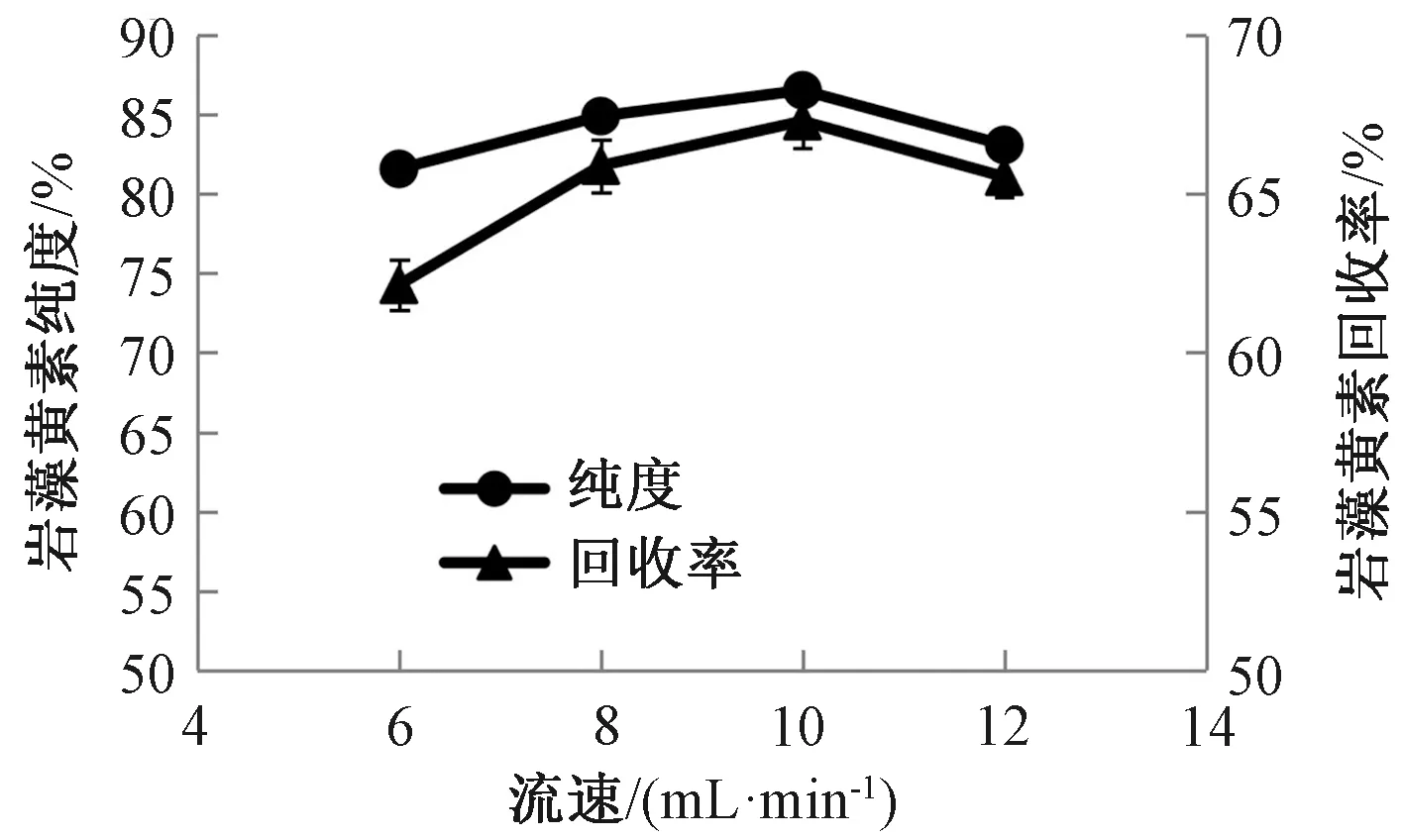
图8 洗脱流速对岩藻黄素纯化效果影响Fig.8 Effect of flow rate on the purification effect of fucoxanthin
2.2.4优化后的硅胶柱层析工艺纯化岩藻黄素 在硅胶柱床高度10 cm、上样量6 g、洗脱流速10 mL·min-1的条件下,开展硅胶柱层析纯化实验,岩藻黄素得率为0.176 5 mg·g-1FW(0.735 3 mg·g-1DW)。
2.3 岩藻黄素制备液相纯化
以经层析纯化的岩藻黄素为样品,进样量为5 000 μL,流动相为甲醇∶水=90∶10(体积比),检测波长为450 nm,流速为10 mL·min-1,进行制备液相纯化,岩藻黄素得率为0.127 1 mg·g-1FW(0.529 4 mg·g-1DW)。
2.4 岩藻黄素高效液相色谱法分析
取不同浓度梯度液过0.45 μm有机滤膜,采用高效液相色谱检测,将岩藻黄素峰面积(x)与其浓度(y)进行线性回归,得标准曲线回归方程y=4×10-6x+2.637 2(R2=0.999 1),根据标准曲线计算各样品中岩藻黄素含量。
分别取经有机溶剂萃取、硅胶柱层析纯化以及制备液相纯化的岩藻黄素与标准品岩藻黄素进行HPLC分析,结果如图9所示。由图9A可以看出,粗提液色谱图的杂峰较多,在7.771 min出现的吸收峰与标准品(图9D)岩藻黄素峰(7.889 min)较为接近,为岩藻黄素峰,此时岩藻黄素纯度为24.51%±1.62%。硅胶柱层析纯化后(图9B),与粗提液相比,杂峰大大减少,在7.814 min出现的吸收峰与标准品一致,判断该物质为岩藻黄素,岩藻黄素纯度为87.01%±0.88%;制备液相纯化后(图9C),杂峰几乎不可见,与标准品图谱(图9D)一致,仅在7.844 min可见一明显岩藻黄素峰,此时,岩藻黄素纯度为99.27%±0.22%。由此可见,硅胶柱层析对提高岩藻黄素纯度有显著效果,适合用于岩藻黄素的纯化生产;制备液相纯化则是良好的高纯度岩藻黄素的获得方法。
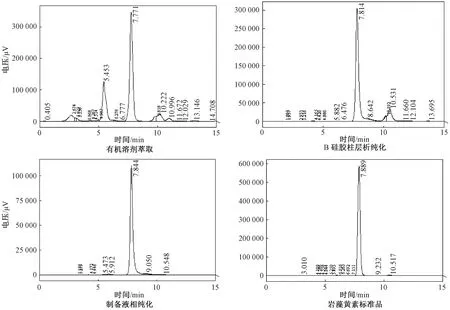
图9 岩藻黄素粗提液、硅胶柱层析纯化、制备液相纯化后和标准品的HPLC图谱Fig.9 HPLC analyses of fucoxanthin in crude extract, after silica column chromatography, after preparative liquid chromatography and standard.
3 讨论
目前,岩藻黄素的提取原料主要为褐藻门的海藻,其中产量比较高的有海带、裙带菜、羊栖菜、马尾藻、鼠尾藻等。近年来陆续有采用铜藻提取岩藻黄素的报道,铜藻作为一种岩藻黄素含量较高的褐藻,越来越被认可作为提取岩藻黄素的优良原料。胡永东等[16]通过70%乙醇溶剂萃取法提取铜藻中的岩藻黄素,在最佳工艺条件(温度70 ℃、时间127 min、料液比68.3 mg·L-1)下,提取率达到0.72 mg·g-1(UV检测);韩典峰等[17]采用超声辅助乙醇提取铜藻中的岩藻黄素,优化得到最佳提取工艺为:乙醇浓度70%,料液比1∶100,起始温度60 ℃,超声时间40 min,此工艺条件下提取率达1.09 2 mg·g-1;严国富等[18]采用超临界CO2法萃取铜藻中岩藻黄素,最佳工艺为:萃取压力27.5 MPa,萃取3 h,夹带剂200 mL,萃取温度35 ℃,此时岩藻黄素萃取率达0.83 mg·g-1; 张怡评等[19]采用超临界CO2法萃取铜藻中岩藻黄素,在样品粉碎粒度80目、萃取温度40 ℃、压力25 MPa、萃取时间30 min的工艺条件下,岩藻黄素提取率为1.12 mg·g-1;李红艳等[20]通过超声辅助有机溶剂萃取法提取铜藻鲜藻中的岩藻黄素,在乙醇浓度90%、超声时间18 min、料液比1∶5、提取温度45 ℃下提取2次,提取率达1.460 3 mg·g-1。上述研究中,除李红艳等[20]外,均采用烘干或冻干后的铜藻干藻作为提取原料。而本研究采用甲醇有机溶剂萃取法提取铜藻鲜藻中的岩藻黄素,提取率为(0.258 9±0.003 6) mg·g-1FW [(1.078 8 ±0.015 0) mg·g-1DW]。这说明,原料产地不同、采样季节不同导致铜藻岩藻黄素的含量可能有所差异,而对原料的预处理方法、检测方法以及提取工艺的不同也会导致结果的不同。
为了与超声辅助有机溶剂萃取法有所比较,采用同一批次的铜藻,应用优化后的铜藻鲜藻超声辅助乙醇提取最佳工艺[20]进行了岩藻黄素提取,提取率为(0.226 5±0.002 1) mg·g-1FW[(0.943 8±0.008 8) mg·g-1DW](数据未发表),比本研究所用的甲醇有机溶剂萃取法提取率低12.51%。通常来讲,超声辅助有机溶剂法具有提取时间短、能耗低、有效成分破坏少、提取率高等特点,但是上述结果与之不符,超声提取率小于有机溶剂提取率,推测可能的原因有:甲醇极性(6.6)高于乙醇(4.3),根据相似相溶原理,其对岩藻黄素的提取率高于乙醇;岩藻黄素不稳定,超声和提取过程温度变化导致降解;由于大量岩藻黄素在褐藻中以岩藻黄素-叶绿素蛋白复合体(fucoxanthin-chlorophyll protein,FCP)形式[23]存在于类囊体膜上,超声过程可能导致蛋白变性,阻碍了岩藻黄素的溶出,具体原因有待进一步验证。
硅胶柱层析法是一种经典的分离纯化技术,具有灵活方便、选择性高、制备量大、成本低等优点,是天然物质和性质相近的物质分离纯化的首选方法之一[21,24-25]。在岩藻黄素纯化方面,王乐等[21]采用硅胶柱层析纯化了从鼠尾藻中提取的岩藻黄素,以石油醚-乙酸乙酯梯度洗脱,纯化后岩藻黄素纯度为86.88%±1.34%,得率为(0.048±0.002) mg·g-1,但未给出岩藻黄素回收率;吴素煌等[26]采用减压硅胶柱层析和制备高效液相色谱制备出3种岩藻黄素异构体,但未给出硅胶柱层析后岩藻黄素的纯度和回收率;周卫松等[27]对裙带菜提取的岩藻黄素进行了硅胶柱层析纯化,正己烷-乙醚洗脱,纯化后岩藻黄素含量为24.2%,回收率90.9%;宋月等[28]采用硅胶柱层析纯化岩藻黄素,以石油醚-乙酸乙酯梯度洗脱,岩藻黄素纯度达70.0%,回收率数据未给出。本研究以石油醚-乙酸乙酯为洗脱剂梯度洗脱,岩藻黄素纯度达87.01%±0.88%,回收率约为68.16%,低于周卫松等[27]的回收率,这可能是由于洗脱方法的不同导致的;较常见的硅胶柱层析回收率(80%以上)[23-25]也偏低,这可能是由于纯化过程较长,且难以做到完全避光,岩藻黄素有所降解。
本研究首先采用有机溶剂法提取铜藻鲜藻中的岩藻黄素,通过单因素实验和正交实验优化提取工艺,得到最佳工艺条件如下:甲醇浓度90%,提取时间1 h,提取温度50 ℃,料液比1∶10。此条件下岩藻黄素提取率达到(0.258 9±0.003 6) mg·g-1FW[(1.078 8±0.015 0) mg·g-1DW]。然后,本研究采用硅胶柱层析法对粗提取的岩藻黄素进行了纯化,通过单因素实验对硅胶柱层析工艺进行优化,最佳工艺条件为:硅胶柱床高度10 cm,上样量6 g,洗脱流速10 mL·min-1,此条件下,岩藻黄素得率为0.176 5 mg·g-1FW(0.735 3 mg·g-1DW),纯度为87.01%±0.88%。最后,采用制备液相对硅胶柱层析后的岩藻黄素进一步纯化,岩藻黄素得率为0.127 1 mg·g-1FW(0.529 4 mg·g-1DW),纯度为99.27%±0.22%。本研究建立了有机溶剂萃取-硅胶柱层析纯化-制备液相纯化的高纯岩藻黄素制备工艺,为高纯度岩藻黄素的制备提供了新的参考。

