苦参异戊烯基黄酮与甘草黄酮联用体外抑菌活性评价及抗小鼠乳腺炎作用研究
曹雅琦,魏丹丹,张森,曾飞,郭盛,郭建明,段金廒
(1.江苏大学药学院,江苏 镇江 212013;2.南京中医药大学中药资源产业化与方剂创新药物国家地方联合工程研究中心,江苏省中药资源产业化过程协同创新中心,国家中医药管理局中药资源循环利用重点研究室,江苏 南京 210023)
苦参为豆科槐属植物苦参SophoraflavescensAit.的干燥根,具有驱虫、消炎、利尿、止泻等多种生物活性[1]。从苦参中分离出的异戊烯基黄酮类化合物对金黄色葡萄球菌、表皮葡萄球菌和枯草杆菌等革兰阳性菌有显著的抗菌作用[2-3]。甘草为豆科甘草属植物甘草GlycyrrhizauralensisFisch.、胀果甘草G.inflataBat.或光果甘草G.glabraL.的干燥根和根茎,含有丰富的黄酮类成分。目前,国内外对甘草黄酮的研究集中在抑菌、免疫、抗肿瘤和抗氧化活性等方面[4-5]。苦参和甘草均为常用中药,二者配伍使用始见于苦参甘草汤,出自《备急千金要方》卷十五,主治疳痢不止。
金黄色葡萄球菌是一种常见的人畜共患病原菌,是引起奶牛乳腺炎的主要病原菌之一[6],其在奶牛乳腺炎中的检出率为17.43%~52.80%[7],给国内外养殖业造成了巨大的经济损失。而近年来由于抗生素的滥用,导致金黄色葡萄球菌耐药性逐渐增强,出现了多种耐药菌株,因此,养殖业迫切需要探索新的抗菌策略来控制耐药菌株的感染。中药具有多组分、多靶点和多作用的特点,在长期临床应用中尚未发现明显的耐药性,从中草药中寻找新型抗菌药物已成为解决细菌耐药性的有效途径[8]。
本研究对苦参异戊烯基黄酮类化合物及甘草黄酮类化合物进行了体内、体外抗菌活性评价,为苦参和甘草的资源价值发现及其综合开发利用提供科学依据,同时为防治奶牛乳腺炎及其他金黄色葡萄球菌感染的日化用品、中成药和中兽药的研发提供参考,并为畜牧养殖业替代抗生素研究提供支撑。
1 材料
1.1 实验菌株
金黄色葡萄球菌Staphylococcusaureus(ATCC 25923),由上海医药工业研究院馈赠。
1.2 实验药材
苦参药材来自内蒙古地区所生产苦参饮片,购自2018年7月,经南京中医药大学段金廒教授鉴定为豆科槐属植物苦参S.flavescens的干燥根,标本现存于江苏省中药资源产业化过程协同创新中心,标本号为SF20180722;甘草药材来源于江阴天江药业,购自2017年10月,经南京中医药大学段金廒教授鉴定为豆科甘草属植物甘草G.uralensis的干燥根及根茎,标本现存于江苏省中药资源产业化过程协同创新中心,标本号为GU20171023。
1.3 实验试剂
LB培养基(LB)、水解酪蛋白培养基(MH)、胰蛋白胨大豆肉汤培养基(TSB)、磷酸盐缓冲溶液(PBS)购自上海源叶生物科技有限公司;甲醇(色谱纯)、甲酸(色谱纯)、乙腈(色谱纯)、无水乙醇(分析纯)、结晶紫(分析纯)购自国药集团化学试剂有限公司;乙酸乙酯(分析纯)购自南京晚晴有限公司;AB-8大孔吸附树脂购自索莱宝有限公司;摇瓶、平皿、康宁全白酶标96孔微孔板购自上海化科实验器材有限公司;超纯水由Millipore超纯水系统提供。
小鼠肿瘤坏死因子-α(TNF-α)、白介素-2(IL-2)、白介素-1β(IL-1β)酶联免疫试剂盒购自南京金益柏生物科技有限公司;苏木素-伊红染液试剂盒购自江苏凯基生物技术股份有限公司;注射用青霉素钠购自江苏省人民医院;兽用青霉素购自久鹏制药有限公司。
1.4 实验动物
BALB/C孕鼠,雌性,SPF级,购自南京市江宁区青龙山动物繁殖场,动物生产许可证号:SCXK(苏)2017-0001;屏障饲养环境系统,温度20~25 ℃,相对湿度40%~70%,换气次数10~20次/h,每日12 h/12 h交替照明;实验期间每日消毒地面、台面和墙面,消毒剂为新洁而灭、来苏尔、乙醇交替使用。
1.5 仪器
DHG-9023A型电热恒温鼓风干燥箱(上海昕仪仪器仪表有限公司),TDL-80-2B型离心机(上海安亭科学仪器厂),FW80型高速万能粉碎机(天津泰斯特仪器有限公司),超净工作台,恒温生化培养箱,Quitix125D电子天平(德国赛多利斯公司),IS-RDV1型恒温振荡器(美国精骐公司),KH-500型超声波清洗器,旋转蒸发仪(瑞士布奇公司)。Waters ACQUITY UPLC系统(美国Waters公司),Waters 2998型PDA检测器(美国Waters公司),Waters Q-TOF Premier飞行时间质谱仪(美国Waters公司),MassLynx 4.1质谱工作站软件(美国Waters公司)。
2 方法
2.1 苦参异戊烯基黄酮、甘草黄酮的制备
干燥苦参药材,粉碎,6倍量乙酸乙酯渗漉提取4次,减压浓缩回收溶剂后,经AB-8大孔树脂柱层析,弃去10%乙醇部位,收集80%乙醇洗脱馏分,浓缩并冷冻干燥,得苦参异戊烯基黄酮富集部位(KSHT)。干燥甘草药材,粉碎,10倍量70%的乙醇加热回流提取3次,乙酸乙酯萃取后萃取物经AB-8大孔树脂柱层析,收集60%醇洗脱馏分,浓缩并冷冻干燥,得甘草黄酮富集部位(GCHT)。黄酮含量测定参照文献[9],以芦丁为对照品,加入5%亚硝酸钠溶液,于500 nm处测定吸光度,KSHT黄酮含量为50.12%,GCHT的含量为41.13%。
2.2 KSHT及GCHT定性分析
采用UPLC-Q-TOF/MS技术对苦参异戊烯基黄酮及甘草黄酮进行定性分析。其中超高效液相色谱部分采用Waters Acquity系统(Waters,Prague,Czech Republic),Waters Acquity UPLC色谱柱(BEH C18100 mm×2.1 mm,1.7 μm),柱温为35 ℃,以A(0.1%甲酸-水)和B(乙腈)为流动相进行梯度洗脱:0~1 min,5%~30% B;1~5 min,30%~50% B;5~14 min,50%~70% B;14~20 min,70%~100% B;流速为0.4 mL/min,进样量为5 μL。Q-TOF-MS离子源采用电喷雾ESI,阴离子模式,扫描时间为1 s,质量范围为m/z100~1 000 ,毛细管电压:2.0 kV,离子源温度:120 ℃,去溶剂化温度:350 ℃,流速:600 L/h,锥孔气流速:50 L/h。
2.3 KSHT及GCHT对金黄色葡萄球菌的抑制作用
2.3.1 KSHT及GCHT对金黄色葡萄球菌最小抑菌浓度(MIC)值测定 参照文献[10]测定供试液对金黄色葡萄球菌的最小抑菌浓度。活化菌株,取A600 nm值为1的菌液用麦氏比浊管稀释至0.5麦氏比浊度,继续稀释1 000倍得到试验用菌液(约为1.5×106U/mL),备用。96孔板4倍稀释法配置苦参异戊烯基黄酮及甘草黄酮不同浓度梯度溶液。以注射用青霉素钠为阳性药物对照,96孔板10倍稀释法配置阳性药不同浓度梯度溶液。苦参异戊烯基黄酮及甘草黄酮的最终浓度梯度为0.39~100 μg/mL,青霉素钠最终浓度梯度为1×10-3~10 μg/mL。菌液加药后37 ℃下培养16 h,用酶标仪于600 nm处检测各孔A(吸光度)值,试验重复3次,每次平行3个复孔,取平均值,计算相应浓度下的抑菌率,以肉眼观测不到菌落生长的浓度为各组相应MIC值。
2.3.2 KSHT及GCHT抑制金黄色葡萄球菌生物被膜及黄素IC50值测定 按2.3.1项下浓度梯度配置各供试液及菌液,于96孔板中37 ℃下培养各加药后菌液及空白菌液36 h,使其被膜生长充分,之后弃去培养基,PBS溶液洗涤,甲醇固定,用0.5%结晶紫染色,加入双蒸水洗涤晾干,加入33%冰醋酸于37 ℃培养箱中溶解后于570 nm处测定A值,计算KSHT及GCHT对金黄色葡萄球菌生物被膜的抑制率及半数抑制浓度IC50值[11]。
按1∶1 000比例吸取对数生长期的金黄色葡萄球菌菌液于TSB培养基中,于96孔板中37 ℃下培养各加药后菌液及空白菌液16 h;之后将菌液于12 000 r/min下离心后弃去上清液,PBS溶液清洗沉淀,离心后弃去上清,重复3次,加入甲醇溶液于55 ℃下水浴加热3 min,之后于12 000 r/min下离心10 min,吸取上清液于96孔板中,于465 nm处测定A值,计算KSHT及GCHT对金黄色葡萄球菌黄素生成的抑制率及半数抑制浓度IC50值[12]。
2.4 KSHT与GCHT联用抑制金黄色葡萄球菌活性评价
采用微量棋盘稀释法[13],于96孔微孔板测定KSHT与GCHT以2×MIC~1/16×MIC的质量浓度联合应用对金黄色葡萄球菌的抑菌效果,计算分级抑菌浓度(FIC)指数。同时,测定各孔600 nm处的吸光度A值:A值大于0.1的标记为绿色,即有菌生长;A值小于0.1的标记为红色,即无菌生长。
FIC指数=MIC(KSHT联合)/MIC(KSHT单用)+MIC(GCHT联合)/MIC(GCHT单用),式中MIC(KSHT单用)和MIC(GCHT单用)分别为KSHT和GCHT单用时的各自的浓度,MIC(KSHT联合)和MIC(GCHT联合)为两药联用时各自的浓度。若FIC指数≤0.5,两药具协同作用;0.5
2.5 KSHT及GCHT体内抗小鼠乳腺炎活性评价
BALB/c孕鼠72只,适应饲养1周,待其分娩后6~8 d,随机分为9组,每组8只:空白对照组,模型组,阳性药组(兽用青霉素),KSHT高、低剂量组,GCHT高、低剂量组,KSHT-GCHT 1∶1联用高、低剂量组,依据药典要求甘草及苦参给药量,换算至小鼠,高剂量给药组灌胃剂量为100 mg/kg,低剂量给药组灌胃剂量为50 mg/kg;模型组及空白组灌胃相同体积的1%吐温-80的生理盐水。小鼠自由饮水,模型组及各给药组于第5对乳房处注射生理盐水稀释的浓度为2.0×104U/mL的金黄色葡萄球菌,每侧50 μL;空白组于相同位置注射相同体积的生理盐水。造模成功后连续给药7 d,各给药组用1%吐温-80的生理盐水溶解,末次给药后脱颈处死小鼠,快速剪开腹部皮肤,观察乳腺组织的病理变化。
2.5.1 乳腺脏器指数及组织病理学评价 称取各组小鼠乳腺组织质量,计算其脏器指数。取第5对乳腺组织一侧置于4%多聚甲醛溶液固定,HE染色,并进行乳腺组织病理学评价。
2.5.2 乳腺组织载菌量及炎症因子测定 另一侧乳腺组织称质量后按每1 g质量加入1 mL无菌生理盐水,冰上研磨为匀浆。各组匀浆液稀释至合理的倍数,取100 μL稀释液涂布平板,置于37 ℃培养箱中培养16~18 h,选择菌落数为30~300的平板进行计数,并换算各小鼠乳腺组织单位质量的载菌量。剩余乳腺组织匀浆液以12 000 r/min离心15 min,取上清液,按照试剂盒说明书,测定各炎症因子水平。
2.6 统计学分析
3 结果
3.1 KSHT及GCHT定性分析
根据UPLC-QTOF/MS质谱信息,参考文献报道[14-24],从KSHT中共鉴定20个黄酮类成分,其中18个为异戊烯基取代黄酮类化合物。从GCHT中共鉴定出22个黄酮类化合物,均为黄酮及二氢黄酮类化合物,结果见表1~2。

表1 苦参异戊烯基黄酮化合物归属

(续表)

表2 甘草黄酮化合物归属
3.2 KSHT及GCHT对金黄色葡萄球菌MIC值的影响
KSHT及GCHT对金黄色葡萄球菌的MIC值分别为25 μg/mL与100 μg/mL;通过比较MIC值及不同剂量下两者抑菌率发现,苦参异戊烯基黄酮的体外抑菌活性优于甘草黄酮,结果见表3。
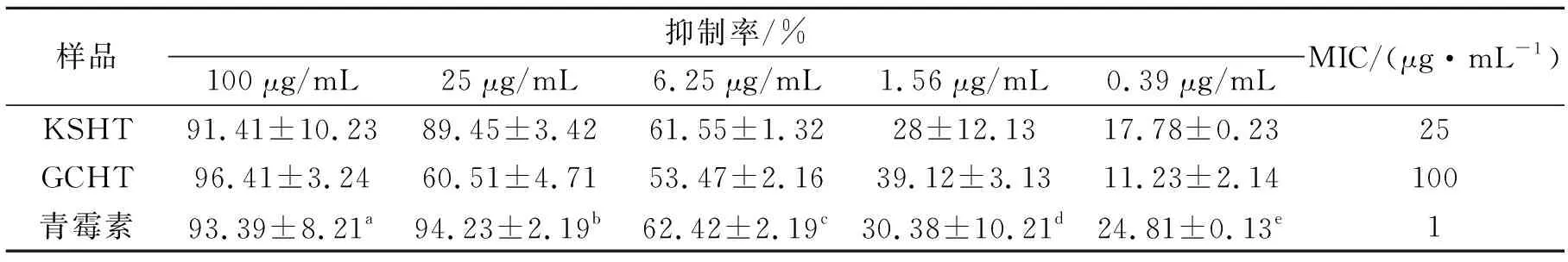
表3 苦参异戊烯基黄酮及甘草黄酮体外抑菌活性
注:青霉素剂量a=10 μg/mL,b=1 μg/mL,c=0.1 μg/mL,d=0.01 μg/mL,e=0.001 μg/mL。
3.3 KSHT与GCHT联用对FIC指数的影响
苦参异戊烯基黄酮(KSHT)与甘草黄酮(GCHT)联用时,对金黄色葡萄球菌的抑制活性见图1。由结果可知,当二者浓度均为各自MIC值的1/4时,两药联合使用表现出显著的抑菌作用。二者联用的FIC指数见表4,由此可知:二者以各自MIC浓度的1/4联用时,对金黄色葡萄球菌生长具有协同抑制作用;二者以各自MIC浓度以上进行联用时,对金黄色葡萄球菌生长具有相加作用。
3.4 KSHT及GCHT对金黄色葡萄球菌生物被膜及黄素生成抑制作用
KSHT及GCHT在体外均有显著的抑制金黄色葡萄球菌生物被膜生成的活性,KSHT对金黄色葡萄球菌的生物被膜IC50值为1.25 μg/mL,GCHT对金黄色葡萄球菌的生物被膜IC50值为2.84 μg/mL,两者1∶1联用时,对金黄色葡萄球菌的生物被膜的IC50值为1.14 μg/mL,KSHT对生物被膜抑制作用优于GCHT,两者1∶1联用时,抑制被膜生长作用优于单用,结果见表5。
KSHT与GCHT在体外均有显著的抑制金黄色葡萄球菌黄素生成的作用,KSHT对金黄色葡萄球菌黄素的IC50值为7.22 μg/mL,GCHT对金黄色葡萄球菌的黄素IC50值为20.35 μg/mL,两者1∶1联用时,对金黄色葡萄球菌的黄素的IC50值为6.41 μg/mL,结果表明,KSHT效果优于GCHT,两药1∶1联用时,其抑制黄素生成活性优于单用,结果见表6。

表4 苦参异戊烯基黄酮与甘草黄酮联合抑菌作用

表5 苦参异戊烯基黄酮及甘草黄酮抑制金黄色葡萄球菌生物被膜生成活性
注:青霉素剂量a=10 μg/mL,b=1 μg/mL,c=0.1 μg/mL,d=0.01 μg/mL,e=0.001 μg/mL。
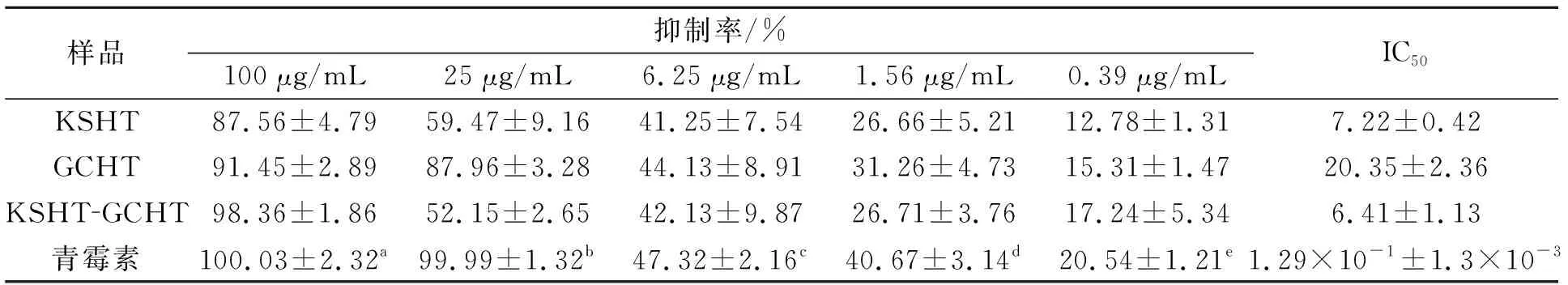
表6 苦参异戊烯基黄酮及甘草黄酮抑制金黄色葡萄球菌黄素生成活性
注:青霉素剂量a=10 μg/mL,b=1 μg/mL,c=0.1 μg/mL,d=0.01 μg/mL,e=0.001 μg/mL。
3.5 苦参异戊烯基黄酮及甘草黄酮抗小鼠乳腺炎的作用
3.5.1 组织病理学观察 组织病理学观察表明:空白对照组小鼠乳腺组织无异常病理变化,间质无明显炎症浸润(图2A);模型组小鼠乳腺腺泡病变明显,腺泡明显增生,腺泡腔内可见大量炎性细胞碎片,炎症细胞类型多样,以嗜中性粒细胞为主(图2B)。相比模型组,各给药组均有不同程度的改善,两药联用效果优于各自单用:KSHT高剂量组乳腺腺泡上皮细胞轻微剥脱,无显著炎性细胞浸润(图2C);KSHT低剂量组乳腺腺泡上皮细胞轻微剥脱,间质中度炎性细胞浸润,以嗜中性粒细胞为主(图2D)。GCHT高剂量组乳腺组织无异常病理变化,乳腺腺泡上皮细胞轻微剥脱(图2E);GCHT低剂量组乳腺间质轻微炎性细胞浸润,以嗜中性粒细胞为主(图2F)。KSHT-GCHT(1∶1)联用高剂量组仅见乳腺腺泡上皮细胞轻微剥脱,无显著炎性细胞浸润(图2G);KSHT-GCHT(1∶1)联用低剂量组乳腺腺泡上皮细胞轻微剥脱,间质轻微炎性细胞浸润,以淋巴细胞为主(图2H)。阳性药组乳腺组织仅有间质轻度炎症细胞浸润(图2I)。
3.5.2 乳腺组织脏器指数、载菌量及炎症因子含量的测定 脏器指数结果显示:相比空白组,模型组小鼠乳腺指数显著增加,可能与炎症所致的红肿热痛相关;与模型组相比,阳性药组、GCHT高剂量组、KSHT高剂量组以及KSHT与GCHT1∶1联用组小鼠乳腺指数显著下降,提示各治疗组均可不同程度改善乳腺炎小鼠乳腺的红肿热痛,其中KSHT与GCHT1∶1联用组优于两者单用。各组乳腺组织载菌量结果显示:与空白组相比,模型组小鼠乳腺载菌量显著增加;与模型组相比,各给药组小鼠乳腺载菌量均下降。其中,GCHT组效果优于KSHT组,KSHT与GCHT联用组效果最优,优于两者单用(表7)。炎症因子测定结果显示:金黄色葡萄球菌造模后,模型组小鼠乳腺组织IL-1β、IL-2和TNF-α含量均显著上升,IL-1β与TNF-α的含量增加尤其显著。二者单用时,甘草黄酮GCHT各剂量组对IL-1β、IL-2和TNF-α的降低作用均优于同剂量下的苦参异戊烯基黄酮组KSHT,与相同剂量的二者联用组抗炎效果相当或略有优势。对于IL-2的调控,KSHT组单用时与模型组相比未有显著差异,与GCHT联用后对IL-2有显著下调作用,且效果优于GCHT单用。对于TNF-α的调控作用,KSHT与GCHT1∶1联用组的下调作用要优于KSHT单用组,KSHT与GCHT1∶1联用组对各炎症因子的下调作用均优于KSHT单用,略优于GCHT单用(表7)。

表7 乳腺炎小鼠乳腺脏器指数、载菌量及组织炎性指标
4 讨论
我国是养殖业大国,饲料中添加抗生素的兴起使动物养殖业的发展进入一个新的阶段,但抗生素过量、超量使用的情况严重制约我国养殖业的绿色可持续发展[25]。抗生素滥用,导致细菌耐药性逐渐增强,如耐甲氧西林金黄色葡萄球菌的出现,严重威胁人、畜安全。根据我国农业部《兽药管理条例》《饲料和饲料添加剂管理条例》有关规定,自2020年1月1日起,已发布停止生产、进口、经营、使用部分药物饲料添加剂,主要包括土霉素预混剂、土霉素钙预混剂、亚甲基水杨酸杆菌肽预混剂、那西肽预混剂、杆菌肽锌预混剂、恩拉霉素预混剂、喹烯酮预混剂、黄霉素预混剂、黄霉素预混剂(发酵)、维吉尼亚霉素预混剂等10种添加剂。绿色环保的无抗养殖新体系将逐渐成为养殖业的主流趋势,因此,研究出无耐药性的饲用添加剂成为新时代养殖行业的重中之重[26]。文献报道[27],苦参异戊烯基黄酮对金黄色葡萄球菌、表皮葡萄球菌和枯草杆菌等革兰阳性菌有显著的抗菌作用;甘草黄酮具有抗氧化、抗菌、抑制炎症反应、降血脂、抗肿瘤等作用,能够有效地预防和改善细菌感染、溃疡等多种疾病[28]。因此,从中药及天然药物中寻找新型替代抗生素类饲料添加剂成分是行业共识和必由之路;同时,同为豆科根茎类药用植物,苦参和甘草主要分布于我国生态环境较为脆弱的西北地区,长期的挖根取药势必进一步加剧当地的生态恶化,因此对其进行资源综合利用,实现资源的吃干榨尽符合绿色、可持续发展战略。
本研究对苦参异戊烯基黄酮类化合物及甘草黄酮类化合物以及两者联用进行了体内、体外抗菌活性评价,为苦参和甘草的资源价值发现及其综合开发利用提供科学依据,同时为防治奶牛乳腺炎及其他金黄色葡萄球菌感染的日化用品、中成药和中兽药的研发提供参考,并为畜牧养殖业替代抗生素研究提供支撑。

