表面活性剂对微黄分支杆菌CP13降解芘特性的影响
刘沙沙,付建平,伍凤姬,郭楚玲,党志*
1.肇庆学院环境与化学工程学院,广东 肇庆 526061;2.华南理工大学环境与能源学院,广东 广州 510006;3.生态环境部华南环境科学研究所,广东 广州 510655
芘是含4个苯环的多环芳烃(PAHs)的代表化合物,其能在环境中长期存在,且检出浓度较高(张俊叶等,2017;黄河等,2019)。芘具有致癌、致畸和致突变性,会对生态环境和人类健康造成严重威胁。微生物修复由于具有成本低、无二次污染等优势已发展成为一种高效治理PAHs污染的方法。然而,芘的强亲脂性导致其生物可利用性较低,这就限制了生物降解的效果。表面活性剂由于具有亲水亲油的两相结构,能进一步提高芘在水相中的溶解度,被用作增效剂来促进芘的生物降解过程(Zhang et al.,2013;王鸣等,2016)。但是,近年来的一些研究发现表面活性剂并未影响或抑制了芘的生物降解(Mohanty et al.,2012;Zhang et al.,2013;倪贺伟,2014)。
表面活性剂发挥作用的程度与其种类和特性相关(Zhang et al.,2013;Liu et al.,2016;Xu et al.,2018),但是不同类型表面活性剂对菌体细胞特性和降解芘的影响尚缺乏系统的研究。本文以微黄分支杆菌Mycobacterium gilvum.CP13为实验菌株,研究了生物型(皂素)、非离子型(Tween80、TritonX-100、Brij30)、阴离子型(SDS)和阳离子型(CTMAB)表面活性剂对CP13降解芘的影响,并初步探讨了相应的影响机制,以期为增效微生物修复PAHs污染环境时选择合适的表面活性剂提供理论依据。
1 材料与方法
1.1 实验材料
试剂:芘,纯度>98%;聚氧乙烯月桂醚(Brij30)、聚乙二醇辛基苯基醚(TritonX-100)、十二烷基硫酸钠(SDS)、十六烷基三甲基溴化铵(CTMAB),纯度>99.9%,均购于Sigma-Aldrich试剂公司。聚山梨酯-80(Tween80),皂素(Saponin)纯度>99.5%,购于天津科密欧化学试剂公司。表面活性剂和芘的性质见表 1。甲醇、乙腈和丙酮均为色谱级,购于上海安谱实验科技有限公司,其它化学试剂购自于广州化学试剂公司,AR级。
菌种:芘降解菌为微黄分支杆菌(Mycobacterium gilvum.CP13),是课题组前期从韶关石化厂焦化废水活性污泥中筛选得到的革兰氏阳性菌,橘黄色,短杆状,菌落光滑,球型,大小约为1.03×0.34 μm。2013年7月22日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCC NO.7963(党志等,2014)。
1.2 培养基和溶液的配制
无机盐培养基(MSM)的组成如下:5 mL磷酸盐溶液(KH2PO48.5 g·L-1,K2HPO4·H2O 21.75 g·L-1,Na2HPO4·12H2O 33.4 g·L-1,NH4Cl 5.0 g·L-1);3 mL MgSO4溶液(22.5 g·L-1);1 mL FeCl3溶液(0.25 g·L-1);1 mL CaCl2溶液(36.4 g·L-1);1 mL 微量元素液 (MnSO4·H2O 39.9 g·L-1, ZnSO4·7H2O 42.8 g·L-1,(NH4)6Mo7O24·4H2O 34.7 g·L-1),定容至 1 L,pH为7.2—7.4。
芘储备液:以丙酮为溶剂配制1 g·L-1的芘母液,分别取1 mL加入到进行降解反应的摇瓶中,放置 12 h,让丙酮完全挥发,使芘的质量浓度为50 mg·L-1。
菌悬液配制:将菌体接种于含芘(50 mg·L-1)的MSM培养液中,30 ℃,150 r·min-1预先培养5 d,6000 r·min-1离心 5 min,收集菌体,0.01 mol·L-1的磷酸盐缓冲液(PBS)洗涤3次,重悬于250 mL MSM培养液中,调节OD600=0.8,用做后续实验的菌液(伍凤姬等,2014)。
1.3 表面活性剂对菌CP13生长和芘降解的影响
将菌悬液(见“1.2”)按体积分数=10%的比例加入到含有50 mg·L-1芘的MSM培养体系(20 mL)的摇瓶中,皂素、Tween80、TritonX-100、Brij30、SDS和CTMAB的浓度分别设定为其0、0.2、1、2、4和 8倍的 CMC值,每个处理设 3个重复。30 ℃,150 r·min-1避光振荡培养,设置不加菌的对照组,定时取样(0、1、2、3、4、5、6 d)分析芘的残余浓度和CP13的生长量,生长量采用平板菌落计数法测定。
芘浓度的测定参考伍凤姬等(2014)的方法:在芘降解后的摇瓶中加入适量的甲醇(色谱级),超声处理(250 W)30 min,确保其中的芘完全溶解于甲醇后,将其转移到50 mL容量瓶并用甲醇定容,利用孔径为0.22 µm的有机相针式过滤器过滤后,进高效液相色谱仪(Agilent 1200)测定芘的浓度,波长为 234 nm,流动相为甲醇/超纯水(V∶V=90∶10),进样量 20 μL,流速 1 mL·min-1,停留时间为 4 min。芘的降解率计算公式为:

式中,ρi为不添加菌的对照组中芘的初始质量浓度,ρa为不添加菌的对照组中芘的残留质量浓度;ρmi为处理组中芘的初始质量浓度,ρma为处理组中芘的残留质量浓度。

表1 表面活性剂和芘的特性1)Table 1 Properties of surfactants and pyrene
1.4 流式细胞仪检测CP13细胞活性
SYTO9是一种能够染色细胞膜完整及受损的细胞的绿色荧光核酸染料,而红色的PI染料只能进入细胞膜通透性改变或者膜结构受损的细胞。当两种染料同时存在时,PI染料会对SYTO9的荧光强度产生一定的削弱作用,可利用两者的光谱特征和对细胞染色能力的差异,结合流式细胞仪检测各降解体系中完整、受损和死亡细胞的比例,从而可以确定菌体细胞的活性(Olszewska et al.,2019)。
反应体系中芘基本降解完后(6 d),20 ℃,6000 rpm,离心10 min,收集CP13菌体,用0.01 mol·L-1的PBS溶液洗涤3次,重悬于1mL PBS溶液中(菌密度调为 106CFU·mL-1),加入 3 µL 混合均匀的SYTO9 /PI染色液(比例为1∶1),室温下避光反应15 min后上流式细胞仪检测。
本实验所用流式细胞仪为 BD FACSAria型(BD,USA),其运行条件和检测参数见表2。PI的红色荧光和 SYTO9的绿色荧光的检测激发光分别为670 nm和530/30 nm,进样流速为10 µL·min-1,每个样品计数10000个细胞左右,利用FACSDiva software软件对数据进行记录和分析。

表2 BD FACSAria流式细胞仪检测参数Table 2 Operating conditions and settings of BD FACSAria flow cytometer
1.5 细胞表面疏水性(CSH)的测定
CSH参照菌体黏着碳烃化合物法(MATH)进行测定(Owsianiak et al.,2009),各培养体系6000 rpm,离心10 min,弃上清液,PBS溶液洗涤菌体3次,重悬,制成菌悬液(OD600,i=1)。取8 mL菌悬液于分液漏斗中,加入4 mL正十六烷,剧烈震荡1 min,静置30 min,收集下层水溶液,测定600 nm的吸光度值(OD600,a),计算公式如下:

2 结果与讨论
2.1 表面活性剂对CP13生长的影响
在CP13降解芘的过程中,不同类型表面活性剂的加入对菌生长的影响存在差异(图1)。皂素和Tween80对CP13的生长均起到促进作用,说明这两种表面活性剂对菌CP13没有毒害作用。皂素的浓度越高,对CP13生长的促进作用越大,在8 CMC时生物量达到最大值 4.95×108CFU·mL-1。随Tween80浓度从0.2—2 CMC增加,促进作用越强,而在高浓度时(4和8CMC),促进作用减少。但在添加TritonX-100、Brij30、SDS和CTMAB的反应体系中,菌CP13的生长受到了抑制,抑制程度与它们的添加浓度成正比。另外,这几种表面活性剂产生抑制作用的大小程度为CTMAB>SDS>Brij30>TritonX-100。
2.2 表面活性剂对CP13细胞活性的影响
利用121 ℃高压蒸汽灭菌的CP13细胞作为PI阳性对照,培养至对数期的菌体细胞作为SYTO9阳性对照,未染色的细胞为阴性对照,确定死亡、受损及完整细胞在流式图中所处的位置(张梦露等,2014),如图2所示。
高浓度(8 CMC)的Tween80、TritonX-100、Brij30、SDS、CTMAB对降解体系中完整、受损和死亡细胞比例的影响如图3所示。与未添加表面活性剂的体系相比,在添加8 CMC Tween80后,完整细胞的比例减少了 4.7%,受损细胞的比例增加了6.1%,但是,死亡细胞的比例几乎没有发生变化(图3c)。Zhang et al.(2012)指出 Tween80与细胞膜中流动的磷脂结合能力较弱,避免了对磷脂双分子层的扰动,属于不具备溶膜特性的非均质型表面活性剂。Liu et al.(2016)的研究证明了流式细胞仪分析中 Tween80是通过增大细胞膜的通透性而增加了受损细胞比例。同样的,添加皂素后受损细胞的比例增加了7.9%,死亡细胞变化不大(图3b)。已有的研究表明皂素对微生物没有毒性(Kaczorek et al.,2008;Lin et al.,2017,Davin et al.,2017),但能够增大细胞膜的通透性(Pijanowska et al.,2007)。本研究中 Tween80和皂素只是使CP13的细胞膜通透性增加,并没有损坏细胞膜的结构而导致死亡,处于受损区间的细胞仍然保持活性。因此,添加 Tween80和皂素后增加了降解体系中活性细胞的比例,比未添加表面活性剂时分别增加了2.1%和1.4%。
TritonX-100、Brij30、SDS和CTMAB的加入均导致了死亡细胞的比例增多(图3d—g),分别为6.2%、9.5%、46.7%和67.1%,说明这几种表面活性剂对菌CP13产生了毒害作用,且CTMAB的毒性最大。TritonX-100和Brij30是容易与细胞膜中的磷脂分子发生互溶的均质型表面活性剂(Nazari et al.,2012),当表面活性剂的浓度达到溶菌浓度时,逐渐将磷脂增溶至液相,形成混合胶束,导致细胞膜逐渐收缩至瓦解消失(Zhang et al.,2013)。Liu et al.(2016)研究指出 Brij30对细胞膜的溶解和破坏能力要大于TritonX-100,因此Brij30的毒性作用要大于TritonX-100。本研究中,添加Brij30后对菌CP13生长和活性的抑制作用要大于TritonX-100。SDS是一种细胞壁抑制剂,能够与细胞壁、细胞膜发生物理化学作用,破坏微生物细胞结构的完整性(Garon et al.,2002;李登宇,2016),因此降低了CP13的细胞活性甚至导致其死亡。CTMAB是季铵盐化合物,由于菌体细胞表面带负电荷,CP13通过静电吸引力对CTMAB有很强的吸附作用,不仅阻碍了菌对芘的吸收,而且CTMAB对细胞膜和细胞壁有损伤作用,还对导致菌体蛋白质变性(Rodrigues et al.,2013),有很强的杀菌作用,从而使菌CP13大量死亡。

图2 菌体CP13细胞的阴性对照及阳性对照Fig.2 The dot plots of negative and positive control
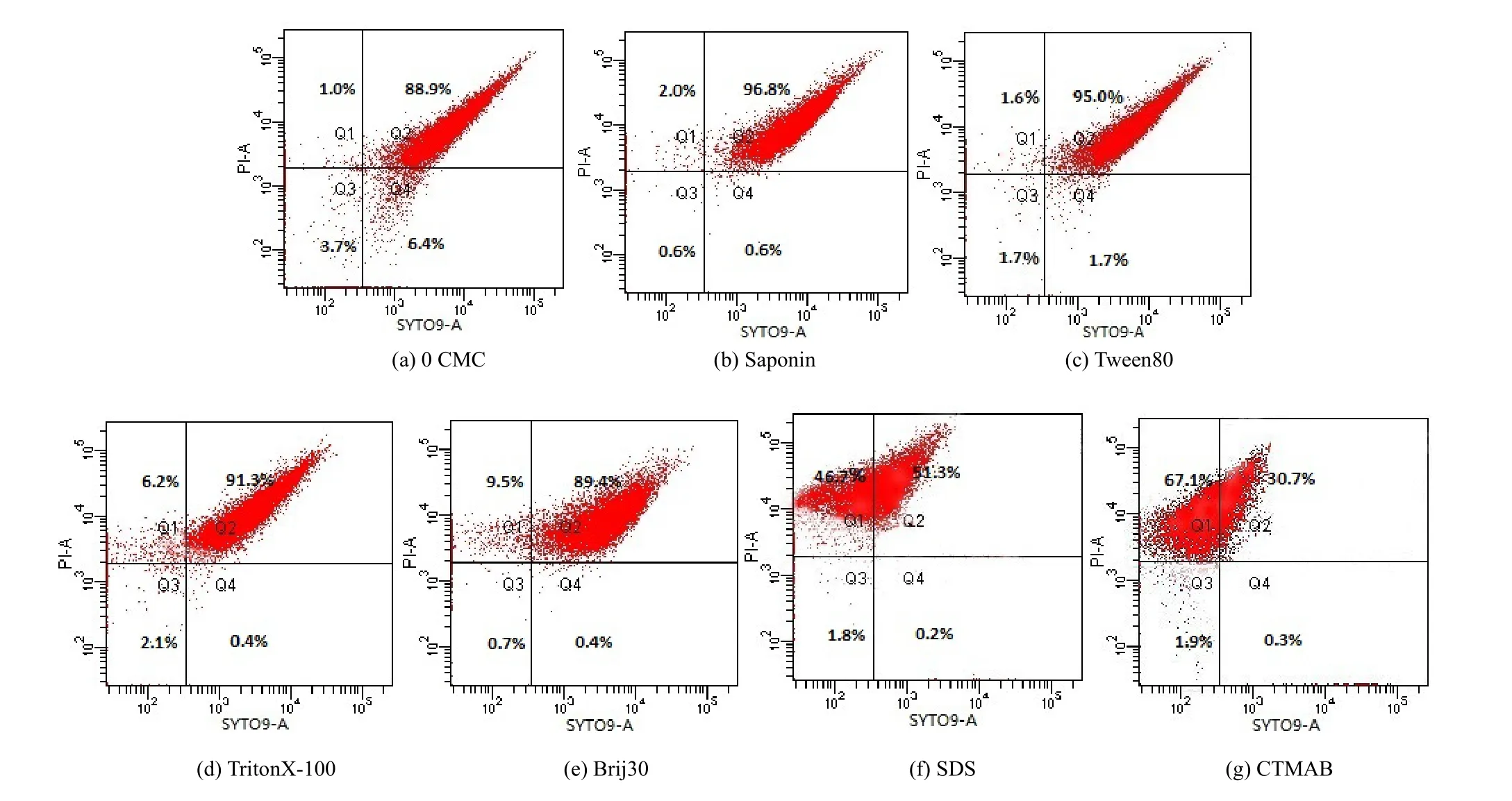
图3 CP13降解芘过程中表面活性剂对细胞活性的影响Fig.3 Effects of surfactants on the cell activity of CP13 during pyrene biodegradation
通过对表面活性剂作用下CP13的生长情况和单细胞特征的分析可知,皂素和Tween80对CP13没有毒害作用,并且可以促进CP13的生长和活性,皂素的增效作用要大于 Tween80。TritonX-100、Brij30、SDS和CTMAB能够损害细胞结构,对CP13的生长和活性产生抑制作用。研究指出(李峰,2014;Jin et al.,2017)对菌的毒性大小按生物表面活性剂、非离子表面活性剂、阴离子表面活性剂、阳离子表面活性剂的顺序而增强。本文结果与此结论一致,六种表面活性剂对CP13毒性作用大小的顺序为 CTMAB (阳离子)>SDS (阴离子)>Brij30 (非离子)>TritonX-100 (非离子)>Tween80 (非离子)>皂素 (生物表面活性剂)。
2.3 表面活性剂对CP13细胞表面疏水性的影响
细胞表面疏水性(CSH)是决定细菌与芘亲和性的重要参数,影响着菌体对芘的吸附,由于表面活性剂同时具有疏水基和亲水基,因此可以调节CSH,影响菌体对 PAHs的摄取和降解。皂素、Tween80、TritonX-100、Brij30、SDS和CTMAB的加入改变了CP13的CSH(见图4),CSH变化趋势取决于表面活性剂的类型和浓度。低浓度的皂素、Tween80和TritonX-100提高了菌株CP13的CSH,Tween80在1CMC达到最大值,皂素和TritonX-100在0.2 CMC达到最大值,随着浓度的增加,CSH逐渐下降。然而,Brij30、SDS和CTMAB降低了CP13的CSH,添加浓度越高,CSH的下降幅度越大。同样,Rodrigues et al.(2013)和 Azeredo et al.(2003)的研究也发现,SDS和CTMAB降低了菌的CSH。

图4 表面活性剂对CP13细胞表面疏水性(CSH)的影响Fig.4 Effects of surfactants on the cell surface hydrophobicity (CSH) of CP13 during pyrene biodegradation
表面活性剂主要通过两种方式来改变菌体的CHS:(1)表面活性剂分子在细胞表面的吸附/分配作用,通过改变细胞表面亲水疏水电位的比例而使CSH发生变化,这种方式是可逆的,在一定程度上可以通过多次水洗脱附使细胞的 CSH恢复到初始水平(张栋,2013);(2)表面活性剂诱导脂多糖从细胞膜外层释放,由于脂多糖分子中位于细胞外侧的O-抗原为亲水结构,它的脱附会使细胞外膜疏水点位暴露(Liu et al.,2014),这会造成细胞膜破损甚至瓦解消失,是不可逆的过程。研究证明(Pijanowska et al.,2007;张栋,2013),皂素和Tween80主要是吸附在菌体表面来改变其CSH,两者与细胞之间的吸附力是疏水作用的范德华力,不会对细胞膜产生破坏作用,这与流式细胞仪的结果基本一致。TritonX-100、Brij30、SDS和CTMAB具有溶膜毒性,会导致细胞膜组分的流失,包括亲水性的脂多糖和疏水性的膜蛋白等(Garon et al.,2002;Rodrigues et al.,2013;Liu et al.,2016),我们推测它们改变菌体的 CSH是吸附和脱附脂多糖共同作用的结果,但是到底是哪种作用占主要地位,还需做进一步的研究。此外,鉴于这四种表面活性剂会导致CP13细胞活性的降低,处于游离分散或半休眠状态,这可能也是引起CP13的CSH降低的原因之一。
李峰(2014)的研究发现表面活性剂能够增加降解菌的CSH而增加菲在菌体细胞上的分配作用。本研究中皂素、Tween80、TritonX-100、Brij30、SDS和CTMAB对菌体CSH的影响规律与其对CP13降解能力的影响相似,这些现象表明表面活性剂通过改变CSH,影响芘的生物可利用性,改变了CP13细胞与芘的亲和力,从而影响了菌对芘的吸附和降解效果。
2.4 表面活性剂对CP13降解芘的影响
图5显示了不同种类和浓度的表面活性剂对芘降解过程的影响呈现不同的方式。添加量为0.2和1 CMC的Tween80对芘降解有促进作用,反应6 d后,降解率分别达到了90.6%和96.1%,在1CMC时达到最大值;高浓度(4CMC和 8CMC)的Tween80显著抑制了芘的降解。与本结果相似的是,Zhang et al.(2013)的研究发现低浓度的Tween80能够促进芘的降解,在浓度为 1 CMC时促进效果最好。结合CP13细胞特性的变化,推测出Tween80影响芘降解的原因:Tween80对CP13细胞没有毒害作用,可以促进CP13的生长和细胞活性,使反应体系中活性细胞的比例增加,另外,低浓度的Tween80能够增强CSH,提高了菌体和芘的亲和性,从而促进CP13对芘的摄取和降解;Tween80的添加浓度较高时,CSH值降低,菌对芘的吸附能力减弱,芘被包裹在胶束内部,微生物对芘的利用率也降低,因此抑制了菌对芘的降解。然而,Ghosh et al.(2016)的研究指出细菌摄取反应体系中游离态的芘与降解菌的 CSH有关,在表面活性剂添加浓度较高时,菌摄取胶束中芘的能力与表面活性剂的增溶能力和胶束中的芘向水相中转移的速度有关,与菌体的CSH无关。这与本文的研究结果不同,可能是因为表面活性剂和菌的种类不同引起的。

图5 表面活性剂对CP13降解芘的影响Fig.5 Effects of surfactants on the pyrene biodegradation by CP13
皂素和 TritonX-100影响 CP13降解芘的趋势基本相同,在0.2 CMC时促进效果最好,但皂素的增效作用明显大于TritonX-100,皂素使芘的降解率提高了10.7%,浓度高于2 CMC时,呈现出显著的抑制作用。然而,Soeder et al.(1996)的研究发现添加50 CMC的皂素加快了假单胞菌对菲和荧蒽的降解速率。与Tween80一样,皂素对CP13不具有毒性作用,而且增强了CP13的生长和活性。由于皂素具有特殊的分子结构,添加浓度低于其 CMC值时可以增加细胞膜通透性,促使更多的污染物进入细胞内被降解(Zhou et al.,2011)。因此,0.2 CMC皂素增强了CP13对芘的降解主要是由于其增强了细胞膜通透性和CSH,随着添加浓度的增加,CSH逐渐减小,降低了菌体细胞与芘的亲和力,菌对芘的吸附和降解能力减弱。0.2 CMC TritonX-100对芘的降解起到了轻微的促进作用,浓度越高,对芘生物降解的抑制作用越大。Zhang et al.(2013)却发现 0.2—8 CMC浓度范围的 TritonX-100均抑制了芘的降解,因为 TritonX-100会破坏细胞膜导致菌体细胞无法正常维持或充分发挥其降解功能。本研究2.2中的分析也证实了TritonX-100对菌CP13的溶膜毒性,但浓度为0.2CMC时还未对细胞膜造成严重破坏,同时增加了CSH,有利于菌对芘的吸附和降解。
Brij30、SDS和CTMAB抑制了菌CP13对芘的降解,Brij30添加浓度越高,抑制作用越大;添加0.2 CM的SDS时芘还能部分被降解,随浓度增加,芘几乎不再降解;即使添加低浓度的CTMAB,也会对芘的降解产生明显的抑制作用,在添加量为0.2—8 CMC范围内,芘的降解率接近0。这3种表面活性剂对菌 CP13具有毒性作用,不仅抑制了CP13的生长,而且能够破坏细胞表面结构加快了细胞的死亡,添加Brij30、SDS和CTMAB后导致反应体系中活性细胞的比例减少甚至失活,而且还降低了CP13的CSH值,阻碍了菌体对芘的吸附,从而使芘的降解受到抑制。此外,三者对CP13毒性作用的大小为CTMAB>SDS>Brij30,因此CTMAB对芘降解的抑制作用最明显。
3 结论
(1)皂素和Tween80对CP13没有毒害作用,可以促进CP13的生长和细胞活性。TritonX-100、Brij30、SDS和CTMAB会损害细胞结构,导致死亡细胞的比例明显增多,对菌CP13具有毒性。
(2)低浓度的皂素、Tween80和TritonX-100增大了CP13的CSH,随着浓度的增加,CSH逐渐减小;添加Brij30、SDS和CTMAB后,菌株的CSH呈下降趋势,浓度越高,CSH的下降幅度越大。
(3)浓度为0.2、1 CMC的Tween80促进了芘的降解,1CMC时芘的降解率提高了 10.3%;0.2 CMC皂素和TritonX-100分别明显、轻微的促进了CP13对芘的降解,在较高浓度时表现出抑制作用;随Brij30和SDS添加浓度的增加对芘降解的抑制作用越明显;添加CTMAB后,芘的生物降解几乎完全被抑制。
(4)皂素、Tween80、TritonX-100、Brij30、SDS和CTMAB影响菌CP13的降解与其CSH的变化规律基本一致,其可以通过改变CSH,影响菌体对芘的吸附和摄取。此外,表面活性剂对菌体细胞的毒性作用,也是影响芘降解效果的原因之一。

