SUMO特异性蛋白酶3通过调控巨噬细胞极化促进磷酸钙诱导的小鼠腹主动脉瘤形成*
陈 阳, 张永兴, 倪焕尔, 李伟峰, 汪 芳
(上海交通大学附属第一人民医院心内科,上海200080)
腹主动脉瘤(abdominal aortic aneurysm,AAA)是腹主动脉的永久性局部扩张至正常腹主动脉直径的150%[1]。临床AAA多发生在肾下动脉处[2];破裂性AAA及其导致的相关病理生理损害的死亡率超过80%[3]。目前除了手术修复,尚无药物可以治疗。因此,探究AAA的病理生理学调控机制,对于临床腹主动脉瘤的药物防治靶点研发具有重要意义。
在AAA中,病理改变可见血管平滑肌细胞的凋亡和缺失、炎症细胞的浸润以及基质金属蛋白酶(matrix metalloproteinases,MMPs)表达上调等引发弹性蛋白断裂和细胞外基质(extracellular matrix,ECM)的降解[4]。单核-巨噬细胞是参与AAA免疫应答重要的炎症细胞,在特定的免疫微环境下,骨髓单核细胞(M0)可以分化为促炎的巨噬细胞(M1型)或抗炎的巨噬细胞(M2型)[5]。而MMPs和许多促炎症反应因子,如肿瘤坏死因子α(tumor necrosis factorα,TNFα)等,由M1型巨噬细胞分泌产生,而M2型巨噬细胞则分泌抗炎细胞因子,如白细胞介素10(interleukin-10,IL-10)等。巨噬细胞M1/M2的失衡被认为是AAA发生发展的重要环节[6],同时也有研究报道巨噬细胞极化可以调控新生血管形成[7]。巨噬细胞在AAA免疫应答中发挥至关重要的作用[8],因此调控巨噬细胞极化的信号通路对于研究AAA发病机制具有重要意义。
SUMO(small ubiquitin-related modifier)是一系列重要的类泛素蛋白,能对底物进行翻译后SUMO修饰(SUMOylation)[9]。SUMO 修饰是一个可逆过程,SUMO特异性蛋白酶家族(sentrin/SUMO-specific proteases,SENPs)能够去除底物蛋白的SUMO修饰,或影响底物与其它蛋白质的相互作用,从而影响底物的生物学效应。有研究表明,SENP3敲除减少了脂多糖(lipolysaccharide,LPS)诱导的巨噬细胞Toll样受体(Toll-like receptor,TLR4)炎症信号的激活和促炎因子的产生,提高小鼠存活率[10]。目前已有证据显示TLR4炎症信号的激活能促进巨噬细胞的极化,加重炎症损伤[11-12]。此外,TLR4激活促进AAA的调控关系也已被证明[13]。但SENP3在AAA病程中对巨噬细胞极化的影响尚不清楚。
本课题组构建SENP3单核细胞特异性敲除的小鼠,并通过磷酸钙(calciumphosphate,CaPO4)诱导的AAA动物模型,探讨SENP3通过影响巨噬细胞的功能在AAA发生发展中的作用,以期进一步阐释调控AAA发生和进展的潜在机制。
材料和方法
1 动物
C57BL/6野生型(wild type,WT)小鼠购于上海斯莱克动物公司。C57BL/6背景的Senp3flox/flox(以下简称WT)小鼠由南京大学模式动物研究中心产生,与C57BL/6背景的Lyz2-Cre小鼠杂交产生Senp3flox/flox;Lyz2-Cre(SENP3单核细胞特异性敲除,即条件性敲除,conditioned knockout,cKO)小鼠。严格按照中华人民共和国科学技术部发布的《实验室动物的护理和使用指南》中的规定进行动物实验,该方案已获得上海交通大学医学院附属机构动物护理和使用委员会的批准[使用许可证号为SYXK(沪)2018-0027],所有手术均在戊巴比妥钠麻醉下进行,并尽一切努力使动物痛苦最小化。本研究选用SPF级cKO小鼠以及同窝出生的WT小鼠,雄性,8~12周龄,体重20~22 g。小鼠饲养于上海交通大学医学院动物实验中心,饲以国家标准啮齿类动物饲料,温度为(23±2)℃,湿度为50%±10%。
2 主要试剂
小鼠SENP3、β-actin、IL-1β和IL-6抗体购自Cell Signaling Technology;小鼠 CD206、CD86和 TNFα 抗体购自Abcam;小鼠MMP-9抗体购自Affinity;荧光素标记的II抗(Alexa Fluor®488标记的山羊抗鼠IgG、Alexa Fluor®555标记的山羊抗鼠IgG、Alexa Fluor®488标记的山羊抗兔IgG和Alexa Fluor®555标记的山羊抗兔IgG)购自Invitrogen;生物素化羊抗小鼠IgG(1∶500)和生物素化羊抗兔IgG(1∶500)购自Jackson;免疫组化显色试剂盒购自Vector Laboratories;胎牛血清(fetal bovine serum,FBS)购自Gibco;鼠源巨噬细胞集落刺激因子(macrophage colony-stimulating factor,M-CSF)购自PeproTech;多聚甲醛购自Sigma;Western blot化学发光显色剂购自中国上海圣尔生物科技有限公司;二水氯化钙(calcium chloride dihydrate,CaCl2·2H2O)、磷 酸 盐 缓 冲 液(phosphatebuffered saline,PBS)和Tween-20购自中国生工生物工程(上海)股份有限公司;TBS缓冲液购自上海索莱宝生物科技有限公司;二氢乙啶(dihydroethidium,DHE)染色液购自中国上海碧云天生物技术有限公司;戊巴比妥购自Sigma。
3 主要方法
3.1 改良磷酸钙诱导的小鼠肾下AAA模型 参照现有研究,相对于传统CaCl2模型,改良方法依次使用CaCl2和PBS诱导产生动脉瘤所需时间较短[14]。我们选用同窝出生、C57BL/6背景的8~12周龄雄性小鼠,按基因型分成2组:WT组(n=20)和cKO组(n=18)。小鼠在戊巴比妥(100 mg/kg)麻醉下,无菌环境里先用0.5 mol/L CaCl2浸泡的棉球包裹游离的腹主动脉孵育10 min,随后改用PBS浸泡的棉球孵育5 min。消毒纱布小心吸干残余液体,用无菌生理盐水冲洗腹腔,减少其余组织损伤,结扎出血点,关腹部缝合。造模时间为14 d。手术操作交由未知小鼠基因型与具体分组的人来完成。
3.2 实验小鼠标本的收集、处理和保存 在术后第2周,戊巴比妥麻醉小鼠后剖腹,体式显微镜下小心暴露腹主动脉,剥离腹主动脉动脉周围筋膜和脂肪组织,游离升主动脉至腹主动脉髂总动脉分叉处,游标卡尺测此处动脉直径。部分标本放入冻存管中存放于液氮罐中,用于提取组织RNA进行RT-qPCR实验,以及提取组织蛋白进行Western blot实验。另一部分标本在操作过程中小心保持形态完整,在4%多聚甲醛溶液中固定48 h,再分成两部分:(1)其中一些标本经过常规脱水、透明、浸蜡、包埋制成蜡块,将蜡块制成4~5μm厚的连续切片,供HE染色、Verhoeff-van Gieson(VVG)特殊染色及免疫组织化学染色;(2)另一些标本用最优切片温度(optimum cutting temperature,OCT)包埋剂包埋,制成动脉横截面7 μm厚的连续冰冻切片,用于免疫荧光和活性氧簇(reactive oxygen species,ROS)的DHE染色。
3.3 免疫组织化学染色法 石蜡切片置于60℃烘箱1 h,置于二甲苯I和二甲苯II中各15 min,再依次浸泡100%乙醇、100%乙醇、95%乙醇、95%乙醇、75%乙醇和双蒸水各5 min完成脱蜡。脱蜡后,石蜡切片置于抗原修复液(柠檬酸三钠缓冲液,pH 6.0)中,95℃水浴修复6 min。PBS漂洗后封闭,经I抗(兔抗小鼠SENP3多克隆抗体)4℃孵育过夜,生物素标记的II抗(生物素化的羊抗兔IgG)室温孵育2 h后在显色液 A+B(1∶1)下孵育 1 h,DAB 显色 5~10 min。适时终止后,经梯度浓度乙醇脱水和二甲苯处理,用中性树胶封片,在显微镜下观察和拍照。
3.4 小鼠骨髓原代单核细胞(bone marrow-derived monocytes,BMDMs)的提取和诱导 小鼠麻醉后,脱颈处死,无菌条件下取小鼠下肢骨,DMEM培养基冲出骨髓,过40μm滤网,室温下500×g离心5 min,去除上清液后用含10%FBS和30μg/L M-CSF的DMEM培养基重悬,接种到10 cm培养皿,7 d后细胞分化为M0,之后分别用来进行M1极化诱导[100 μg/L LPS+50μg/L干扰素γ(interferonγ,IFNγ)处理24 h]和 M2 极化诱导(20 μg/L IL-4 处理 24 h)[6,15]。BMDMs置于37°C、5%CO2培养箱,隔天换液。
3.5 组织和细胞免疫荧光法 (1)组织免疫荧光:脱蜡步骤同3.4中所述,其余步骤与细胞免疫荧光步骤相似。(2)细胞免疫荧光:细胞用PBS清洗之后,迅速加含4%多聚甲醛的固定液,于4°C固定过夜;0.2%Triton X-100处理10 min,并用封闭液封闭1 h;CD86抗体(1.0 mg/L)4°C孵育过夜,次日用PBS洗3次后,荧光素标记的山羊抗兔IgG(1∶500)在室温下进行染色标记,然后观察。细胞图像通过DM2500型荧光显微镜(Leica)拍照。
3.6 ROS的DHE染色法 DHE在ROS作用下脱氢后,可与RNA或DNA结合产生红色荧光。冰冻切片用PBS清洗3次,每次5 min后,按1∶100工作浓度用PBS稀释配制DHE染色液,每个样品滴加50μL工作液,室温下避光孵育60 min。然后同样用PBS清洗3次,每次5 min。荧光显微镜观察(最大激发波长为300 nm,最大发射波长为610 nm)。
3.7 组织RNA抽提和RT-qPCR检测 TRIzol一步法提取小鼠腹主动脉瘤体组织中的RNA后,利用NanoDrop 2000分光光度计检测样品RNA浓度,并注意A260/A280是否在1.8~2.0范围,以判断RNA提取过程中是否有污染。之后按照TaKaRa的PrimeScript®RT reagent Kit使用说明书,进行逆转录操作。qPCR按照TaKaRa SYBR®Premix Ex Taq™(Perfect Real Time)Kit说明书,在冰上将扩增体系中的各组分充分混匀后,使用LightCycler®480型实时荧光定量PCR仪检测。采用两步法荧光定量PCR扩增程序进行扩增。反应结束后检查实时荧光定量PCR的扩增曲线是否正常,融解曲线是否为单峰。计算公式:ΔCt=Ct目的基因-Ct内参照(GAPDH);ΔΔCt=ΔCt待测样品-ΔCt对照样品;相对表达量=2-ΔΔCt。引物由中国生工生物有限公司负责合成,主要引物序列见表1。

表1 RT-qPCR引物序列Table 1.Sequences of the primers for RT-qPCR
3.8 蛋白提取和Western blot RIPA缓冲液提取来自主动脉或细胞的蛋白。将主动脉组织速冻在液氮中,在RIPA缓冲液中通过组织研磨破碎仪粉碎,冰上静置40~60 min,12 000×g、4℃离心15 min。然后将上清液转移到新EP管用于后续实验。BCA protein assay kit测定其蛋白浓度,再根据样品蛋白浓度,按蛋白总量30~50μg范围内计算出上样体积。Western blot检测:组织蛋白样品经SDS-PAGE后转至聚偏二氟乙烯膜,5%脱脂奶粉37℃封闭1 h,TBST缓冲液洗3次,每次5 min,然后加入I抗(SENP3、TNFα、IL-1β和MMP9抗体均为1∶1 000稀释,β-actin抗体为1∶5 000稀释)于4℃孵育过夜;次日,加入II抗(1∶10 000)于37℃孵育1 h;用增强化学发光(enhanced chemiluminescence,ECL)试剂显影,显影仪采用ImageQuant LAS4000(GEHealthcare)。
4 统计学处理
以均数±标准差(mean±SD)表示符合正态分布的计量资料,采用GraphPad Prism 8.0进行统计分析和作图。两组间符合正态分布的计量资料比较采用双侧t检验,两组间等级资料比较采用Mann-WhitneyU检验。两个率或两个构成比的比较采用Fisher确切概率法,生存分析比较采用Mantel-Cox检验。以P<0.05为差异有统计学意义。
结 果
1 SENP3调控巨噬细胞极化
RT-qPCR结果显示,SENP3 mRNA在M1型巨噬细胞诱导过程中表达升高(P<0.01),但是M2型巨噬细胞中表达显著降低(P<0.01),见图1A、B。细胞免疫荧光图片中可见M1分化时细胞核内SENP3蛋白表达升高,见图1C。此外,在巨噬细胞受刺激由M1向M2型转换时,SENP3的mRNA表达降低(P<0.01),而在M2向M1型转换时,SENP3的mRNA表达升高(P<0.01),见图1D、E。进一步,细胞免疫荧光结果显示,cKO小鼠和其同窝出生的WT小鼠的原代BMDMs在诱导M1分化过程中,cKO组M1型巨噬细胞的标志物CD86表达低于WT组,与之对应的是,诱导M2分化时cKO组M2型巨噬细胞的标志物CD206表达则高于WT组,见图1F。

Figure 1.SENP3 expression was up-regulated during M1 polarization and M1/M2 transformation.A and B:the BMDMs from wildtype(WT)mice were isolated,cultured and treated with M1 stimulation(100 μg/L LPS+50 μg/L IFNγ)(A)or M2 stimulation(20μg/L IL-4)(B)for 24 h,and the mRNA expression of SENP3 was detected by RT-qPCR;C:the BMDMs from WTmice were treated with M1 stimulation(100μg/L LPS+50μg/L IFNγ)or M2 stimulation(20μg/L IL-4)for 24 h,and immunofluorescence was conducted to analyze SENP3 protein expression(red:SENP3;blue:DAPI);D:the BMDMs from WT mice were cultured in DMEM containing 100μg/L LPS+50μg/L IFNγfor 24 h,and then in DMEM containing 100μg/L LPS+50μg/L IFNγor 20μg/L IL-4 for another 24 h,and the mRNA expression of SENP3 was detected by RT-qPCR;E:the BMDMs from WT mice were cultured in DMEM containing 20μg/L IL-4 for 24 h,and then in DMEM containing 20μg/L IL-4 or 100μg/L LPS+50μg/L IFNγfor another 24 h,and the mRNA expression of SENP3 was detected by RT-qPCR;F:BMDMs isolated from WT and cKO mice were cultured and treated with M1 stimulation(100μg/L LPS+50μg/L IFNγ)or M2 stimulation(20μg/L IL-4)for 24 h,and the M1 marker or M2 marker was measured by immunofluorescence(red:CD206;green:CD86;blue:DAPI).Mean±SD.n=6.**P<0.01 vs PBSgroup;##P<0.01 vs LPS+IFNγ/LPS+IFNγ group;△△P<0.01 vs IL-4/IL-4 group.图1 巨噬细胞M1极化和M1/M 2转化过程中SENP3表达上调
2 SENP3在改良磷酸钙诱导的模型小鼠AAA组织中高表达
RT-qPCR和Western blot结果显示,SENP3在小鼠AAA组织中表达显著升高(P<0.05),见图2A、B。石蜡切片免疫组织化学染色显示,AAA病灶组织内膜、中膜层有缺失;SENP3阳性染色主要分布在中膜层细胞核及核周的部分胞质内,与对照组相比,阳性染色面积显著增大(P<0.05),见图2C。
3 单核细胞SENP3特异性敲除抑制磷酸钙诱导的小鼠A A A形成

Figure 2.SENP3 was up-regulated in the aorta tissue of mice with CaPO4-induced abdominal aortic aneurysm(AAA).The AAA model was establshed in 8~12-week-old C57BL/6Jmice by administration with CaCl2 and PBSfor 14 d.A:SENP3 mRNA expression was measured by RT-PCR;B:SENP3 protein expression was measured by Western blot;C:representative immunohistochemical staining images for SENP3 in paraffin-embedded sections from aorta tissues were shown,and the SENP3 positive area was determined.Mean±SD.n=6.*P<0.05,**P<0.01 vs Con group.图2 SENP3在CaPO 4诱导的小鼠腹主动脉瘤中高表达
RT-qPCR和Western blot检测结果显示,cKO小鼠BMDMs中,SENP3表达显著降低(P<0.01),见图3A。cKO雄鼠和同窝出生的WT雄鼠AAA造模结果显示,cKO小鼠腹主动脉成瘤较小或无法形成AAA,见图3B,相应地,cKO组AAA造模小鼠生存率显著高于WT组(P<0.05),见图3C。改良磷酸钙法诱导的AAA中cKO小鼠AAA发生率显著低于WT组(P<0.05),见图3D;WT小鼠中,磷酸钙诱导的AAA主动脉瘤体外部直径和动脉重/总体重比值均高于cKO组(P<0.05),见图3E、F。HE染色可见正常动脉具备清晰、完整的弹力板层将内、中、外膜分开,动脉无异常扩张,内皮细胞和平滑肌细胞排列整齐;而造模后,WT组发生AAA的动脉扩张和增厚程度比cKO组严重,见图3G。此外,VVG染色可见cKO组仅有少量或无内弹性膜崩解及弹性纤维断裂(黑色着色为弹性纤维),而WT组的弹性纤维断裂更为严重,纤维断裂等级数据的差异有统计学显著性(P<0.05),见图3G、H。
4 SENP3敲除抑制AAA的炎症和氧化应激
通过对AAA瘤体组织进行RT-qPCR和Western blot检测显示,在磷酸钙诱导下,WT组的主动脉组织炎症因子IL-1β、IL-6和TNFα的表达显著高于cKO组,见图4A~C。DHE染色检测动脉组织中的ROS水平,结果显示:cKO组的主动脉组织中氧化应激水平低于WT组,见图4D。
5 SENP3敲除抑制MMP-9表达上调所导致的ECM重构
RT-qPCR、Western blot和免疫组织化学染色结果显示,在cKO组瘤体内MMP-9的mRNA和蛋白表达比WT组显著下调,见图5A~C。MMP-9阳性着色在细胞质中,瘤体的病灶中伴随着大量浸润的炎症细胞和破损的血管平滑肌细胞,而cKO组的中膜层相对完整,在MMP-9高表达的相应部位,对应WT组瘤体动脉中膜的弹力板层破坏更为严重,见图5C。
6 SENP3介导MKK7 de-SUMO修饰调控JNK通路和MMP-9表达
Co-IP实验结果显示,巨噬细胞MKK7的SUMO2/3修饰在诱导M1分化的过程中减少(图6A),而MKK7与SENP3的相互作用增强(图6B);在转染Flag-MKK7野生型(Flag-MKK7 WT)和SUMO修饰位点K18突变体(Flag-MKK7 K18Rmutant)后诱导BMDMs进行M1极化,结果显示,后者p-JNK和MMP-9水平均高于前者,见图6C、D。
讨 论
1 SENP3介导的巨噬细胞M 1极化促进AAA发生和进展
哺乳动物体内目前共发现有7种SENPs,其中SENP3对氧化应激最为敏感[16-17],主要介导底物蛋白的去除SUMO2/3修饰(de-SUMO2/3修饰),在肿瘤增殖、转移和炎症细胞的激活中发挥重要作用。同时,在免疫应答条件下巨噬细胞极化成M1型,线粒体中大量生成ROS,在氧化应激环境下分泌释放大量的炎症因子,放大炎症损伤[5]。本研究表明SENP3在巨噬细胞M1/M2极化时存在表达差异,并且敲除SENP3能改变M1/M2巨噬细胞的诱导分布,这提示SENP3也参与调控巨噬细胞M1和M2表型转换。人类外周血单核细胞衍生的巨噬细胞蛋白质组学和转录组学分析显示,AAA与非AAA外周动脉疾病的患者之间,巨噬细胞的蛋白和基因表达谱存在显著差异,其中差异表达的基因和蛋白质富集在与AAA相关的ECM重塑和炎症等方面,表明单核-巨噬细胞谱系在AAA的ECM重塑或炎症过程具有重要作用[18]。在体外,cKO小鼠的M0受刺激后发生M1极化的比例降低,而在磷酸钙诱导的腹主动脉瘤小鼠模型中,SENP3敲除能够有效降低AAA的氧化应激损伤、炎症反应和ECM重塑,从而导致AAA发病减少和小鼠存活率的升高。以上结果表明,SENP3介导的巨噬细胞M1极化可促进AAA发生和进展。

Figure3.Monocyte-specific SENP3 knockout protectsed mice from CaPO4-induced AAA.A:SENP3 expression in abdominal aorta tissue was measured by RT-qPCR and Western blot;B:representative images of mouse abdominal aorta tissue in 8~12-week-old cKO male mice(n=6)and WT littermates(n=6)administered with CaCl2 and PBSfor 14 d(the arrowhead indicates typical aneurysm);C:Kaplan-Meier survival curves(WT:n=20;cKO:n=15);D:incidences of AAA in animal model;E:quantification analysis for maximal external diameters of abdominal aortas in animal model;F:total wet weight of abdominal aorta per body weight in animal model;G:HE and VVG staining for paraffin-embedded section of AAA tissue in animal model;H:grade of elastic degradation.Unpaired two-tailed t-test was used for statistical analysis in A,Eand F,and Mann-Whitney U test was used in H.Two-sided Fisher's exact test was used to compare variables in D.Statistical significance on Kaplan-Meier curves(C)was assessed with Mantel-Cox test.Mean±SD.*P<0.05,**P<0.01 vs WTgroup.图3 单核细胞SENP3特异性敲除减少CaPO4诱导的小鼠腹主动脉瘤形成
2 SENP3促进巨噬细胞炎症反应并调控ECM的机制

Figure 4.Monocyte-specific SENP3 knockout inhibited the flammation and oxidative stress in AAA.A,Band C:the mRNA and protein levels of inflammatory cytokines(IL-1β,IL-6 and TNFα)in the aorta tissues of WT and cKO mice were detected by RT-qPCR and Western blot;D:in situ dihydroethidium(DHE)staining for ROSproduction in the frozen sections of the aorta tissues from WT and cKOmice.Unpaired two-tailed t-test was used for statistical analysis in A,B and C.Mean±SD.n=5.**P<0.01 vs WTgroup.图4 单核细胞SENP3特异性敲除抑制AAA的炎症和氧化应激反应

Figure 5.Monocyte-specific SENP3 knockout inhibited MMP-9-induced ECM remodeling.A:the mRNA level of MMP-9 was measured by RT-qPCR;B:the protein level of MMP-9 was measured by Western blot;C:immunohistochemical staining for MMP-9 in paraffin-embedded sections fromaorta tissues.Mean±SD.n=5.*P<0.05,**P<0.01 vs WTgroup.图5 单核细胞SENP3特异性敲除抑制MMP-9介导的细胞外基质重构
SENP3及其介导的de-SUMO修饰在单核-巨噬细胞分化和炎症反应中发挥重要作用。SUMO蛋白酶SENP3在小鼠炎症性休克模型中可以激活TLR4下游MAPK/AP-1通路,正向调节巨噬细胞炎症反应,而SENP3敲除则显著抑制了这一过程,提高了小鼠炎症损伤后的存活率[10]。我们的研究结果表明相,磷酸钙诱导的AAA病灶中有大量炎症细胞浸润,SENP3介导巨噬细胞M1极化发挥促炎作用从而加重AAA。研究表明,钙离子可诱导主动脉中层平滑肌细胞凋亡和弹性蛋白降解,刺激单核-巨噬细胞迁移趋化,并促进炎症因子表达分泌[19-20]。M1型巨噬细胞的MMPs(MMP-9最具代表性)表达上调,能够降解和破坏中层弹性纤维板以及Ⅰ型和Ⅲ型胶原,反映病情进展。病灶处炎症损伤-修复过程ECM的主动病理性重构依赖于MMPs的分泌和活化,大量降解动脉中层的主要应力结构——弹力蛋白。同时,炎症细胞对组织的浸润和相关炎症因子表达上调会促进巨噬细胞的MMPs进一步表达,加重弹力蛋白的降解,从而引发破坏-重塑恶性循环,促进AAA的形成和动脉瘤体破裂。我们构建的小鼠模型表明,单核细胞SENP3敲除显著减轻了这种炎症级联放大效应,延缓AAA的疾病进展。
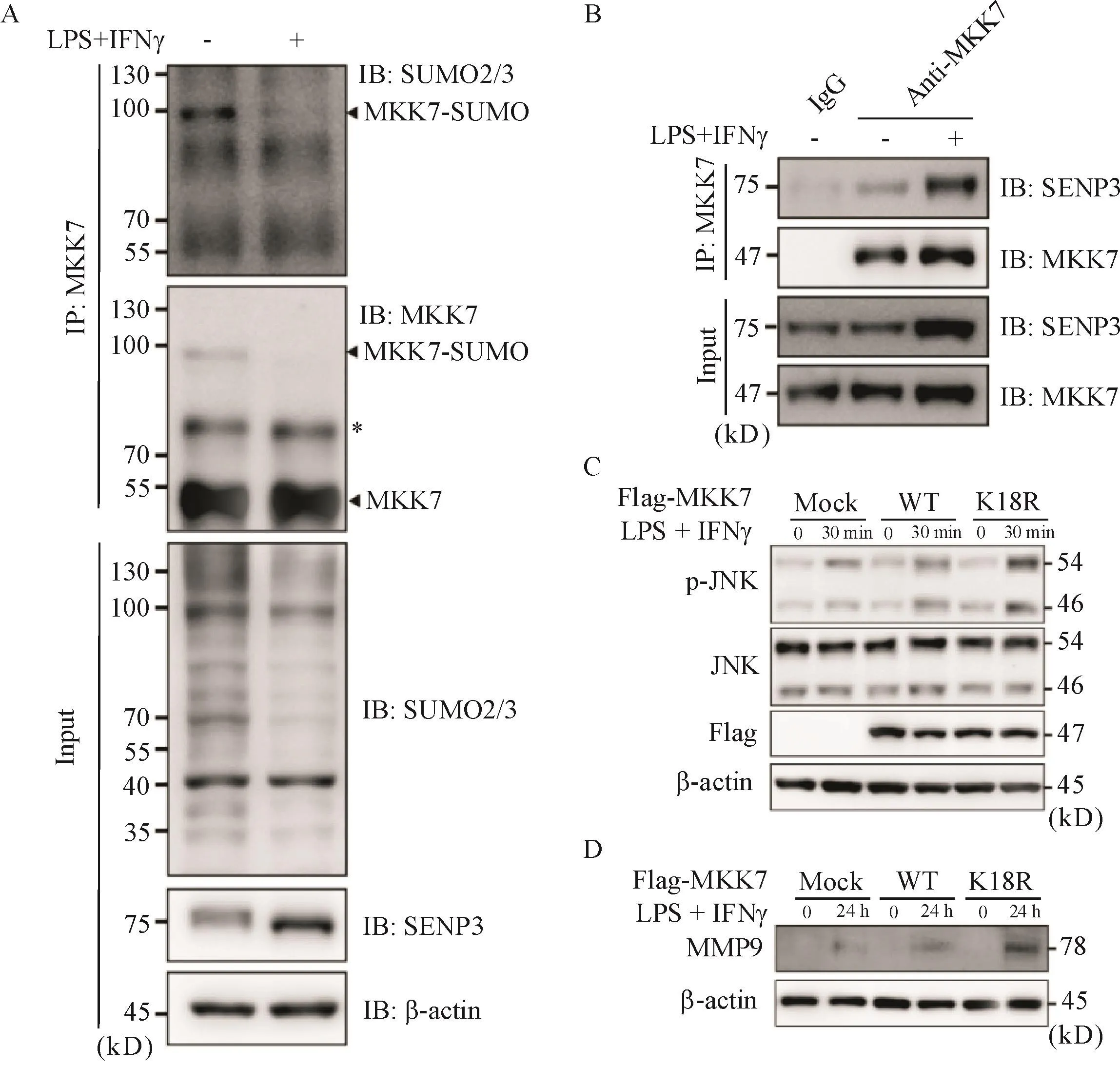
Figure 6.SENP3 mediated MKK7 de-SUMO modification to regulate JNK pathway and MMP-9 expression.A:BMDMs treated with or without LPS(100 μg/L)and IFNγ(50μg/L)for 48 h were collected,and endogenous MKK7 conjugated with SUMO2/3 was detected by co-immunoprecipitation(Co-IP);B:BMDMs were treated with LPS(100 μg/L)and IFNγ(50 μg/L)for 30 min,and the interaction of endogenous SENP3 and MKK7 was determined by Co-IP;C and D:BMDMs were transfected with Flag-tagged MKK7 WT or SUMOless mutant K18R and incubated with or without LPS(100 μg/L)and IFNγ(50μg/L)for the indicated time,and then p-JNK,JNK and MMP-9 were determined by immunoblotting(IB).*:non-specific bands.图6 SENP3通过介导MKK 7的de-SUMO修饰调控JNK通路和MMP-9表达
这些研究也揭示了不同炎症环境下的单核-巨噬细胞系中SUMO修饰底物和多种调控机制,为我们深入了解单核-巨噬细胞谱系中转录因子的翻译后调控机制提供了充分的证据。目前尚无研究表明MMP-9能被SUMO化修饰,SUMO修饰功能位点预测(http://www.jassa.fr/)也同样表明,MMP-9没有可能的SUMO修饰位点。因此,巨噬细胞MMP-9合成增多可能是SENP3调控的效应分子和终末环节。SENP3作为一种de-SUMO蛋白酶,主要功能是对底物蛋白进行翻译后de-SUMO修饰,降低底物蛋白的SUMO2/3水平,从而影响底物蛋白的功能及活性。我们课题组前期研究表明,SENP3通过介导MKK7 de-SUMO修饰调控JNK/c-Jun通路,从而参与巨噬细胞炎症反应[10]。我们现有的研究证据也表明SENP3作用于AAA疾病的机制在于de-SUMO调控MKK7及MAPK/JNK通路,进而促进MMP-9合成和分泌,最终导致ECM重构的病理学改变。未来我们将进一步通过Co-IP实验鉴定SENP3及其介导的de-SUMO2/3在氧化应激以及CaPO4诱导的AAA中的其他作用底物。此外,其他类型细胞如平滑肌细胞的凋亡和增殖异常,以及内皮细胞参与的新生血管形成[7]等,在AAA形成中也发挥了重要作用,我们将在接下来的工作中继续开展相关研究。

