科研级嵌合抗原受体慢病毒浓缩方法对比研究
聂蓓娜 许晨光 万晓春
1(中国科学院深圳先进技术研究院 深圳 518055)
2(中国科学院大学 北京 100049)
3(广东省免疫细胞治疗工程技术研究中心 深圳 518055)
1 引 言
继 2013 年肿瘤免疫治疗被评为世界十大科技突破之首[1]后,美国食品药品监督管理局(FDA)在 2017 年批准了两款 CD19 嵌合抗原受体(Chimeric Antigen Receptor,CAR)T 细胞药品上市,分别用于治疗 B 细胞急性淋巴细胞白血病(B-ALL)和弥散性大 B 细胞淋巴瘤(DLBCL)。这标示着肿瘤细胞免疫治疗从科研阶段发展到了直接造福病人的阶段[2]。CAR-T 技术中的关键环节之一是实现 CAR 在 T 细胞上的安全稳定表达。目前有 3 种可实现的方法:电穿孔、逆转录病毒转导和慢病毒转导。其中,通常的逆转录病毒所携带的 DNA 片段较小,不能感染非分裂细胞且体内注射的致瘤风险较高;而电穿孔虽然较安全,但也只能实现 T 细胞的瞬时表达,故需进行多次制备和输注[3]。因此,目前常用于制备 CAR-T 的方法是经过改良的、相对更加安全稳定的慢病毒侵染系统[4]。
慢病毒载体是重组的人免疫缺陷病毒(Human Immunodeficiency Virus,HIV),不仅能够整合到宿主基因组获得长期稳定的基因表达,而且具有无毒性、低免疫原性等优点,已被用于人细胞的高效基因传递,并在基因治疗研究和临床治疗中具有广泛的应用[5]。慢病毒存活和发挥功能所需的基本基因包括 gag、pol 和 env,分别编码病毒结构蛋白、逆转录蛋白及整合到宿主细胞基因组所需的酶和包膜糖蛋白[6]。目前制备慢病毒通常是把病毒基因组的基本原件分到单独的质粒中,再通过将 3~4 种不同的质粒和目的穿梭质粒共转染人胚肾 293T 细胞获得。实验室小规模制备的病毒滴度范围一般为 106~107TU/mL[7],这虽然可以满足短基因片段或易转染细胞的基因转染实验,但要实现较长 CAR 基因在 T 细胞上的高效转染和表达则需对病毒进行浓缩纯化以提高滴度。一般最常用的是物理浓缩方式,主要包括超速离心(超离)和超滤。
超速离心是实验室中较常见的一种病毒浓缩方式。常规超离所需的相对离心力(RCF)一般超过 10 000×g,以除去杂质和确保较高的感染活力[8]。另有研究表明,含 env 编码的包膜蛋白的慢病毒颗粒在超离过程中能保持较好的稳定性[9],但由于超离一次循环处理的病毒液体积十分有限,且仪器和耗材造价昂贵,故不利于比较大体积病毒液的浓缩。超滤是一种采用分子量截断值(MWCO)在 20~500 kDa 的各向异性高分子膜进行压力驱动的分离过程[10]。其中,超滤膜主要由两层组成:提供机械强度的厚大孔支撑层、负责膜的选择性和渗透性的薄表皮层[11]。超滤膜由超滤柱承载,由于超滤操作时间较超离的短,对离心机转速要求不高,故也广泛应用于实验室的病毒浓缩和缓冲液交换。目前关于超离和超滤浓缩病毒效果比较的研究中,较多涉及的是非 HIV 不同种病毒之间的比较[12]。而针对不同慢病毒浓缩方式间的优劣探究中,仅在一些对含不同包膜蛋白的慢病毒滴度和感染效果的比较研究中有所提及。但对于含不同长度插入基因的同种包膜慢病毒,仍然缺乏超离与超滤浓缩效果的对比研究[13-14]。虽然大规模生产病毒的下游工艺已较成熟,但在常规实验室小批量制备高滴度慢病毒时,对浓缩方式的选择仍没有相关的研究作为参照依据。
本实验旨在使用两种含不同长度外源基因的二代慢病毒,比较二者使用不同方法浓缩的效果,以探索超离和超滤对科研级制备高滴度慢病毒的影响。
2 材料与方法
2.1 材料
本研究所用穿梭质粒和包装质粒由中国科学院深圳先进技术研究院免疫细胞治疗实验室保存;人胚肾 293T 细胞系购于美国菌种保藏中心(ATCC);急性 T 细胞白血病细胞系 Jurkat 购于中国科学院典型培养物保藏委员会细胞库;RPMI-1640 培养基、DMEM 培养基、0.25% 胰蛋白酶和磷酸盐缓冲液(DPBS)均购于美国 Hyclone 公司;胎牛血清和 Opti-MEM 培养基购于美国 Gibco 公司;青霉素/链霉素双抗购于北京全式金生物技术有限公司;转染试剂 PEIpro 购于法国 Polyplus Transfection 公司;100 mm×20 mm细胞培养皿和 24 孔板均购于无锡耐思生物科技有限公司;超滤柱购于英国颇尔(PULL)公司;超速离心管购于美国贝克曼库尔特有限公司;0.45 μm 一次性针头式过滤器购于英国颇尔(PULL)公司;20 mL 一次性注射器购于上海双鸽医疗器械有限公司;超速离心机(美国贝克曼(Beckman)公司,型号 Optima XE-100);流式细胞分析仪(美国贝克曼(Beckman)公司,型号 CytoFLEX)。
2.2 方法
2.2.1 病毒包装
于转染前一天,将状态良好的 293T 细胞接种到 100 mm×20 mm 细胞培养皿,细胞数为(3.5~4.0)×106个/皿,以确保转染时细胞汇合率在 70%~80%。转染时,采用 Opti-MEM 配制包装质粒 psPAX2、包膜质粒 pMD2.G 和穿梭质粒混合液,加入 PEIpro 静置 15 min 后滴加到前一天接种的培养皿中,培养 6~8 h 后更换新培养液。转染 48 h 后收集上清液,0.45 μm 滤膜过滤去除杂质得病毒原液。
2.2.2 病毒浓缩
将所得病毒原液取出 1 mL,剩下的病毒液均分两管,分别进行超离和超滤处理。
(1) 超速离心
将病毒液转移到超速离心机专用离心管中,精确配平后使用 Beckman 超速离心机进行超离(40 000×g、4 ℃、2 h)。离心结束后去除上清液,并用新鲜培养基重悬收集底部病毒颗粒沉淀。
(2) 超滤
将病毒液加入分子量截断值为 100 kDa 的 Omega 膜超滤柱,4 ℃、3 220×g 离心 30 min,收集上层浓缩液。
2.2.3 T 细胞转染和滴度测定
于 24 孔培养板中每孔接种 5×105个 Jurkat 细胞,第一梯度稀释孔的细胞悬液体积为 300 μL,后续稀释梯度每孔加入 360 μL 细胞悬液。其中,每个梯度设 3 个平行,共设 4 个浓度梯度。取 100 μL 浓缩后的病毒液加入第一梯度孔。另取 3 个 1.5 mL 离心管用于病毒稀释,第一管中加入 340 μL 培养基,其余离心管分别加入 360 μL 培养基。取 100 μL 病毒液加入第一管,充分混匀后吸取 40 μL 混合液加入第二梯度孔,再从第一管中取 40 μL 加入第二管,依此进行 10 倍稀释,每孔终体积为 400 μL。置培养箱中培养过夜后补充 1 mL 新鲜培养基,感染 48 h 后取 500 μL 细胞悬液进行流式检测荧光蛋白的表达。使用 0.5%~10% 的荧光蛋白阳性率计算滴度:

2.2.4 统计分析
本文使用 GraphPad Prism 8 软件对实验数据进行处理,其中实验结果均以“平均值±标准差”(n=3)表示。
3 结 果
3.1 质粒构建和表达
本文在慢病毒穿梭载体的基础上,以自切割短肽 P2A 序列[15]做桥接构建了共表达 mCherry 荧光蛋白和 CD19 CAR (CAR19)的慢病毒质粒,其中通过 mCherry 表征 CAR19 的表达,故本文将该病毒质粒表示为 CAR19-mCherry。同时,以标记绿色荧光蛋白(Green Fluorescent Protein,GFP)的慢病毒质粒(表示为 pWPXLd-GFP)作为对照。两种病毒质粒基因构成如图 1(a)所示,将二者分别转入 293T 细胞 48 h 后,通过流式分析荧光蛋白表达情况。从图 1(b)可看出,mCherry 和 GFP 在 293T 上的瞬时表达率分别为 18.5% 和 36.9%,表明在慢病毒载体上插入的目的基因成功转入 293T 细胞并能有效表达。
3.2 慢病毒产生和感染效率测定
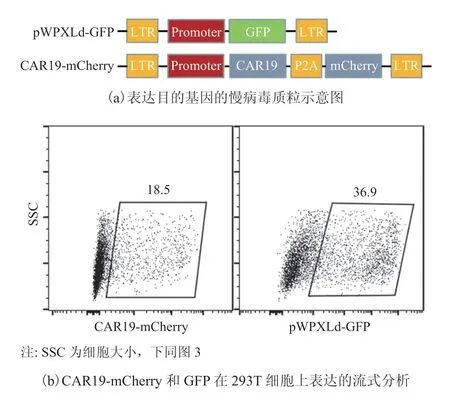
图 1 有效表达质粒的构建Fig. 1 The construction of effective expression plasmids
慢病毒颗粒在 293T 细胞中组装后,通过内体分选复合体运送出细胞膜,并释放到胞外空间[16]。因此,本文通过收集 293T 包装 48 h 后的细胞上清液,过滤杂质后得到病毒毒液。实验过程中,首先将浓缩前、后病毒液分别感染 Jurkat 细胞。结果显示,在等体积情况下,两种浓缩方法浓缩 15 倍后的病毒液均比未浓缩时的感染效率高 1.5~2 倍(如图 2 所示),这表明浓缩处理是有效的。其次,对浓缩后的病毒液进行梯度稀释并分别感染 Jurkat 细胞。48 h 后流式分析及荧光显微镜观察 mCherry 荧光蛋白表达可见,随着病毒稀释倍数的增加,荧光细胞数量成倍递减,且能明显看出超滤的滴度高于超离,具体如图 3(a、b)所示。最后,将阳性表达率与病毒加入量做统计分析。为准确计算滴度、避免多个病毒颗粒整合到同一细胞内,在病毒加入量与荧光表达率呈线性关系的范围内选取数值进行滴度计算[17]。如图 3(c)所示,每次病毒感染后选取 0.5%~10% 的阳性率计算病毒滴度。
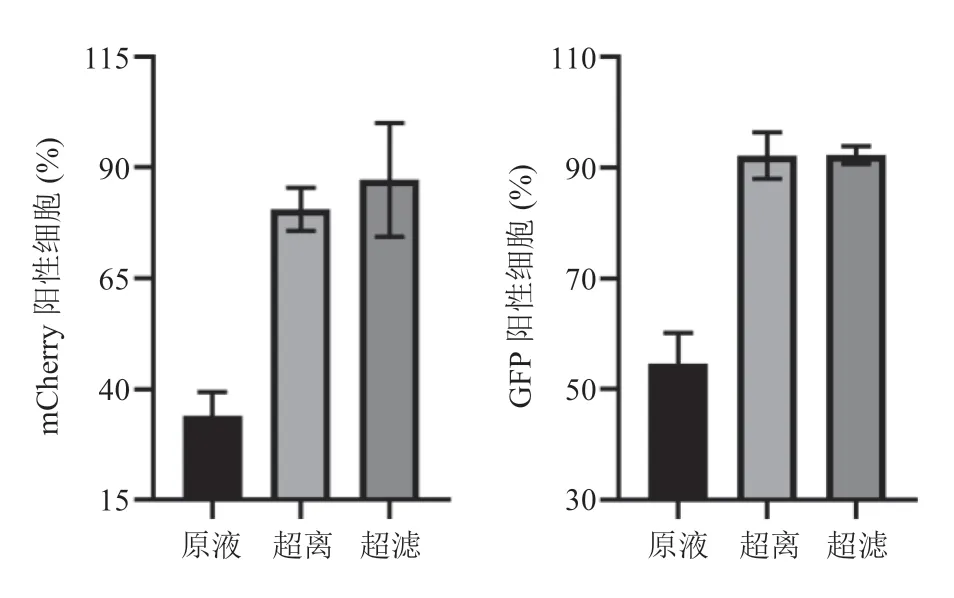
图 2 浓缩有效性分析Fig. 2 The assessment of concentrated effectiveness
3.3 不同浓缩方式的滴度和回收效率
通过比较超离和超滤法产生的病毒滴度差异可知,两种方法均可对慢病毒产生有效的浓缩。从表 1 可以看出,同一浓缩倍数下,超离产生的病毒滴度为 108~109TU/mL,回收率为 115%~202%。对比而言,超滤产生的滴度均高于 1×1010TU/mL,比超离滴度高 20~40 倍;同时,回收效率比超离高 60~400 倍。这表明,超滤法在慢病毒滴度和回收率方面比超离更有效。图 4 显示,两种方法产生的滴度间具有显著性差异(P<0.05)。由此可见,通过超滤能得到更高效的慢病毒颗粒浓缩,且浓缩造成的损失更少,对病毒活力的抑制也更小。

图 3 不同方法浓缩后的病毒感染效率评估Fig. 3 The assessment of infection efficiency of virus concentrated by different methods

表 1 超离心法和超滤法浓缩慢病毒的比较 Table 1 Comparison of lentivirus stocks concentrated by ultracentrifugation or ultrafiltration

图 4 不同浓缩方式滴度统计分析Fig. 4 The statistical analysis of titers concentrated by different methods
4 讨论与分析
目前用于测量慢病毒滴度的方法主要有 4 种:(1)使用定量 PCR(聚合酶链反应)法检测转导病毒细胞基因组中的载体拷贝数;(2)基于病毒 RNA(核糖核酸)测定病毒载体相对颗粒数;(3)使用 ELISA(酶联免疫吸附)测定 HIV-1 p24 蛋白;(4)通过流式测定慢病毒载体表达的荧光蛋白滴定慢病毒滴度。其中,前 3 种方法无法确定所测定的病毒颗粒是否有活性,而流式分析法能够比较准确地测定活性病毒颗粒的滴度[18]。因此,本文采用流式细胞术检测慢病毒的感染效率和滴度。
本文通过对比超离和超滤对含不同目的基因的慢病毒的影响发现,超离所得的滴度远低于超滤,说明超离过程可能使慢病毒的活性和感染效力减弱甚至丢失。同时还发现,等体积等稀释度的病毒液感染 Jurkat 细胞时,超离的病毒会导致细胞状态变差甚至大量死亡,表明超离方法对细胞产生的毒性高于超滤法。推测原因,首先可能是超离的离心力较大且时间较长,施加在病毒颗粒上的剪切力可能会使得病毒活性下降,使得感染力大幅降低。其次,超离过程涉及相变(从液体到固体),也可能会导致病毒失活[19]。对于离心力造成的剪切力,Boroujeni 等[18]发现降低相对离心力至 8 000×g 时,可在一定程度上提高病毒的存活率。另外,多种与病毒颗粒密度类似的杂质会被沉淀下来,如宿主细胞的膜泡等[20],而这些杂质会对细胞产生毒性,容易造成感染细胞死亡。另有研究表明,小鼠大脑注射超离沉淀后的逆转录病毒会引起轻微神经炎症反应和免疫反应[21]。本文表 1 显示超离的回收率存在一定的损失,提示超离对慢病毒的损伤作用可能与慢病毒的包膜蛋白 VSV-G 有关[22]。从表 1 可以看出,无论是超离还是超滤,相同条件下含较长外源 CAR 片段的慢病毒产率比只含 GFP 的慢病毒低一个数量级,而从图 1(b)可知慢病毒质粒瞬时转染 293T 细胞的阳性率也仅相差约一倍。因两个慢病毒载体的外源基因相差约2 000 bp,表明慢病毒的浓缩获得率与插入片段长度具有一定关系。
相对来说,超滤所得到的病毒滴度更高,从回收率来看病毒颗粒的损失更小,且感染后的细胞状态较好,提示超滤浓缩的病毒悬液感染力更强、细胞毒性更低。虽然超滤的离心过程也会产生剪切力,但与超离相比,其离心时间较短、离心速率较低,因而对病毒活力的影响大大降低。使用合适孔径的滤膜能在达到高回收率的同时滤除多数小粒径杂质,既能提高病毒纯度又大大降低杂质引起的细胞毒性。由于慢病毒大小在 300 kDa左右,因此本文使用分子截留率为 100 kDa 的滤膜进行超滤,从表 1 可见其滴度和回收率都远高于超离。Rodrigues 等[23]也发现,病毒超滤后的回收率普遍高于 100%,主要原因与超滤不涉及相变,能更好地保持病毒的活力有关[19]。另有研究[24]认为,回收率超过 200% 可能是去除了大量的血清蛋白、降解的 DNA 片段和转染抑制因子。但超滤也存在弊端,如果病毒颗粒与膜孔径大小在同一数量级,那么病毒颗粒有可能陷入滤膜微孔,导致低回收率[25]。另外,膜污染是超滤的潜在制约因素,污垢的积累会导致流速随着时间的增加而降低[19],故为确保浓缩病毒的质量,超滤的体积应在合理范围内。
5 结 论
本文通过比较超离和超滤对含不同长度目的基因慢病毒的浓缩效果,探究了超离和超滤两种方式对二代慢病毒滴度和回收率的影响。结果显示,无论是从滴度还是回收率来看,超滤浓缩慢病毒的效果均优于超速离心。表明在实验室小规模制备高滴度慢病毒过程中,超滤产生的慢病毒感染力更强,细胞毒性也更低,比超离达到更优的病毒浓缩和纯化效果。同时,超滤具有所需耗材更便宜,操作更方便、时间更短,可浓缩体积更大等特点,无疑比超离更适用于实验室小规模制备高滴度慢病毒,特别对 CAR-T 基础研究中所涉及到慢病毒浓缩纯化具有重要参考意义。

