基于仿生微流控技术的肠道器官芯片构建
向云青 权菲菲 温 慧 袁国栋 崔 菊 黄术强
1(中国科学院深圳先进技术研究院 深圳 518055)
2(中国科学院大学 北京 100049)
3(中国科学院半导体研究所 半导体超晶格国家重点实验室 北京 100083)
4(北京医院 国家卫生健康委北京老年医学重点实验室 北京 100730)
1 引 言
肠道是人体重要的消化和吸收器官,主要包括小肠和大肠。其中,小肠内壁上存在着大量褶皱状绒毛结构,能够大大增加吸收面积,并且肠腔中的黏液层对于阻止病原菌入侵肠道细胞具有显著作用。同时,大约有 1 000 种细菌生存于肠道部位[1],参与营养吸收、药物代谢、免疫系统成熟及致病菌防御等过程[2]。现有研究表明,一旦肠道菌群失去平衡,肠道结构与功能将会受到破坏,甚至打破免疫稳态,导致一系列的肠道疾病,如炎症性肠病(Inflammatory Bowel Disease)、肠癌等[3-4]。目前在人体肠道生理学研究、药物研发中,常用的仍是体外细胞培养模型和哺乳动物模型[5]。虽然体外细胞培养技术已经有了相当大的进步,但现有的二维细胞培养模型仍然不能完全模拟肠道结构和肠道微环境,难以实现人体肠道复杂的生理功能[6]。同时,动物实验需要较长周期、成本较高,且动物与人体的生理状态存在较大差异,难以准确地预测人体肠道的生理响应[7-8]。为更好地模拟肠道复杂的结构和功能,克服现有细胞培养和动物模型的局限,研究者们在体外细胞模型的基础上做了大量努力。如将微系统工程、微加工技术应用到细胞生物学研究中[9],通过在微流控芯片上构建出人体肠道仿生系统,开发了肠道芯片技术[10-12]。该方法的优势在于将微流体技术与微加工技术进行集成,能够在微米尺度上精确控制动态流体的流动和压力变化,以模拟肠腔内物质运输。该方法中,细胞在外界微环境的不断刺激下,展现出一些复杂的生理功能。随着微流控技术的不断进步,肠芯片得到了快速发展,已被用于药物测试与研发、肠道病理研究和肠道微生物研究等领域[13-16]。
在肠道器官芯片发展的过程中,肠芯片主要分为两种类型:二维夹膜肠芯片和三维绒毛肠芯片。初期的夹膜肠芯片结构包含由半透膜分隔的两个通道,分别为上通道和下通道。将人结直肠癌细胞 Caco-2 接种于半透膜上,可在芯片内生长形成致密单层上皮细胞,进而模拟人体肠道上皮屏障[17-19]。绒毛肠芯片可分为两类,一类是在二维夹膜肠芯片的基础上,通过有规律的拉伸多孔膜,使 Caco-2 细胞长成类肠绒毛结构,并分化出肠道上皮细胞的多种功能,提高代谢酶活性、黏液表达量,并且实现与微生物的共培养[20-21];另外一种形成绒毛的方式是将细胞培养于三维支架上,细胞可生长形成“指状结构”[22-24],但此类方式大都是静态培养,缺乏动态的流体环境,无法对体内肠道微环境进行完整的模拟[25-26]。
本研究旨在体外环境下构建一种肠道器官芯片,通过将微流控技术和细胞生物学相结合,并采用 Caco-2 细胞和可分泌黏液的 HT-29 细胞共培养体系,使其在特殊的微结构上生长形成三维绒毛结构并表达肠上皮细胞的多种功能,同时利用微通道的流体流动模拟肠腔中的营养运输。这类肠芯片既重现了肠道的绒毛结构和黏液层,又增加了流体体系,可为后续肠道微生物的相关研究、肠道生理学研究提供一个简便有效的平台。
2 材料与方法
2.1 材料
Caco-2 细胞和 HT-29 细胞均购于国家实验细胞资源共享平台;聚二甲基硅氧烷(Polydimethylsiloxane,PDMS)液体单体与固化剂购于美国 Dow Corning 公司;光刻胶 SU-8 2100 购于美国 Microchem 公司;全氟辛基三氯硅烷购于美国 Sigma-Aldrich 公司;胎牛血清购于美国 Gibco 公司;青霉素-链霉素溶液双抗、胰酶和 DMEM 培养基购于美国 Hyclone 公司;ZO-1 抗体购于美国 Thermo Fisher Scientific 公司;MUC2 抗体购于美国 Santa Cruz Biotechnology 公司;DAPI 染色液购于广州杰特伟生物科技有限公司;肉汤培养基(Luria-Bertani Broth,LB Broth) 和琼脂培养基(Luria-Bertani Agar,LB Agar)购于广东环凯微生物科技有限公司;等离子清洗仪购于美国 Harrick Plasma 公司;激光共聚焦显微镜为日本尼康公司生产制造;CO2细胞培养箱购于美国 Thermo Fisher Scientific 公司。
2.2 方法
2.2.1 硅片结构设计与制作
硅模板采用 p 型(100)单晶硅衬底进行 V 型槽制备,硅片电阻率为 1~10 Ω·cm。在制备 V 型槽前,先采用标准 RCA 方法对硅片进行清洗,并利用等离子增强化学气相沉积(PECVD)在硅片表面蒸发一层 500 nm 厚的 SiO2。然后,利用预先设计好的光刻版进行光刻工艺,其中光刻版的设计主要根据微流控芯片对硅片模板尺寸的要求进行。经过光刻工艺之后,得到图形化的 SiO2掩盖的单晶硅衬底,随后将其放到四甲基氢氧化铵和异丙醇混合溶液中。其中,四甲基氢氧化铵浓度在 5%~25% 内调节、异丙醇在 5%~20% 内调节,溶液温度在 50~90 ℃ 内调节,反应时间为 20~60 min。利用混合溶液对 Si(100)和 Si(111)晶面腐蚀速率的差异,可以对 Si(100)衬底进行各向异性腐蚀。最后,利用缓冲氧化物刻蚀液将表面的 SiO2层去除,得到所需的图形化硅模板。
2.2.2 微流控芯片制作
(1)通道 PDMS 层制作
首先,将洁净硅片放入等离子清洗仪中高档清洗 20 min,接着利用匀胶机将光刻胶 SU-8 2100 铺满整个硅片,其中匀胶转速为1 750 r/min、匀胶时间设置为 30 s。随后将硅片放在热板上 95 ℃、30 min,放凉进行去边后,再放于热板上 95 ℃ 前烘 1.5 h。然后,将掩膜放在光刻胶合适的位置进行紫外曝光,曝光后 95 ℃ 后烘 30 min。将硅片从热板上拿下,使用显影液洗去光刻胶,再用异丙醇辅助显影。最后,将显影完全的硅片放于烘箱内 180 ℃ 坚膜 30 min,完成芯片模板制备。
将 PDMS 单体与固化剂以质量比 10∶1 进行配制,并将 PDMS 混合物浇筑在芯片通道模板上,真空除气后放到 80 ℃ 烘箱 0.5 h,冷却后将 PDMS 从模板上剥离并切割整齐,同时使用外径 1.5 mm 的打孔器打孔作为出入口。
(2)微结构膜制作
将图形化的硅片模板放入真空干燥器中,同时加入熏蒸液全氟辛基三氯硅烷 20 μL,真空泵抽气 10 min 后关闭阀门,放置过夜。硅模板经表面修饰后,将 PDMS 与固化剂以质量比 15∶1 配制,并进行真空除气,随后将其倒在结构硅模板上并采用匀胶机使 PDMS 铺满硅片表面,以 800 r/min 的转速持续匀胶 30 s,待放置 2~3 min 后,将硅片放到 80 ℃ 烘箱 30 min 后取出,冷却后从边缘处揭起 PDMS 结构膜。
(3)芯片封接
将结构膜、载玻片一同放入等离子清洗仪进行第一次封接,随后将封接好的载玻片和上通道 PDMS 块再次封接。其中,第二次封接时滴加 20 μL 无水乙醇于结构膜上,显微镜下将结构膜和上通道 PDMS 块对准,待自然风干后,放 80 ℃ 烘箱约 10 min,完成微流控芯片的制作。
2.2.3 细胞培养
Caco-2 细胞和 HT-29 细胞都采用含 20% 胎牛血清、1% 青霉素-链霉素溶液双抗的 DMEM 高糖培养基进行培养,培养条件为 37 ℃、5% CO2。
芯片中的细胞培养:芯片制作好后在实验开始前,先进行紫外消毒 2 h,并将 30 μL 浓度为 3.55 mg/mL 的胶原溶液加到 1 mL 的 DMEM 溶液当中配制终浓度为 100 μg/mL 的胶原溶液。随后吸取配好的胶原溶液,注入到芯片通道入口中,使溶液进入芯片且不产生气泡,放入培养箱中 1~2 h,以对芯片通道进行表面胶原修饰。然后,将软管与芯片连接并过夜灌注培养基。最后,使用胰酶将 Caco-2 细胞和 HT-29 细胞消化下来,并制成混合悬液,将密度为 5×106cell/mL 的细胞悬液接种于通道中。待细胞沉降 2 h 后,打开注射泵以 40 μL/h 的流速培养 5 天。
2.2.4 细菌培养
实验所用菌株由肠道益生菌大肠杆菌 Nissle 1917 改造而来,导入质粒 J23101-RFP- kana 可得到表达红色荧光的菌株。
将从-80 ℃ 冰箱取出冻存的菌种放置在冰上,于超净台中使用无菌中枪头蘸取菌种并于对应抗性 LB 琼脂平板上划线(此处使用卡纳抗性平板)。随后,将平板放置在 37 ℃ 培养箱过夜培养。第二天取出该平板观察菌落生长情况,并于超净台中挑取生长旺盛且单独生长的单菌落,接种于装有 2 mL 对应抗性(此处为卡纳抗性)新鲜培养基的无菌培养管中,37 ℃、200 r/min 摇菌过夜培养。
芯片中的细菌培养:首先,细菌共培养前 12 h 将芯片所用培养基换成含有卡纳霉素的细胞培养基,进行连续灌注。其次,将培养好的细菌菌液于 8 000 r/min 室温下离心 3 min,去上清,用磷酸缓冲液(Phosphate Buffer Solution,PBS)清洗 3 次后,再次离心、弃去上清,使用细胞培养基重悬。最后,使用一次性 1 mL 无菌注射器吸取适量菌悬液,从芯片出口处打入芯片通道中,待细菌沉降 1 h 后,重新打开注射泵。在细菌培养过程中,将芯片置于激光共聚焦显微镜下观察细菌的生长增殖情况。
2.2.5 细胞表征
将肠芯片从培养箱拿出,先用 PBS 冲洗通道 3 次,接着将 4% 多聚甲醛注入通道中固定细胞,并将芯片置于细胞培养箱中孵育 15 min。然后,使用 PBS 冲洗通道去除固定剂,并向通道注入 0.3% (v/v) Triton X-100 溶液,室温下孵育芯片 15 min。孵育完成后再次使用 PBS 对通道进行冲洗,并注入 5% (w/v)牛血清蛋白封闭液,在室温下孵育 2 h。最后,为进行细胞间紧密连接表征,将 1 μg/mL ZO-1/MUC2 染料注入通道,4 ℃ 孵育过夜后,向通道注入 DAPI 染色液孵育 10 min,再次使用 PBS 清洗后,避光于激光共聚焦显微镜下观察。
3 实验结果
3.1 微流控芯片性能评价
本实验选择 PDMS 作为制作芯片的材料。该材料是微流控芯片材料中最常用的高分子聚合物,具有无毒、透气性好、成本低等优点,同时具有优越的生物兼容性。PDMS 基底属于软基底,更符合肠上皮细胞的基底软硬程度,有利于芯片内细胞的培养和观察。芯片模板采用基于 SU-8 负胶的光刻技术,制作好的模板具备良好的力学性能,可反复翻印成 PDMS 芯片,方便使用并提高实验效率。在进行 SU-8 光刻时,由于本实验所需胶层较厚,若实验过程中光刻胶溶剂挥发不充分,则易发生厚度不均匀的情况且光刻胶固化后应力太大,将会导致模板从硅基片上脱落。为避免这些问题产生,本文对相应制作工艺进行了改进。前烘时,使温度缓慢升高到 95 ℃,以延长前烘时间,前烘结束后温度从 95 ℃ 缓慢下降到室温,这样可避免光刻胶溶剂挥发不均匀。同时,坚膜温度亦采用“缓升缓降”操作,且坚膜时间不宜太久(应保持在 30 min 左右),以确保模板不会出现脱落现象。
本文设计的微流控芯片结构包括三部分:载玻片基底、带有微结构的 PDMS 膜和 PDMS 微通道层。微结构 PDMS 膜利用 PDMS 从带有微结构的硅片上翻印而成,用来模拟肠道绒毛的褶皱状结构,其中微结构硅片模板基于 p 型(100)单晶硅衬底进行 V 型槽制备,由一个个四棱锥(高 50 μm、底面为 100 μm 长的正方形)整齐排列而成。该四棱型基底膜增加了肠上皮细胞在芯片中的附着面积,且结构坡度适宜,与其他“指状结构”相比可防止细胞堆积在结构底部,有利于细胞的附着和生长。芯片中的微通道长1 cm、宽 1.5 mm、高 330 μm,代表着人体肠腔,培养基通过此通道不断地为细胞提供新鲜的营养,并冲走细胞的代谢产物。整个芯片制备流程如图 1 所示,首先将微结构膜与洁净载玻片在表面处理后进行第一次封接,然后将带有结构膜的载玻片与通道层 PDMS 块进行第二次封接,至此完成整个芯片制作。具体芯片实物图如图 2 所示。
3.2 肠道器官芯片搭建

图 1 芯片制备流程示意图Fig. 1 Schematic diagram of chip fabrication

图 2 芯片实物图Fig. 2 View of microfluidic chip
在成功制作微流控芯片的基础上,开始进行肠芯片体系的构建。本文设计的肠芯片旨在模拟肠道的三维绒毛结构和动态微环境,在体外实现肠上皮屏障功能,并支持与肠道微生物的共培养。因此,微流控肠芯片主要由 Caco-2 细胞和 HT-29 细胞在胶原修饰的微结构膜上进行共培养形成类绒毛结构。具体地,Caco-2 细胞和 HT-29 细胞以 75∶25 比例制成混合悬液接种于通道中。该比例能确保肠道上皮屏障功能并表达黏液。其中,Caco-2 细胞模拟肠上皮吸收细胞;HT-29 细胞模拟分泌黏液的杯状细胞;微通道的流动流体模拟肠道微环境中的营养运输和物质流动,且为了与真实肠道体内的流体剪切力相匹配,肠芯片的流速设计为 40 μL/h[27]。为了使细胞能更好地黏附在通道内,提前一天对芯片进行胶原蛋白修饰,并过夜灌注细胞培养基冲洗去掉多余的胶原,以利于细胞在芯片内的生长。在肠芯片培养 5 天后,若细胞连接紧密并产生黏液,即表明展现出了肠道功能,可用于后续实验。
3.3 肠道器官芯片功能表征
肠道上皮细胞间的紧密连接是肠道粘膜屏障调节的重要组成部分,也是相邻肠上皮细胞之间最主要的连接方式。其由多种跨膜蛋白组成,包括 ZO 家族蛋白(ZO-1、ZO-2 和 ZO-3 蛋白)、Occludin 蛋白和 Claudin 蛋白等。通过对染色的 ZO-1 蛋白和细胞核进行激光共聚焦显微观察发现,经过 5 天培养后,细胞长成类绒毛结构且细胞间形成紧密连接。其中,ZO-1 蛋白均匀分布在细胞膜周边且边缘清晰,被 DAPI 标记的细胞核清晰可见,具体如图 3(a)所示。同时通过对黏蛋白 MUC2 的免疫荧光染色和激光共聚焦显微观察发现,与单独在芯片中培养 Caco-2 细胞相比,Caco-2 细胞和 HT-29 细胞共培养体系中的绿色点状区域更多,所产生的黏液是 Caco-2 细胞单独培养时的 4 倍,具体如图 3(b、c)所示。这表明共培养体系与真实的人体肠道微环境更为类似,能够具有肠上皮的屏障功能。
3.4 肠芯片上细胞与细菌共培养
肠道微生物群落是人类肠道系统中重要的组成部分之一。为验证所设计的肠芯片对细菌与宿主共培养的支持情况,将带有红色荧光质粒的肠道益生菌大肠杆菌 Nissle 1917 接种在肠芯片上并进行培养,实时观察细菌的定殖、分布及生长情况。其中,细菌接种到芯片上经沉降后,未沉降的细菌将被培养基冲走。图 4 显示,经过 12 h 在芯片上的共培养后,大肠杆菌 Nissle 1917 仍然粘附在细胞表面,且与 3 h 时相比,12 h 时细菌的红色荧光明显增强,可以观察到细菌的生长增殖。从细菌分布部位来看,细菌主要分布在结构底处,如图 4 所示。为研究细菌与细胞的共培养对细胞活性造成的影响,本研究将大肠杆菌 Nissle 1917 接种于肠芯片中共培养 12 h 后,对细胞功能进行了表征。结果显示,肠上皮细胞依然具备完整的紧密连接并产生黏液,具体如图 5 所示。由此可见,该肠道芯片可以在不影响肠上皮细胞活性的基础上支持肠道细菌与肠上皮细胞的共培养并可进行实时观察。

图 3 肠芯片功能表征Fig. 3 Functional characterization of gut-on-a-chip
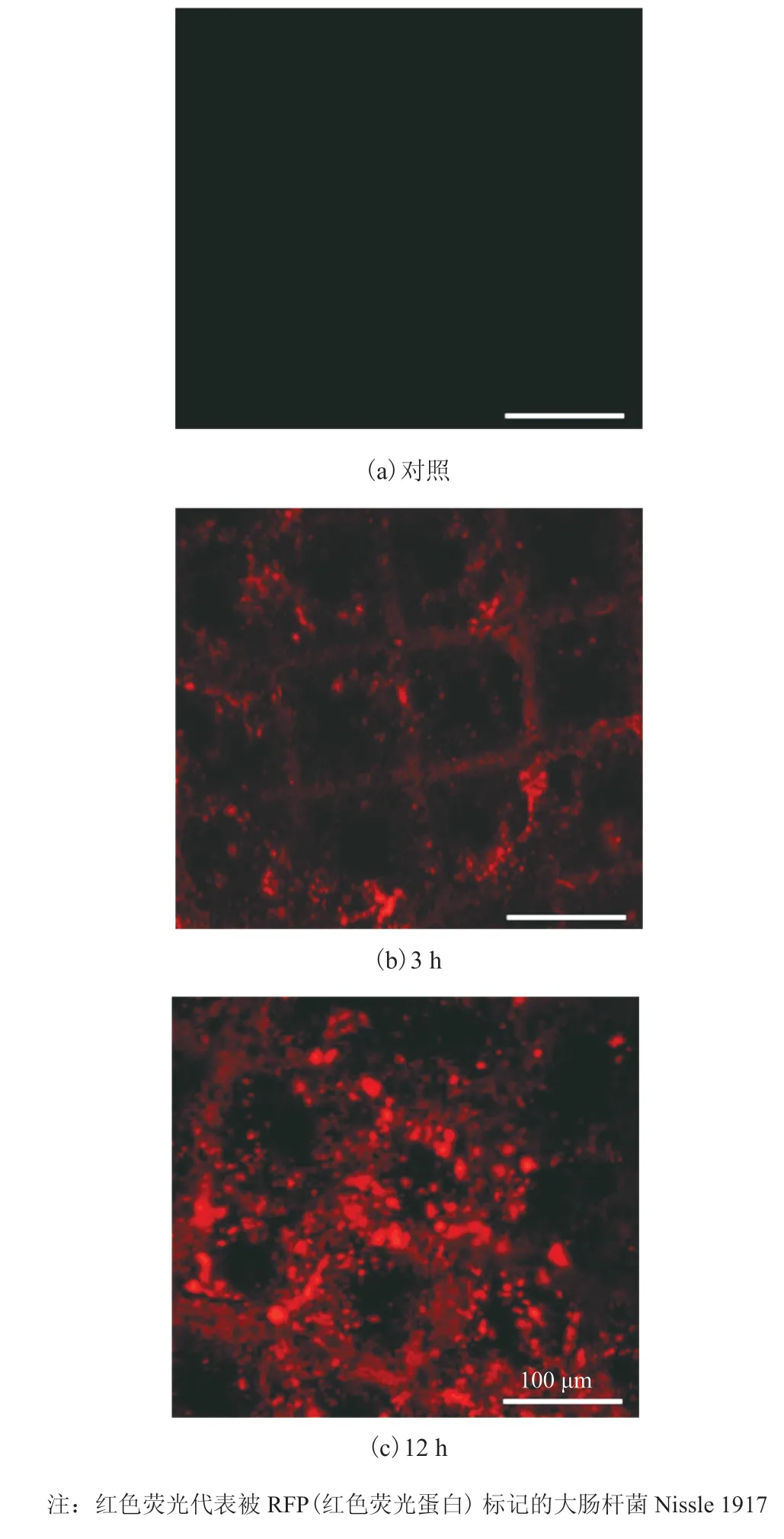
图 4 肠道细菌在芯片中的生长Fig. 4 Growth of intestinal bacteria in gut-on-a-chip
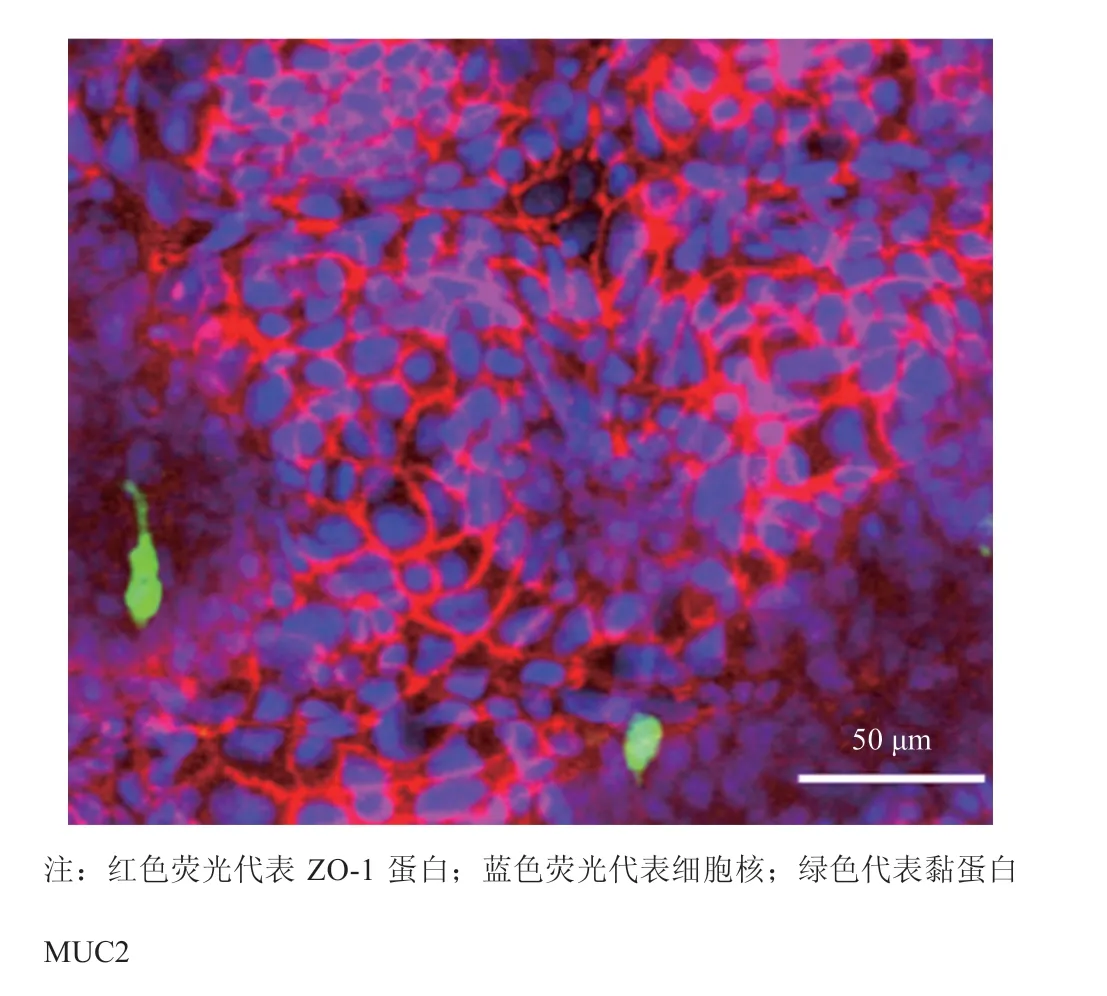
图 5 细菌共培养后的肠芯片功能表征Fig. 5 Functional characterization of gut-on-a-chip after co-culture with bacteria
4 讨论与分析
人体肠道微生物在肠道健康中起着重要作用,因此发展用于研究宿主-微生物相互作用的体外培养平台在生物医学领域变得格外重要。肠道芯片作为一个体外的仿生模型,能够结合流体剪切力、动态机械应力来模拟肠道的结构与功能,连续的流体流动体系能够及时清除细胞代谢废物,并提供新鲜营养。有研究表明,与传统体外二维细胞静态培养模型相比,在肠芯片的流体剪切力的作用下,肠道上皮的紧密连接完整性得到增加,与肠上皮细胞分化相关的氨基肽酶表达量明显提高,具有更好的肠道上皮屏障功能。并且肠芯片能结合长期拉伸的机械应力模拟肠道蠕动,诱使单层 Caco-2 细胞转变成三维绒毛形态[28-29]。
目前传统的细胞培养模型仍未能支持人类肠道细胞与活的肠道微生物稳定共培养 1~2 天以上。这是因为在体外培养过程中,微生物细胞的生长速度远超过哺乳动物细胞的生长速度。过度增长的微生物会迅速消耗掉培养基中的氧气和营养物质,随后产生过量的代谢废物(如有机酸),严重危害肠道屏障功能甚至导致肠上皮细胞死亡。而基于微流控技术的肠芯片能够利用精准的流体控制,使得只有紧紧粘附在肠道细胞表面黏液层的细菌能继续生长,而其余细菌及代谢废物将随着培养基的冲洗而被清除,确保了细菌不会过度增殖,同时避免了因养分不够或有毒代谢废物对肠上皮细胞造成破坏,因此能将共培养周期至少延长至一周,为肠道微生物与肠道细胞长期体外共培养提供了一种可靠方法。Kim 等[30]在肠芯片上实现了绿色荧光标记的非致病性大肠杆菌与肠上皮细胞的长时间共培养,并观察到肠绒毛上绿色荧光标记的大肠杆菌在 3 天内从单个细菌生长到多个菌落。Shin 等[16]使用双歧杆菌 Bifidobacterium adolescentis 和霍氏真杆菌 Eubacterium hallii 在肠芯片上与肠道细胞进行共培养,研究发现两株细菌分别与上皮细胞共培养一周后,肠道上皮细胞活力未受影响,且两株细菌都逐渐定殖于肠芯片中。上述研究表明,肠芯片在体外进行肠道微生物与肠道细胞共培养方面具有巨大潜力,可为研究肠道微生物与宿主的关系提供新的思路。
此外,大量研究中使用微结构支架来模拟绒毛的实验都通过静态培养方式来实现,虽然微结构能增加肠上皮细胞的生长面积、模拟肠道绒毛和隐窝结构,但在肠道微生物研究中,细菌和肠道细胞的共培养时间只局限在 4 h 内[26],限制了对肠道微生物与肠道生理功能间长期的动态关系分析。本研究开发了一种肠道器官芯片模型,在动态培养环境下形成绒毛结构,通过激光共聚焦显微镜成像可观察红色荧光标记的大肠杆菌 Nissle 1917 在肠芯片中 12 h 的增殖情况,结果显示经过 12 h 培养后肠道上皮细胞依然保持良好的活力。这表明集成了类绒毛微结构的肠芯片能够实现稳定的细菌与肠上皮细胞的共培养,且共培养时间至少达到 12 h,甚至更长时间,为体外分析益生菌与肠道功能间的关系提供研究基础,有助于肠道生理学研究。
然而本文在研究方法上也具有不足,如对细菌生长的研究多基于荧光图像定性分析,更准确的方法应结合流式细胞仪计数、光密度值测定等研究手段进行定量分析。此外,本研究关注于细菌自身的生长,且在肠芯片中的培养时间只限于 12 h,没有对更长期的培养时间进行研究。因此,在未来的工作中,将会延长共培养周期,结合定量分析手段,考察细菌在长时间共培养过程中的生理特性变化情况及其对细胞的进一步影响,同时对所涉及的生物过程进行更深入的探析。
5 小 结
本文描述了一种基于微流控技术的三维肠芯片技术——利用 Caco-2 细胞和 HT-29 细胞共培养体系在芯片内形成具备黏液层的类绒毛结构,并实现了微生物与肠道细胞的共培养。实验结果显示,该肠道器官芯片具有肠道的绒毛三维结构和屏障功能,其中 Caco-2 细胞和 HT-29 细胞共培养方法大大提高了黏液的表达量,且支持肠道细菌与肠道细胞的共培养,可对细菌的生长增殖情况进行实时观察。该肠芯片以其仿生优势,可为体外进行宿主-肠道微生物相互作用分析、肠道生理学等研究提供一个有效的平台,同时可促进药物开发和药物测试研究,有望成为动物模型的有力替代。

