狼疮肾炎患者自噬水平及其对足细胞相关蛋白表达水平的影响
李张红 张瑞瑞 罗秋菊
719000 榆林,陕西省榆林市第一医院肾内科
狼疮肾炎(lupus nephritis,LN)是指系统性红斑狼疮(systemic lupus erythematosus,SLE)合并双肾不同病理类型的免疫性损害,以蛋白尿、血尿、肾功能障碍等为临床主要表现[1]。足细胞即肾小囊脏层上皮细胞,分布于肾小球基底膜(glomerular basement membrane,GBM)外侧,与GBM、血管内皮细胞(vascular endothelial cell,VEC)共同组成肾小球血液滤过屏障,维持着体内离子渗透压和酸碱平衡。足细胞损伤为LN的主要病理机制,而自噬参与了该过程[2]。自噬是真核生物特有的保护机制,具有降解受损细胞器、消化并循环利用大分子物质、维持细胞内环境稳定的作用[3]。既往资料显示糖尿病肾病、肾缺血再灌注损伤(renal ischemia-reperfusion injury,RIRI)、膜性肾病等肾脏疾病病理过程与自噬有关[4],但自噬在LN发生及进展中的作用尚不清楚。本研究就LN患者自噬水平及其对足细胞相关蛋白表达水平的影响进行了探讨,以期为LN诊疗提供参考。
资料与方法
一、研究对象及分组
选择2017年5月至2019年5月期间于榆林市第一医院收治的69例LN患者为LN组,50例SLE患者为SLE组,50例因肾恶性肿瘤、肾损伤等行肾切除手术患者为对照组。LN组:男28例,女41例;年龄18~60岁,平均年龄(37.7±5.5)岁;病程1~9年,平均病程(3.0±1.2)年。SLE组:男20例,女30例,年龄20~59岁,平均年龄(37.7±5.6)岁,病程1~8年,平均病程(3.5±1.3)年。对照组:男19例,女31例,年龄18~58岁,平均年龄(36.5±5.2)岁。3组一般资料无显著性差异(P>0.05)。
纳入标准:(1)LN患者符合《狼疮肾炎诊治循证指南(2016)解读》中LN诊断标准[1];(2)无肾小球肾炎;(3)无过敏性疾病;(4)无其他自身免疫系统疾病;(5)签署知情同意书。排除标准:(1)合并恶性肿瘤;(2)合并IgA肾病、糖尿病肾病、局灶性节段性肾小球硬化(focal semental glomerulo-sclerosis,FSGS)、特发性膜性肾病(Idiopathic membranous nephropathy,IMN)等有足细胞损害的疾病;(3)合并血液疾病;(4)合并重要脏器功能障碍;(5)妊娠或哺乳期妇女。本研究上报我院医学伦理委员会并获得批准。
二、方法
1.肾脏足细胞内自噬体数量测定 选取LN组、SLE组肾脏活检组织和对照组手术切除的正常肾组织,固定,冲洗,脱水,包埋,固化,切成50~60 nm厚度超薄切片,在透射电镜下选择5~7个足细胞进行观察,记录足细胞内自噬体数量,取平均数。
2.LC3、Beclin-1、Podocin、Nephrin蛋白表达 采用Western Blot检测。选取LN组、SLE组肾脏活检组织和对照组肾组织,匀浆,裂解,离心,提取蛋白,使用BCA试剂盒(上海索宝生物科技有限公司)对蛋白定量,取总蛋白上样,电泳,切胶,转膜,封闭,加入1∶200稀释的LC3单克隆抗体一抗(武汉艾美捷科技有限公司)、1∶300稀释的Beclin-1单克隆抗体一抗(武汉巴菲尔生物技术服务有限公司)、1∶200稀释的Podocin单克隆抗体一抗(上海研卉生物科技有限公司)、1∶400稀释的Nephrin单克隆抗体一抗(武汉博欧特生物科技有限公司)、1∶500稀释的GAPDH单克隆抗体一抗(上海子起生物科技有限公司),4℃孵育过夜,洗膜,加辣根过氧化物酶(high reliability program,HRP)标记的山羊抗兔二抗(北京泰泽瑞达科技有限公司),37℃孵育60 min,洗膜,ECL发光试剂盒(上海樊克生物科技有限公司)显色,洗片后显影、定影,应用Image Quant TL软件进行分析,GAPDH为内参蛋白,以目的蛋白与内参蛋白的灰度值之比计算LC3、Beclin-1、Podocin、Nephrin蛋白表达水平。
3.分离LN患者肾脏足细胞及处理 选取69例LN患者肾脏活检组织,PBS清洗,剪碎,分离单个核细胞,采用免疫磁珠法分选法分离足细胞,采用间接免疫荧光法鉴定足细胞,采用流式细胞术检测足细胞纯度,直至足细胞纯度达到95%。将足细胞分为正常对照组、自噬抑制组、自噬诱导组,用含10%胎牛血清的DMEM培养液,于37℃、5% CO2培养箱中培养,培养48 h换液,待细胞达到80%~90%融合时,用0.25 g/L胰酶溶液消化,以1×106个细胞接种于培养瓶进行传代,培养48 h换液,3~4 d传代1次,取对数生长期的足细胞,制成5×106个/mL细胞悬液,接种于6孔细胞培养板(100 μL/孔),加入含10%胎牛血清的DMEM培养液,于37℃、5% CO2培养箱中培养,细胞贴壁后换液,待细胞达到80%~90%融合时,正常对照组加入100 nmol/L生理盐水(上海士锋生物科技有限公司),自噬抑制组加入100 nmol/L 3-MA(南京赛泓瑞生物科技有限公司),自噬诱导组加入100 nmol/L RAPA(上海经科化学科技有限公司),继续培养12 h,然后检测自噬抑制组和自噬诱导组足细胞内自噬体数量及LC3、Beclin-1、Podocin、Nephrin蛋白表达量,具体操作同上。
三、统计学方法
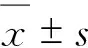
结 果
一、LN组、SLE组、对照组肾脏足细胞内自噬体数量及LC3、Beclin-1蛋白表达量
对照组自噬体数量1~2个,SLE组自噬体数量2~4个,LN组自噬体数量4~6个。SLE组肾脏足细胞内自噬体数量及LC3、Beclin-1蛋白表达量显著高于对照组(P<0.05);LN组肾脏足细胞内自噬体数量及LC3、Beclin-1蛋白表达量显著高于SLE组(P<0.05)。(表1、图1)

表1 LN组、SLE组、对照组肾脏足细胞内自噬体数量及LC3、Beclin-1蛋白表达量
注:与对照组比较,aP<0.05;与SLE组比较,bP<0.05
二、LN组、SLE组、对照组Podocin、Nephrin蛋白表达量
LN组Podocin、Nephrin蛋白表达量显著高于对照组(P<0.05);LN组Podocin、Nephrin蛋白表达量显著高于对照组(P<0.05)。(表2、图1)

表2 LN组、SLE组、对照组Podocin、Nephrin蛋白表达量
注:与对照组比较,aP<0.05;与SLE组比较,bP<0.05
三、正常对照组、自噬抑制组、自噬诱导组足细胞内自噬体数量及LC3、Beclin-1蛋白表达量
正常对照组自噬体数量4~6个,自噬抑制组自噬体数量2~3个,自噬诱导组自噬体数量6~8个。正常对照组足细胞内自噬体数量及LC3、Beclin-1蛋白表达量显著高于自噬抑制组(P<0.05);自噬诱导组足细胞内自噬体数量及LC3、Beclin-1蛋白表达量显著高于正常对照组(P<0.05)。(表3、图2)

表3 正常对照组、自噬抑制组、自噬诱导组足细胞内自噬体数量及LC3、Beclin-1蛋白表达量
注:与正常对照组比较,aP<0.05;与自噬抑制组比较,bP<0.05
四、正常对照组、自噬抑制组、自噬诱导组足细胞内Podocin、Nephrin蛋白表达量
正常对照组足细胞内Podocin、Nephrin蛋白表达量显著高于自噬抑制组(P<0.05);自噬诱导组足细胞内Podocin、Nephrin蛋白表达量显著高于正常对照组(P<0.05)。(表4、图2)

表4 正常对照组、自噬抑制组、自噬诱导组足细胞内Podocin、Nephrin蛋白表达量
注:与正常对照组比较,aP<0.05;与自噬抑制组比较,bP<0.05
讨 论
SLE是一种累及多系统的自身免疫性疾病,肾脏损害是SLE常见脏器损害,约50% SLE患者可出现LN,其病情严重程度直接影响患者预后[5]。LN发病与循环免疫复合物(circulating immune complex,CIC)在肾脏沉积、T细胞介导免疫反应、原位免疫复合物形成、自身抗体直接作用、局部补体激活等有关[6]。足细胞是一种高度分化的肾小囊脏层上皮细胞,在正常情况下能够分泌GBM主要组成成分,即纤维连接蛋白(fibronectin,FN)和IV型胶原(collagen IV,COLIV),在转化生长因子β1(transforming growth factor β1,TGFβ1)、结缔组织生长因子(connective tissue growth factor,CTGF)等促肾纤维化因子刺激下还能分泌具有降解GBM作用的组织蛋白酶(cathepsin)和基质金属蛋白酶(matrix metalloproteinase,MMP),从而发挥调节GBM肌原张力、参与GBM合成、支持血管球、维持着毛细血管襻结构稳定、调节肾小球过滤功能的作用[7]。足细胞为肾小球血液滤过屏障的重要组成部分,其损伤是引发肾性疾病的主要因素[8]。SLE自身抗体可进入足细胞内而引发足细胞损伤,足细胞损伤为LN的主要病理机制之一[9]。有研究显示自噬水平升高与肾性疾病免疫介导的损伤之间具有相关性,自噬参与了足细胞损伤过程[10]。自噬是细胞内高度保守的降解机制,广泛存在于真核生物细胞内,常见于生理和病理过程中,能够降解受损细胞器、氧化脂质体、大分子物质、病原微生物等,为维持肾小球稳态的关键机制。相关研究发现自噬可参与肾脏疾病发生及发展,自噬体数量在糖尿病肾病、RIRI、膜性肾病等多种肾性疾病肾活检组织足细胞内发生异常变化[11]。
本研究显示LN组肾脏足细胞内自噬体数量显著高于对照组、SLE组,这与Aguilar A等人[11]研究结果相符,提示LN患者自噬水平呈升高状态。LC3B是自噬体膜上的标志蛋白,能够参与自噬体形成,常用于检测哺乳动物自噬活性和评估自噬体程度。Beclin-1是自噬体成核的关键分子之一,B淋巴细胞瘤/白血病-2(B cell leukemia-2,Bcl-2)可通过Beclin-1的BH3结构域与Beclin-1结合而影响其活性,进而调控自噬体形成[12]。有关研究发现足细胞损伤中伴随有LC3B、Beclin-1水平升高的现象[13],这与本研究相符;本研究显示LN组LC3、Beclin-1蛋白表达量显著高于对照组、SLE组,提示自噬水平升高与LN发生相关。Nephrin、Podocin均为足细胞相关蛋白,Nephrin是肾小球足细胞完整膜蛋白,定位于足突裂孔膜伸入足突膜上,Podocin是肾小球足细胞跨膜蛋白,特异性表达于裂孔隔膜上,两者共同维持着足细胞正常形态及功能。Nephrin、Podocin共同形成的裂孔隔膜复合体,与足突之间相互连接形成裂孔隔膜,被视为肾小球大分子蛋白滤过的最后一道屏障[14]。有研究证实Nephrin、Podocin水平异常是肾脏疾病蛋白尿形成的主要原因,两者水平与足细胞损伤均呈负相关[15]。本研究显示LN组Podocin、Nephrin蛋白表达量显著高于对照组、SLE组,提示足细胞相关蛋白Podocin、Nephrin在LN患者中呈高表达。本研究进一步进行基础实验得到了相同结果,采用RAPA诱导自噬,3-MA抑制自噬,发现自噬诱导组足细胞内自噬体数量及LC3、Beclin-1、Podocin、Nephrin蛋白表达量显著高于自噬抑制组、正常对照组,说明自噬水平升高可能通过上调足细胞相关蛋白Podocin、Nephrin水平而减轻足细胞损伤,抑制LN病情进展,这为临床防治LN提供新思路。
综上所述,LN患者自噬水平呈升高状态,自噬水平升高可能通过上调足细胞相关蛋白Podocin、Nephrin水平而减轻足细胞损伤,抑制狼疮肾炎病情进展。但本研究纳入病例数较少,研究时间较短,有待扩大样本和时间进一步研究。

