干扰VIRMA基因对胃癌细胞迁移的影响和机制研究
代聪聪,吴立胜,缪 冉,朱志强
胃癌是人类世界癌症医学中最艰难的挑战之一,其发病率在东亚最高,且其致死率也排在恶性癌症的前列。胃癌是中国最为常见的癌症之一,仅次于肺癌。伴着医疗行业整体的不停进步,胃癌的诊断方法及治疗手段得到很大程度的提升,但胃癌的局部复发和远处转移依然影响着患者的生存预后,胃癌病人现阶段的5年生存率仍不能达到比较满意的水平[1-2]。因此,探索影响胃癌转移机制的生物新靶点对于提高胃癌患者生存预后有重大意义。
6-甲基腺苷(N6-methyladenosine, m6A)属于真核生物mRNA转录后修饰中含量最为丰富的一种方式,对调节mRNA剪接、翻译和稳定性等方面有着非常重要的影响。m6A动态调控蛋白包含甲基转移酶(Writers),去甲基化酶(Erasers)及读取基因(Readers)这三类[3]。甲基转移酶被发现是一种可以催化甲基化过程的多因子复合物,是由METTL3、METTL14、WTAP、VIRMA、RBM15和ZC3H13蛋白组成的[4]。已有研究[4-9]表明,m6A相关蛋白以不同的角色影响肿瘤的发生和发展,如乳腺癌、急性髓性白血病、胆管癌、肝细胞癌和膀胱癌等。VIRMA作为近年来发现的m6A甲基转移酶的重要组成部分,尚不清楚其在胃癌的发生和发展进程中的具体作用。该研究构建VIRMA干扰胃癌细胞株,探究其对胃癌细胞迁移功能的影响并对其机制进行初步探究。
1 材料与方法
1.1 细胞来源及细胞培养人胃癌MGC803和SGC7901细胞株从中国科学院上海生命科学研究院生物化学与细胞生物学研究所购入。胃癌细胞MGC803和SGC7901细胞株在有1%链霉素-青霉素混合物(美国Gibco公司)和10%胎牛血清(美国Gibco公司)的1640培养基(美国Gibco公司)中进行培养,在温度37 ℃、CO2体积为5%的细胞培养箱(美国Thermo Fisher Scientific公司)中进行培养。
1.2 细胞转染用含10%胎牛血清的1640培养液培养人胃癌MGC803和SGC7901细胞至细胞融合度为60%~70%,然后按照相关制造商的说明书(上海Obio公司),用VIRMA干扰慢病毒和pLKD-CMV-G &PR-U6阴性对照载体感染细胞,感染细胞24 h后使用新鲜培养液继续培养。然后用内含10%胎牛血清和8 μg/ml嘌呤霉素的1640培养液培养筛选2周,扩增筛选后的细胞株,将稳定转染的干扰组和对照组胃癌细胞分别命名为shVIRMA组和shRNA-NC组。
1.3 实时荧光定量PCR对培育的胃癌细胞中使用TRIzol试剂(美国Invitrogen公司)萃取细胞中总的RNA,用Primescript RT试剂(日本TaKaRa 公司)逆转录合成cDNA。用ChamQ SYBR qPCR Master Mix试剂盒(南京诺唯赞生物公司)进行qRT-PCR的mRNA检测和分析。应用于qRT-PCR的引物序列:VIRMA上游序列:5′-GAGTAAGAGCCCATAGCA GT-3′,下游序列: 5′-TAGCACCAGACCATCAGTA TTCAC-3′;FN1上游序列: 5′-AGGAAGCCGAGGTT TTAACTG-3′,下游序列: 5′-AGGACGCTCATAAGTG TCACC-3′;β-actin上游序列: 5′-AGCGAGCATC CCCCAAAGTT-3′,下游序列: 5′-GGGCACGAAGG CTCATCATT-3′。PCR实验的化学反应的总体积为10 μl:Mix 5 μl、Rox 0.2 μl、上游和下游引物各0.2 μl、ddH2O 3.4 μl、cDNA 1 μl。PCR实验的化学反应的扩增条件:95 ℃控温开始进行预变性30 s;95 ℃控温进行变性5 s;60 ℃进行控制温度30 s,共扩增循环40次。参照选取β-actin,实验设置3个副孔,选取2-ΔΔCt方法去计算mRNA表达量的相对变化。实验操作均遵循试剂制造商的说明书。
1.4 蛋白质印迹实验挑选生长增殖情况处于优良的胃癌细胞,遵循试剂说明书,加入裂解缓冲液及蛋白酶抑制剂(上海碧云天公司),置于冰上15 min后刮取细胞裂解物,4 ℃的温度下使用13 000 r/min的转速进行离心12 min,抽取离心后的部分上层液体并按照BCA蛋白质测定试剂盒(上海碧云天公司)的说明指导定量蛋白质的浓度,后加入蛋白上样缓冲液水浴煮沸变性6 min,保存在-80 ℃冰箱。制作浓度为13%的(SDS-PAGE)凝胶用于电泳,蛋白上样后电泳,使用湿转法转膜,脱脂牛奶封闭。清洗,分别放入相对应一抗抗体中4 ℃过夜。次日洗膜,分别放入相对应二抗抗体常温置于摇床上孵育1 h。随后洗膜,加入显色液,曝光及观察结果。
1.5 CCK-8实验挑选生长增殖情况处于优良的胃癌细胞,制备成细胞密度为16 000/ml的含血清细胞悬液,在96孔板的每个小孔中滴入100 μl的细胞悬液然后放置于培养箱中培育,每组细胞设置3个副孔。每隔24 h,滴入含有10% CCK-8的不含血清的1640培养基,在培养箱中放置培养1 h,然后应用酶标仪对实验对象读取其在450 nm的数据并分析。
1.6 Transwell实验
1.6.1细胞迁移实验 挑选生长增殖情况处于优良的胃癌细胞,应用胰酶消化离心后重新悬浮并吹打均匀下层积淀的细胞时应用不含有血清的培养基,校准细胞悬浮液的密度为2×105/ml。使用移液枪以200 μl的体积将细胞悬浮液滴入Transwell小室上室,在小室下室以650 μl的体积加入含有10%胎牛血清的培养基,放在培养箱中继续培育。24 h后从细胞培养箱中拿出Transwell小室,吸除上室培养液并应用PBS仔细清洗3次,然后加入95%乙醇来固定,待35 min后吸除乙醇,自然情况下风干小室。应用0.1%结晶紫试剂对细胞染色35 min,后应用PBS仔细清洗3遍。100倍光学显微镜下拍照及记数。
1.6.2细胞侵袭实验 将Matrigel基质胶(美国BD公司)和无血清1640培养基按照1 ∶15的溶液比例进行稀释混合后,加入到Transwell小室的上层小室内,在37 ℃培养箱中放置2 h待其成形为凝胶,后续实验步骤与细胞迁移实验相同。
1.7 细胞划痕实验挑选生长增殖情况处于优良的胃癌细胞,按照每孔2×105个细胞的数量铺在6孔板中,随后将新鲜的含有10%血清的液体培养基加入6孔板,等候细胞增殖到生长融合度超过75%时,以100 μl移液枪头为工具在直尺的辅助下划十字直线于培养板上,应用PBS仔细清洗3次,换入不含血清的液体培养基,应用显微镜对划线结果进行拍照,后放回培养箱中继续培育。24 h后仔细吸除旧培养基,应用PBS清洗3次,40倍光学显微镜下查看并拍照,然后进行测量及统计。

2 结果
2.1 慢病毒转染成功抑制VIRMA mRNA表达使用pLKD-CMV-G &PR-U6阴性对照载体和VIRMA干扰慢病毒感染胃癌MGC803和SGC7901细胞,实时荧光定量PCR法检测shRNA-NC组和shVIRMA组细胞中VIRMA mRNA的表达水平。相较于shRNA-NC组,shVIRMA组细胞中VIRMA mRNA的表达水平降低,差异有统计学意义(t=10.52、15.54,P<0.05)。见图1。
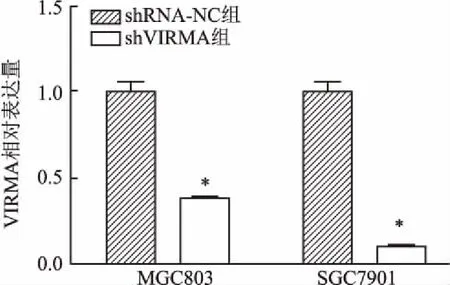
图1 实时荧光定量PCR检测VIRMA mRNA表达水平与shRNA-NC组比较:*P<0.05
2.2 慢病毒转染成功抑制VIRMA蛋白表达使用蛋白质印迹法检测shRNA-NC组和shVIRMA组细胞中VIRMA蛋白的表达水平。结果显示shVIRMA组细胞中VIRMA蛋白相对表达量低于shRNA-NC组。荧光定量PCR实验的检测结论与蛋白质表达结论相一致,表明慢病毒在胃癌细胞中成功降低了VIRMA基因的表达,可在后续实验中使用。差异有统计学意义(t=50.75、47.27,P<0.05)。见图2。

图2 蛋白质印迹法检测VIRMA 蛋白表达水平与shRNA-NC组比较:*P<0.05
2.3 干扰VIRMA抑制胃癌细胞的增值使用CCK-8法检测shRNA-NC组和shVIRMA组的胃癌细胞增殖情况。结果显示shVIRMA组胃癌细胞的生长能力弱于shRNA-NC组胃癌细胞,差异有统计学意义(t=4.424、t=16.14;t=3.359、t=5.934,P<0.05)。见图3。

图3 CCK-8法检测细胞增殖能力A:MGC803;B:SGC7901;与shVIRMA组比较:*P<0.05
2.4 干扰VIRMA抑制胃癌细胞的迁移对胃癌MGC803和SGC7901细胞分别进行Transwell细胞实验。24 h后shRNA-NC组胃癌细胞迁移和侵袭个数多于shVIRMA组,差异有统计学意义(t=15.42、42.68;t=22.48、14.59,P<0.05)。见图4。
2.5 干扰VIRMA抑制胃癌细胞的划痕愈合能力划痕实验进一步检测及分析抑制VIRMA基因表达对胃癌细胞的迁移潜能的影响。24 h后shVIRMA组划痕愈合率较shRNA-NC组低,差异有统计学意义(t=30.28;t=12.43,P<0.05)。见图5。

图4 Transwell实验检测胃癌细胞迁移和侵袭能力A:迁移实验 ×100;B:侵袭实验 ×40;与shRNA-NC组比较:*P<0.05
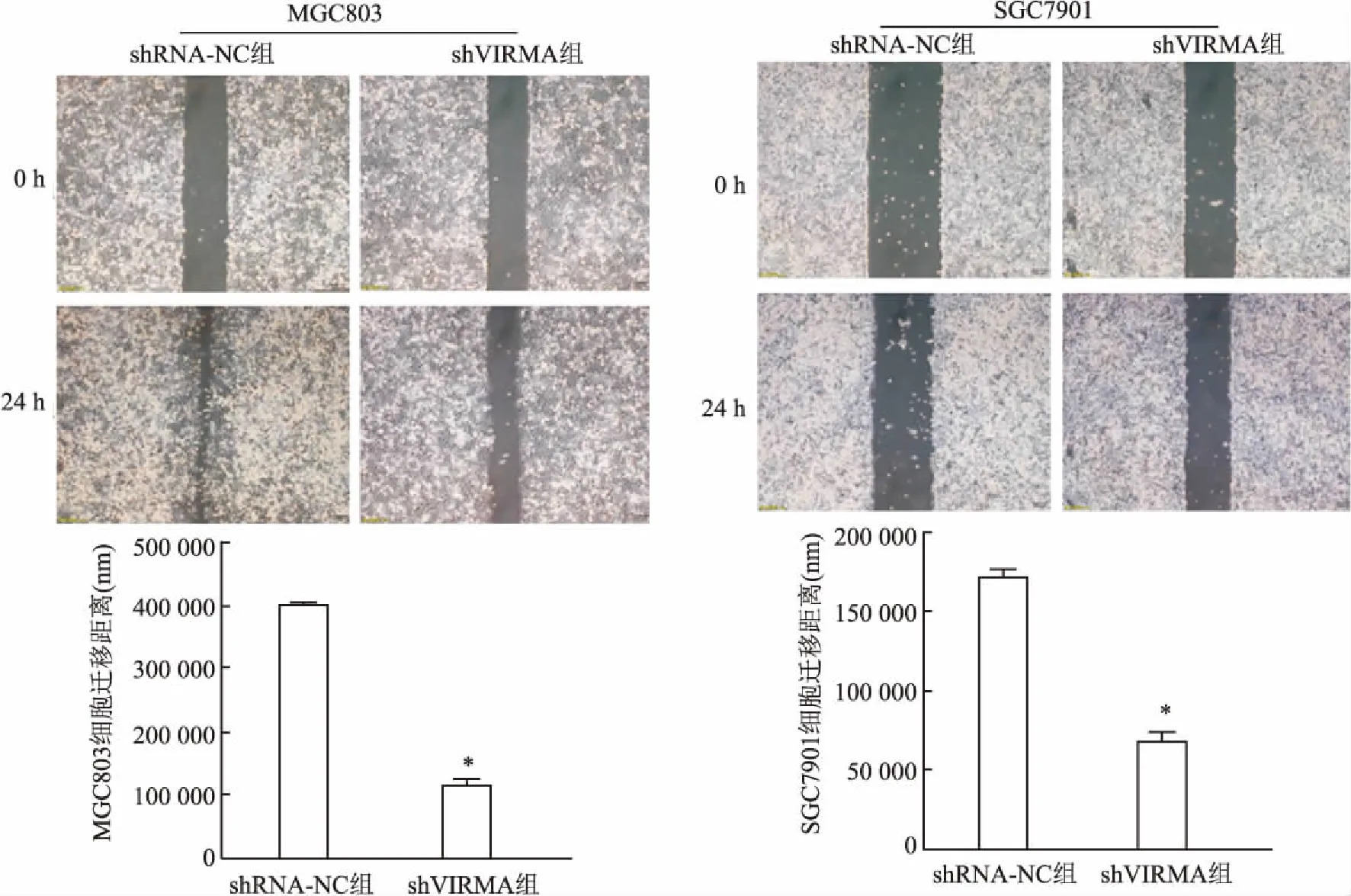
图5 划痕实验检测细胞迁移能力与shRNA-NC组比较:*P<0.05
2.6 干扰VIRMA影响FN1的mRNA和蛋白表达蛋白质印迹法和实时荧光定量PCR法检查干扰VIRMA基因后,胃癌细胞中FN1基因的表达变动程度。结果显示,shVIRMA组和shRNA-NC组对比,FN1的mRNA和蛋白表达量均受到了抑制的影响,差异有统计学意义(t= 5.731、4.224;t=32.42、49.17,P<0.05)。见图6。
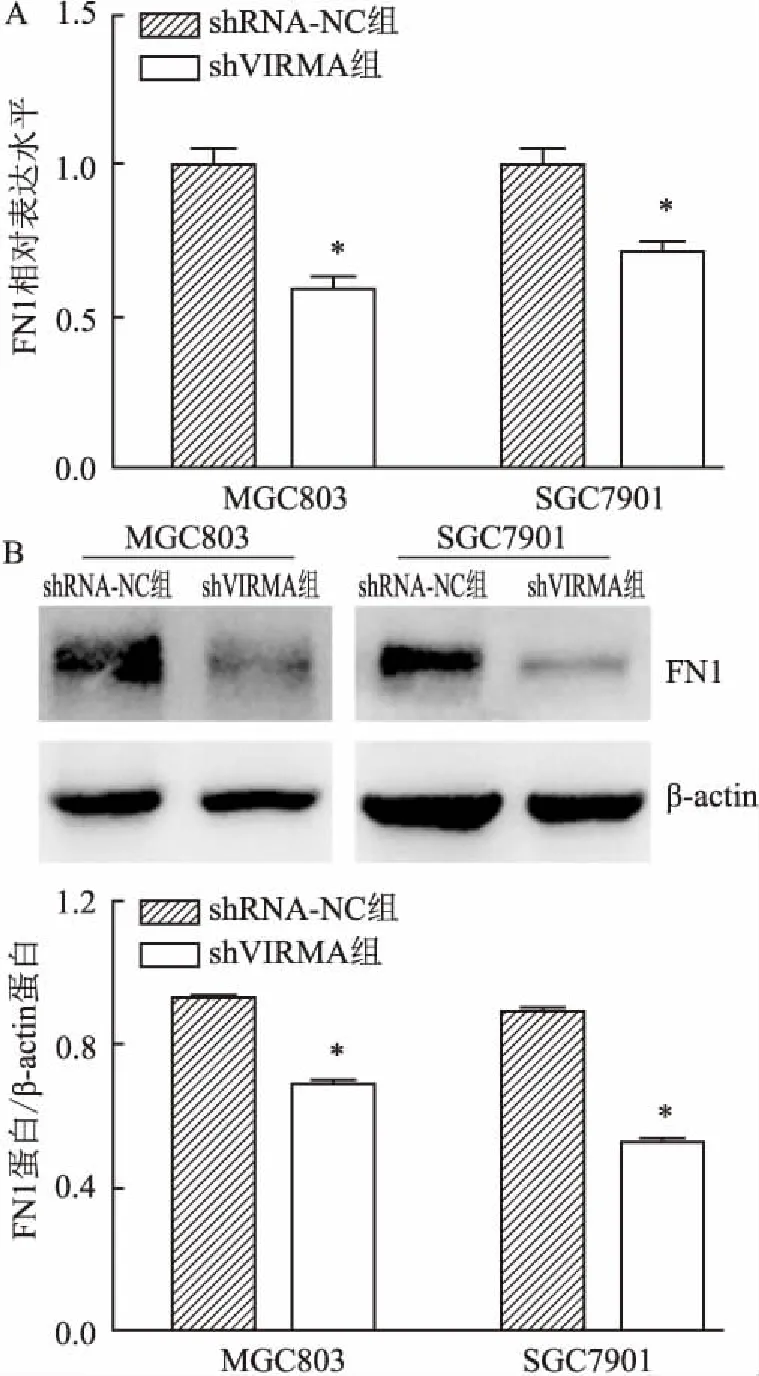
图6 胃癌细胞中FN1 mRNA和蛋白相对表达水平
3 讨论
RNA甲基化已在mRNA、miRNA、incRNA、rRNA和snRNA等多种RNA中发现,m6A甲基化在真核细胞中为含量最为丰富的mRNA化学修饰。先前的研究[4-5]表明m6A修饰有许多动态蛋白参与调控,其中甲基转移酶是由多个蛋白组成的复杂物质,由METTL3、METTL14、WTAP、RBM15、VIRMA及ZC3H13几个主要成分构成。最近研究[6-10]表明,m6A相关蛋白与不同类型的癌症细胞的发生和发展进程有一定的关系,如METTL3是急性髓性白血病生长的必须基因,是基于染色质的这一途径用于维持急性髓性白血病所需要的调节剂,METTL3基因表达的降低将导致癌症细胞周期出现停滞,白血病细胞分化受阻。m6A甲基化修饰对于胶质母细胞瘤干细胞(glioblastoma stem cells,GSC)肿瘤发生及自我更新进程至关重要,METTL14或METTL3基因的表达减少可以促进人GSC细胞的增殖。然而,GSC的增殖会因为RNA脱甲基酶FTO的降低或者METTL3的过量表达而受到抑制。WTAP过表达可以对胆管癌细胞的迁移和侵袭产生积极作用,干扰WTAP基因则降低胆管癌的侵袭和转移[11]。ZC3H13通过调节K-ras和ERK信号的表达,在抑制结直肠癌中侵袭和增殖中发挥着重要作用[12]。VIRMA作为m6A甲基转移酶复合物中的重要一员,但VIRMA在胃癌转移中的作用仍未见相关研究。
为探究VIRMA对胃癌转移的影响,使用慢病毒分别转染胃癌MGC803和SGC 7901细胞,建立胃癌VIRMA干扰细胞株。结果表明,慢病毒干扰组的VIRMA mRNA和蛋白表达均较对照组降低,根据Transwell小室实验结果及细胞划痕实验的测试结果,发现胃癌的划痕愈合和迁移能力较实验对照组均受到了抑制。因此,降低VIRMA基因的表达水平可以使胃癌的转移能力受到抑制。
癌细胞与细胞外基质的相互作用包括增殖、存活、侵袭和转移等都对癌细胞至关重要,而FN1在细胞外基质中含量丰富。FN1作为一种从属于细胞外基质结构的糖蛋白,在多种类型的已知癌症中表达比正常组织高,例如肛门癌、乳腺癌、头颈部鳞癌和卵巢癌。功能试验表明,FN1参与细胞增殖、胚胎发育、伤口愈合、血小板聚集宿主防御、凝血、EMT、转移等生物学过程。已有研究[13-15]报道FN1在一些肿瘤的转移中发挥比较重要作用。如FN1的表达降低则抑制肺癌的迁移能力,诱导细胞凋亡。FN1也是皮肤鳞状细胞癌、脑胶质母细胞瘤和喉部鳞状细胞癌等疾病进展和转移的关键介质。有研究证明通过激活MMP2/MMP9通路,FN1表达的增加可以对胃癌细胞的迁移和侵袭能力产生积极效应。FN1也被认为是胃癌的潜在预后生物标志物。为了探讨VIRMA参与胃癌转移过程的相关分子机制,本研究选取了参与细胞运动和基质侵袭转移的基因FN1作为靶基因。
本研究显示,VIRMA基因受到干扰后,降低了胃癌细胞株MGC803和SGC 7901的体外迁移能力,FN1基因的mRNA量和蛋白表达量也受到了降低的影响。这表明敲低VIRMA基因可以降低胃癌细胞的转移潜能,可能与细胞外基质糖蛋白分子FN1有关。综上所述,本研究表明敲低甲基转移酶VIRMA可抑制胃癌细胞的转移能力,其机制可能与抑制细胞外基质糖蛋白分子FN1的表达相关。

