G蛋白偶联受体激酶2杂合子敲除小鼠构建及表型鉴定
陶 娟,周伟杰,邰 宇,郭派派,周正炜,王 珍,汪庆童,魏 伟
G蛋白偶联受体激酶2(G protein-coupled receptors kinase 2, GRK2)属于GRKs家族的一种调控蛋白,广泛分布于各种组织器官中[1]。GRK2磷酸化被配体激活的G蛋白偶联受体(G protein-coupled receptors, GPCRs),使其磷酸化,随后募集β-arrestin,引起GPCRs的脱敏和内吞,GRK2还可以特异性调控丝裂原激活的蛋白激酶(mitogen-activated protein kinase, MAPK)、磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)等细胞信号传导,在细胞及组织的生长发育中起到重要作用[2]。课题组近期研究[3]发现,GRK2是GPCRs信号与胰岛素受体相互作用的关键接头分子,在GPCRs与细胞因子受体的交叉联系中也发挥重要转导作用。大量研究表明,GRK2参与了多种慢性疾病的发病过程,如心力衰竭[4]、类风湿关节炎[5]等,目前GRK2被认为是诊断心血管系统疾病的生物标志物及治疗靶点,多个GRK2抑制剂处于研究阶段[6]。为揭示GRK2在疾病的进程中发挥了至关重要的作用,利用CRISPR/Cas9技术构建GRK2基因敲除小鼠,有报道表明GRK2基因全敲除可引起胚胎致死,所以利用该技术构建GRK2基因半敲除小鼠(GRK2+/-)模型,并对GRK2+/-与同背景的野生型小鼠交配得的后代子鼠进行基因型鉴定和体质量的检测,并检测GRK2+/-小鼠多个组织中GRK2蛋白的表达,验证GRK2+/-小鼠的成功构建。
1 材料与方法
1.1 实验动物GRK2基因杂合敲除小鼠以C57BL/6为背景,饲养于SPF实验室,由江苏集萃药康生物科技有限公司提供,生产许可证号:SCXK(苏) 2015-0001。所有实验均得到安徽医科大学临床药理研究所动物实验伦理委员会批准。
1.2 主要试剂PGK1.1线性载体由江苏集萃药康生物科技有限公司提供;核酸染料购自上海天能科技有限公司;琼脂糖凝胶购自美国Genetech公司;Genotyping Mix购自美国KapaBiosystems公司;抗GAHDH抗体购自美国Proteintech公司;抗GRK2抗体购自美国Santa Cruz公司;辣根酶标记的山羊抗鼠IgG购自北京中杉金桥生物公司。
1.3 方法
1.3.1Cas9/先导RNA(single guide RNA, sgRNA)载体构建 小鼠GRK2基因定位于第19号染色体上,基因ID为11035,包括21个外显子。根据sgRNA设计原则,选择外显子3、4、5作为设计靶位点(图1),利用美国麻省理工学院CRISPR Design软件(http://crispr.mit.edu)设计筛选得到一对sgRNA,为GRK2-S1(GGCAGAAGTCCCGGAAAAG C)、GRK2- S2(TCTGGAAGAGGCCAAGCCCT),分别识别前间区序列邻近基序为AGG和TGG。将设计的sgRNA寡核苷酸单链利用PCR仪退火形成双链,反应体系见表1,反应程序为37℃ 30 min,95℃ 5 min,缓慢冷却至25℃(5 ℃/min)。然后将双链sgRNA与线性化载体PGK1.1 linear vector在T4 DNA连接酶作用下16℃过夜连接,连接产物转染到DH5a感受态细胞,通过PCR和基因测序挑选阳性克隆产物,完成sgRNA载体构建。
1.3.2F0代GRK2+/-小鼠获得 将体外转录的sgRNA与Cas9 mRNA混合后显微注射到C57BL/6小鼠受精卵中,将受精卵移植进C57BL/6雌性小鼠体内,生产出10只F0代小鼠。
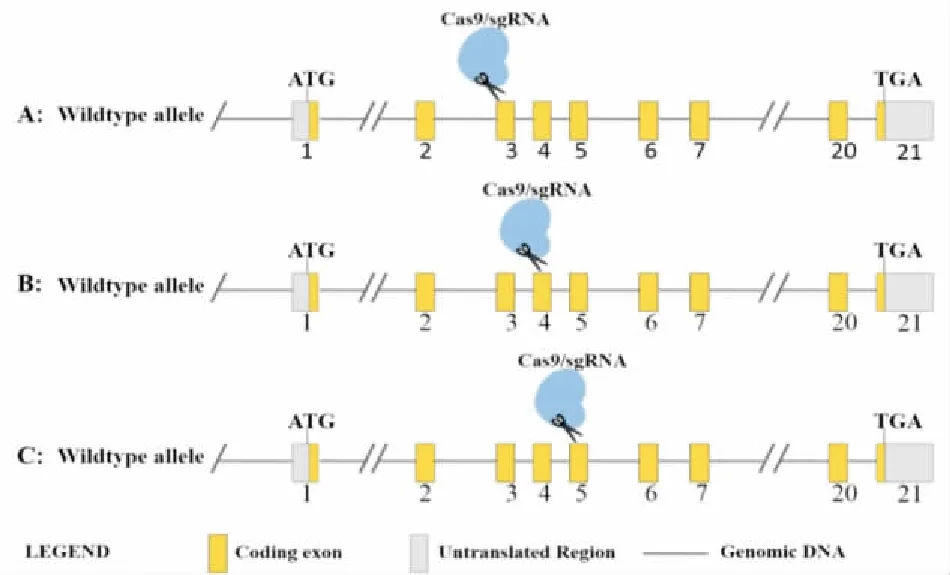
图1 利用CRISPR/Cas9系统构建GRK2基因敲除策略

表1 sgRNA PCR退火程序的反应体系
1.3.3基因型鉴定
1.3.3.1鼠尾DNA提取 待F0代子鼠2周大时,剪小鼠尾巴(长不超过0.2 cm),放入1.5 ml EP管中,加入490 μl鼠尾裂解液(100 ml裂解液中含5 ml 10% SDS、2 ml 5 mol/L NaCl、1 ml 1 mol/L Tris·HCl、10 ml 0.5 mol/L EDTA、82 ml H2O)和10 μl的蛋白酶K(10 mg/ml),混匀以后将EP管放入60 ℃水浴锅中消化鼠尾过夜,随后煮沸10 min终止裂解。高速离心机10 000 r/min 离心10 min后取上清液进行PCR检测。
1.3.3.2PCR扩增反应 引物由上海Invitrogen公司合成。引物序列、PCR反应体系及程序见表2、3、4。
1.3.3.31%琼脂糖凝胶电泳 1×TAE buffer 30 ml,加入琼脂糖0.3 g及1 μl的核酸染料,取上述PCR扩增产物10 μl,电压120 V,电泳30 min,于Tanon-1600全自动数码凝胶图像分析系统(上海天能公司)中拍照观察。
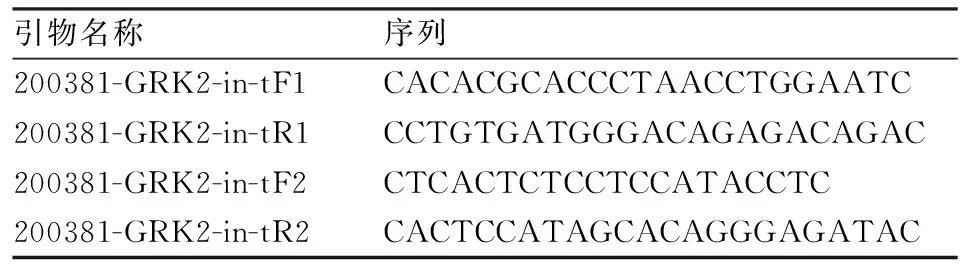
表2 GRK2+/-小鼠基因鉴定引物序列

表3 GRK2+/-小鼠基因鉴定PCR反应体系

表4 GRK2+/-小鼠基因鉴定PCR反应程序
1.3.4GRK2+/-小鼠的饲养繁育 GRK2+/-小鼠于SPF级实验室饲养及繁殖。昼夜明暗交替时间为12/12,小鼠饲料,垫料以及饮用水均经过高温高压消毒灭菌处理,并定时喂少量葵花籽,鼠笼和垫料每周更换两次,各种操作均在超净工作台内按无菌操作进行。繁殖初期将雌性GRK2+/-小鼠与C57BL/6雄性小鼠按1 ∶1进行合笼,孕鼠妊娠期一般21 d左右;子鼠19~21 d可与母鼠分笼,将雌雄小鼠分开饲养;一般雄鼠8周,雌鼠6周左右大小性成熟,可用于配繁。
1.3.5小鼠体重和主要器官GRK2蛋白水平检测 待子鼠8周时,禁食过夜,称重,同时取同窝野生型及GRK2+/-小鼠脾脏、胸腺以及心脏组织匀浆提取组织蛋白,加入5×loading buffer,煮沸10 min,10%聚丙烯酰胺凝胶电泳,转膜,5%脱脂牛奶室温封闭2 h,加入GRK2一抗4 ℃孵育过夜,TPBS洗膜10 min×3次,加入对应的HRP标记的二抗,室温孵育2 h,TPBS洗膜,ECL发光液显影[7],使用LAS4000Mini型化学发光成像分析仪(美国GE公司)进行蛋白质信号检测。

2 结果
2.1 获得GRK2基因杂合敲除F0代小鼠将体外转录扩增的sgRNA与Cas9 mRNA的混合物显微注射入C57BL/6小鼠受精卵中,获得10只F0代小鼠,编号为1#-7#、8#-1、8#-2、9#,提取尾部DNA经PCR扩增后进行测序(图2A和2B),测序结果表明CRISPR/Cas9系统作用于GRK2基因的19号染色体的第三个外显子上,其中2#小鼠删除了19 bp碱基,3#、4#小鼠删除了20 bp碱基,8#-1小鼠缺失13 bp碱基,8#-2虽然缺少了1 bp碱基但却插入了16 bp碱基导致插入了15 bp碱基,9#插入了21 bp碱基。由于8-2#,9#小鼠插入的碱基个数是3的倍数,因此未能实现基因的确定突变,因此得到4只F0代GRK2+/-小鼠。

图2 F0代小鼠基因鉴定
2.2 获得GRK2基因杂合敲除F1代小鼠为构建稳定遗传的GRK2基因杂合敲除小鼠,4只F0代GRK2+/-小鼠与C57BL/6小鼠回交,共得到24只F1代小鼠,编号为16#-39#。每只子鼠的DNA均经过PCR扩增及基因测序(图3A和图3B)。发现20#、21#、23#、36#和39#小鼠基因突变点,其基因序列如图3C所示,将这些基因突变小鼠与野生型小鼠的DNA序列进行比对发现,20#、21#和23#小鼠GRK2基因缺失了13 bp碱基,36#和39#小鼠的GRK2基因缺失19 bp碱基(图3D),至此成功获得遗传稳定的13 bp和19 bp缺失GRK2+/-小鼠。
2.3 19 bp缺失的GRK2+/-小鼠扩繁由于13 bp的GRK2基因序列缺失较短,因此将其进行精子冻存保种,而将19bp缺失的F1代GRK2+/-小鼠与C57BL/6小鼠交配扩繁,通过PCR及基因测序对其进行基因型鉴定,发现F2代小鼠中46#、47#和50#均为19 bp缺失的GRK2+/-小鼠,提示成功建立了GRK2+/-小鼠,且具有良好的稳定遗传性(图4A~4C)。
2.4 GRK2+/-小鼠生长情况及组织GRK2表达与野生型小鼠相比,GRK2+/-小鼠外观及生理表现未见明显异常,但生长速度较慢,体型和体重明显小于同窝野生型小鼠(图5A和5B)。为确定GRK2基因杂合被敲除的正确性,在基因型鉴定后,应用Western blot法检测同窝GRK2+/-小鼠及野生型小鼠脾脏、胸腺、心脏、肝脏、巨噬细胞、肾脏组织中GRK2蛋白的表达水平,如图5C-5H所示,与野生型小鼠相比,GRK2+/-小鼠脾脏(t=3.471,P=0.0269)、胸腺(t=12.15,P=0.0003)、心脏(t=3.908,P=0.0174)、肝脏(t=4.297,P=0.0127)、巨噬细胞(t=2.999,P=0.0400)、肾脏(t=3.898,P=0.0176)组织中GRK2蛋白表达明显低于同窝野生型小鼠各组织。证实了GRK2+/-小鼠模型的成功建立。
3 讨论
GRK2属于丝/苏氨酸激酶家族,磷酸化GPCRs,GRK2与β-arrestin共同调控GPCRs的脱敏及内吞,为GRK2最经典的作用[8],最近研究[2]表明GRK2也可直接磷酸化微管蛋白、核糖体蛋白、钠通道及参与ERK、MAPK和NF-κB等信号通路的调控,并且通过诱导Smad磷酸化来调节转化生长因子-β(transforming growth factor-β, TGF-β)介导的细胞生长停滞和凋亡,在细胞的生长发育中起到关键作用。因此,GRK2在多种慢性疾病包括心血管疾病、神经系统疾病、自身免疫病以及肿瘤的发生和发展中起到了重要作用。

图3 F1代小鼠基因鉴定

图4 F2代小鼠基因鉴定
在心血管系统中,GRK2维持着心脏的正常结构和功能,损伤或应激可使心肌细胞GRK2表达水平上调3~4倍,引起肾上腺素受体过度脱敏或表达下降,导致心脏收缩功能发生障碍。值得注意的是,GRK2为收缩性心功能障碍发生时第一个产生变化的蛋白[9]。此外,在心肌缺血动物模型的心脏组织中也检测到GRK2的显著升高,高血压患者的外周血淋巴细胞中GRK2 mRNA水平和活性均显著增加[10]。这些研究证实了GRK2是心血管系统功能不可缺少的调节因子,逐渐成为临床上心血管疾病诊断的生物标志物和治疗靶点。GRK2也参与了神经系统疾病及自身免疫病的发病机制,如阿尔茨海默症、帕金森病、类风湿关节炎以及多发性硬化等疾病中GRK2的表达均有不同程度的改变,与病程显著相关[11-12]。对于GRK2功能的研究将有助于揭示多种慢性疾病的病理机制,探索药物作用靶点。因此,啮齿动物中GRK2的缺失为基础发育、生理和发病机制的研究提供了非常有用的动物模型。此外,该模型在确定药物靶标和开发新的临床治疗方法方面具有重要价值。1996年,Jaber et al[13]报道由于心肌发育不全,GRK2纯合子导致胚胎死亡。他们观察到GRK2-/-胚胎小鼠的心脏射血分数明显降低,并伴有严重的心力衰竭。然而Matkovich et al[14]发现,心脏特异性GRK2基因敲除小鼠(通过Cre/loxP系统获得)具有正常的心脏结构、功能和心脏基因表达,表明GRK2纯合子小鼠心脏的胚胎发育异常可能归因于心脏以外的因素。但心脏特异性GRK2基因敲除小鼠对急性和慢性异丙肾上腺素治疗更为敏感,这表明GRK2在维持心脏的儿茶酚胺反应中非常重要。尽管已有研究者通过同源重组技术构建了GRK2+/-小鼠,但这种基因编辑技术既费时又效率低下,限制了GRK2的整体研究。本研究采用CRISPR/Cas9新型基因编辑技术构建GRK2+/-小鼠,相比于传统的基因打靶技术具有操作方便,成本较低,周期短和高效率等优点[13]。

图5 GRK2+/-与野生型小鼠体重及主要组织中GRK2表达情况
根据GRK2基因序列设计出sgRNA表达载体,成功删除了GRK2基因第三个外显子上的13 bp和19 bp碱基,发生移码突变,导致GRK2遗传信息的改变,基因测序结果表明其遗传信息可稳定遗传。通过检测GRK2+/-小鼠主要器官以及重要的循环器官(如心脏)中GRK2蛋白表达水平,发现其蛋白表达量均明显降低,不同组织中GRK2蛋白丰度略有不同可能是因为在特定器官中的转录和翻译效率存在差异。GRK2+/-小鼠的行为活动均正常,但生长速度慢于同窝出生的野生型小鼠。我们将GRK2+/-小鼠与C57BL/6小鼠进行杂交,防止出现GRK2基因敲除纯合子,引起胚胎致死而对母鼠造成损伤。本研究采用PCR扩增及基因测序对子鼠进行基因型鉴定,通过一段时间的扩繁,获得了一定数量的GRK2+/-小鼠,为后续GRK2相关机制研究提供了较好的动物模型。本文详细描述的CRISPR/Cas9技术将为其他研究者构建GRK2基因敲除小鼠提供线索。

