海马和前脑皮层BDNF 和VEGF 表达与慢性应激所致小鼠抑郁的相关性
孙孟军董泽飞*王 宏
(1.邢台医学高等专科学校,河北 邢台 054000;2.华北理工大学附属医院精神科,河北唐山 063000)
抑郁症是情感性精神障碍的一种临床表现,主要表现为显著而持久的情绪低落、思维迟缓等,严重者甚至会出现自杀的念头或行为[1]。 近年来抑郁症的发病率正不断提高,但其发病机制较为复杂,尚未明确,一般认为其可能与遗传因素、神经介质及环境等有关[2]。 有研究发现,抑郁症的发生、发展与脑内神经营养因子及神经可塑性改变等因素关系密切。 神经营养因子对促进突触生长、维持神经元生存具有重要作用[3]。 据国外相关研究报道,海马与前脑皮层相关神经营养因子的表达与抑郁的发生密切相关[4]。 若海马、前脑皮层等脑区缺少神经营养因子,相应的脑功能会受到抑制,最终导致抑郁症的发生[5]。 脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)是由Zhang等[6]首先在猪脑中发现的一种具有神经营养作用的蛋白质。 有研究发现,心理学、物理学应激、长期注射皮质酮或束缚应激的大鼠海马BDNF 水平明显降低,同时大鼠出现抑郁样行为。 BDNF 水平与抑郁症严重程度关系密切[7]。 血管内皮生长因子(vascular endothelial growth factor,VEGF)是一种高度特异性的促血管内皮生长因子,能够使血管通透性增加,刺激血管再生,保护缺血及退变的神经元,促进大脑神经元的再生。 Turner 等[8]研究发现在抑郁症患者发作期,VEGF 水平明显升高。 抑郁症的发病机制较为复杂,单一理论或是单一因子治病方面已有多方面研究,但从几个方面联合研究致抑郁的较少。 本组研究采用不同的应激因子建立小鼠应激抑郁模型,从BDNF 及VEGF 两种因子的角度出发,旨在探讨海马和前脑皮层BDNF 和VEGF 表达与慢性应激所致的小鼠抑郁的相关性。
1 材料和方法
1.1 实验动物
SPF 级 KM 小鼠 58 只,2 月龄,雌雄小鼠各 29只,体重18~19 g,购自上海睿太莫斯生物科技有限公司[SCXK(沪)2016-0011],无菌手术在上海睿太莫斯生物科技有限公司屏障动物实验设施[SYXK(沪)2017-0033]进行,经本校伦理委员会审批通过(IACUC-2018-008)。 于本实验室温度(22±5)℃,湿度(57±8)%,光暗交替各12 h 的环境下饲养,自由摄食、饮水。 实验过程中坚持3R 原则。
1.2 主要试剂与仪器
0.9%氯化钠注射液(四川科伦药业股份有限公司,生产批号:20166626,规格:100 mL);VEGF 抗体(武汉默沙克生物科技有限公司);BDNF 抗体(上海赛默飞世尔科技有限公司);戊巴比妥钠(上海新亚药业有限公司,生产批号:31160240,规格:25 g)。电子秤(山东畅欧商贸有限公司, 型号: HZA50001);旷场行为检测箱(使用不透明材料制成底面为75 cm×75 cm 的正方形,将其等位成25 个等边方格,底面为白色,周围为黑色,在距箱顶50 cm 处放一60 W 灯光);秒表(深圳市鑫宏茂科技发展有限公司,型号:HS-70 W);冰箱(山东博科科学仪器有限公司,型号:BYC-250);小鼠避暗箱(上海软隆科技发展有限公司,规格:BW-YLS-17B);morris 水迷宫(江上海欣软信息科科技有限公司,型号:XRXM101-Z);石蜡切片机(上海聚慕医疗器械有限公司,型号:HM3555);恒温水浴箱(上海赫田科学仪器有限公司,型号:HH-US)。
1.3 实验方法
建立抑郁症小鼠模型:将小鼠随机分为对照组与观察组两组,观察组小鼠采用禁食(24 h 内不提供饲料,正常饮水)、禁饮(24 h 内不提供饮水,正常提供饲料)、电击足底(采用小鼠避暗箱进行操作:35 V 电压,每次 1 min,每次 6 s,共 20 次)、高台(将小鼠置于高150 cm,宽2.5 cm 的高台上60 min)、冰水游泳(使用自制的高16 cm 的水桶中,内有5℃冷水,水深14 cm,将小鼠放入其中,5 min 后取出)等多种应激因子刺激,每天随机选择一种,共20 d。对照组小鼠不接受实验应激原,以同样条件饲养。
应激前、应激后10 d、20 d 均测定小鼠体重。
Morris 水迷宫实验:将水迷宫分为四个区域,在每个区域内进行入水点标记设置,将一隐蔽的圆形平台放于第四区域。 在定向航行实验中(每天3次,共3 d),每次随机选取一个区域入水,在90 s 内找到圆形平台的时间为逃避潜伏期。 观察并记录小鼠找到并爬上平台所需时间。 第4 天时将平台撤去进行空间探索实验,从原区域入水,记录小鼠在90 s 内找到原平台区域的探索时间,若在90 s 内未找到平台,则需将小鼠引到平台。 48 h 后重复实验,观察小鼠的逃避潜伏期、游泳路程及在各象限停留时间变化。
旷场实验:于应激第20 天进行旷场实验,将小鼠放入旷场行为实验箱中,观察小鼠在10 min 内的行为表现,每只小鼠实验结束后彻底清洗实验箱,观察两组小鼠的洗脸、舔足等修饰次数、排便粒数、中央区停留时间以及垂直运动得分。
海马及前脑皮层 BDNF 及 VEGF 表达:采用Motic Images Advanced 3.3 系统对海马及前脑皮层BDNF 及VEGF 免疫组化阳性神经元结果进行分析,计算其平均光密度值。 采用免疫组化法观察慢性应激后小鼠海马及前脑皮层BDNF 及VEGF 的表达情况。
1.4 统计学方法
采用SPSS 22.0 软件包进行统计学数据分析,计量资料两组间比较采用独立样本t检验。 统计所得结果以P<0.05 为有统计学意义。
2 结果
2.1 两组小鼠体重变化比较
结果显示,两组小鼠体重均呈上升趋势,但对照组小鼠体重增加明显优于观察组。 应激前,两组小鼠体重水平相差不大(P>0.05),应激后,观察组小鼠体重明显低于对照组(P<0.01),见表1。
2.2 morris 水迷宫实验结果比较
观察组小鼠逃避潜伏期、游泳路程及在第二象限的停留时间明显高于对照组(P<0.05 或P<0.01),而两组在其他象限的停留时间无明显差异(P>0.05),见表 2。
表1 两组小鼠体重变化比较(,n=29)Table 1 Comparison of body weight changes between two groups of mice
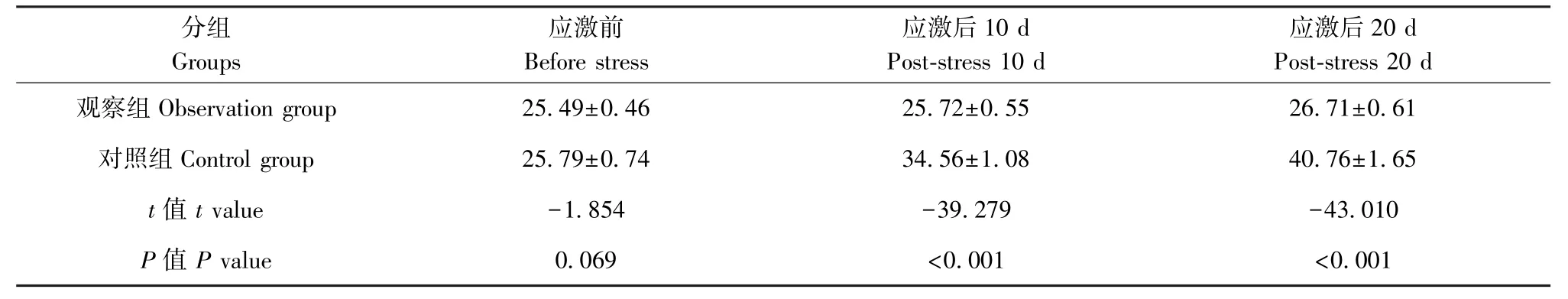
表1 两组小鼠体重变化比较(,n=29)Table 1 Comparison of body weight changes between two groups of mice
分组Groups应激前Before stress应激后10 d Post-stress 10 d应激后20 d Post-stress 20 d观察组 Observation group 25.49±0.46 25.72±0.55 26.71±0.61对照组 Control group 25.79±0.74 34.56±1.08 40.76±1.65 t 值t value -1.854 -39.279 -43.010 P 值 P value 0.069 <0.001 <0.001
表2 Morris 水迷宫实验结果比较(,n=29)Table 2 Comparison of morris water maze test results

表2 Morris 水迷宫实验结果比较(,n=29)Table 2 Comparison of morris water maze test results
Quadrant dwell time(s)训练周期1 训练周期2 训练周期1 训练周期2 第一象限 第二象限 第三象限Training cycle 1 Training cycle 2 Training cycle 1 Training cycle 2 First quadrant Beta quadrant Third quadrant观察组bservation group 59.26±5.26 35.54±2.46 824.21±217.49 692.75±119.17 24.21±1.61 34.58±1.94 31.49±1.15分组Groups逃避潜伏期(s) 游泳路程(cm) 象限停留时间Escape latency Swimming distance对照组Control group 37.14±2.67 22.36±1.59 671.52±165.42 493.16±98.82 23.75±1.17 43.93±2.75 30.58±2.17 t 值t value 20.194 24.231 3.009 6.943 1.245 -14.961 1.995 P 值P value <0.001 <0.001 0.004 <0.001 0.218 <0.001 0.051 O
2.3 旷场实验结果比较
观察组小鼠修饰次数、垂直运动得分明显低于对照组,中央区停留时间明显高于对照组(P<0.01),两组小鼠排便粒数无明显差异(P>0.05),见表3。
2.4 海马和前脑皮层BDNF 和VEGF 表达情况
与对照组相比,观察组海马CA1 区及前脑皮层BDNF、VEGF 表达水平明显降低(P<0.05),而两组CA3 区 BDNF 比较差异无统计学意义(P>0.05)。 见表4,图1。 显微镜下观察发现,对照组小鼠细胞核完整,细胞质成条状或聚集分布,观察组小鼠神经元细胞核固缩、碎裂,细胞明显变圆。 见图2,图3。
表3 旷场实验结果比较(,n=29)Table 3 Comparison of open-field experimental results
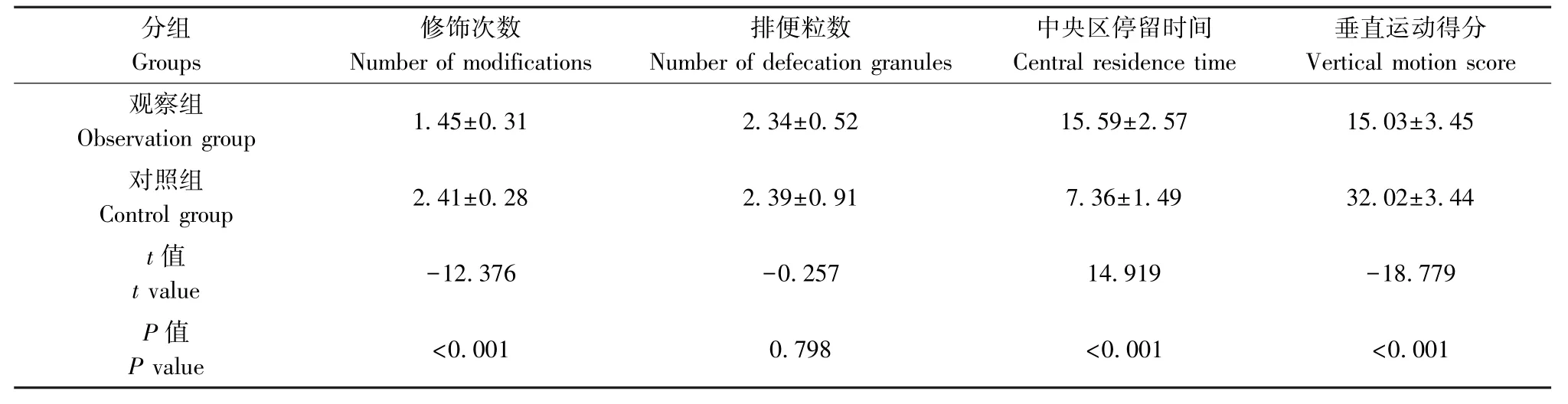
表3 旷场实验结果比较(,n=29)Table 3 Comparison of open-field experimental results
分组Groups修饰次数Number of modifications排便粒数Number of defecation granules中央区停留时间Central residence time垂直运动得分Vertical motion score观察组Observation group 1.45±0.31 2.34±0.52 15.59±2.57 15.03±3.45对照组Control group 2.41±0.28 2.39±0.91 7.36±1.49 32.02±3.44 t 值t value -12.376 -0.257 14.919 -18.779 P 值P value <0.001 0.798 <0.001 <0.001
表4 海马和前脑皮层BDNF 和VEGF 表达(,n=29)Table 4 Expression of BDNF and VEGF in hippocampus and forebrain cortex
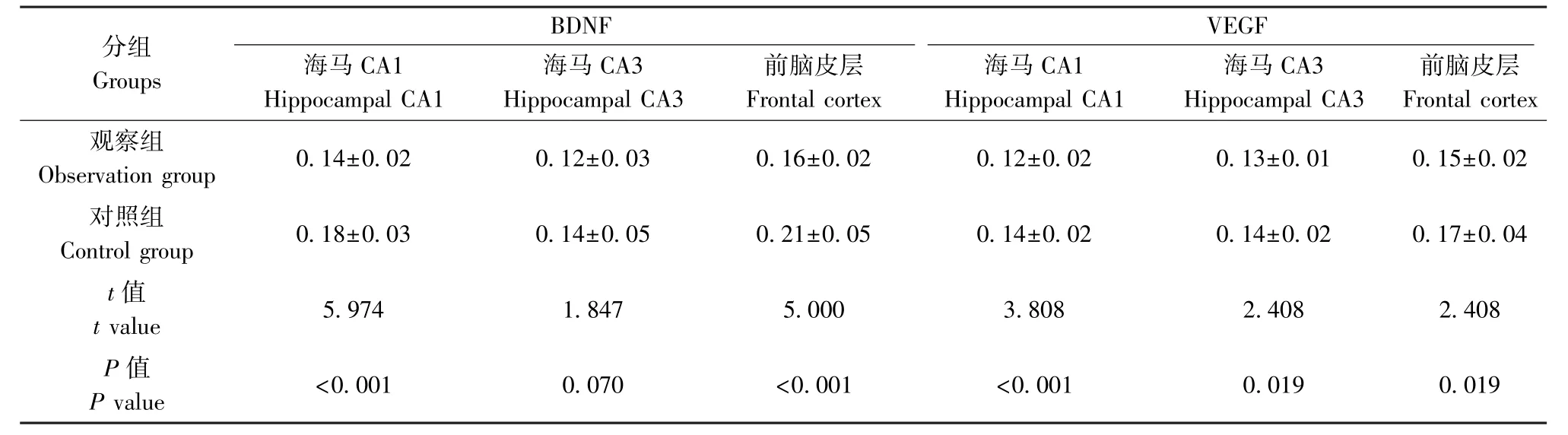
表4 海马和前脑皮层BDNF 和VEGF 表达(,n=29)Table 4 Expression of BDNF and VEGF in hippocampus and forebrain cortex
分组Groups BDNF VEGF海马CA1 Hippocampal CA1海马CA3 Hippocampal CA3前脑皮层Frontal cortex海马CA1 Hippocampal CA1海马CA3 Hippocampal CA3前脑皮层Frontal cortex观察组Observation group 0.14±0.02 0.12±0.03 0.16±0.02 0.12±0.02 0.13±0.01 0.15±0.02对照组Control group 0.18±0.03 0.14±0.05 0.21±0.05 0.14±0.02 0.14±0.02 0.17±0.04 t 值t value 5.974 1.847 5.000 3.808 2.408 2.408 P 值P value <0.001 0.070 <0.001 <0.001 0.019 0.019
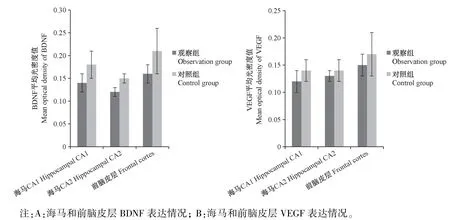
图1 海马和前脑皮层BDNF 和VEGF 表达情况Note.A, Expression of BDNF in hippocampus and forebrain cortex.B, Expression of VEGF in hippocampus and forebrain cortex.Figure 1 Expression of BDNF and VEGF in hippocampus and forebrain cortex
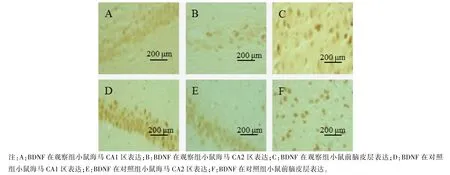
图2 BDNF 在海马和前脑皮层的表达情况Note.A, Expression of BDNF in the hippocampal CA1 region of the observation group mice.B, Expression of BDNF in the hippocampal CA2 region of the observation group mice.C,Expression of BDNF in the forebrain cortex of the observation group mice.D,Expression of BDNF in the hippocampal CA1 region of the control group mice.E, Expression of BDNF in the hippocampal CA2 region of the control group mice.F, Expression of BDNF in the forebrain.Figure 2 BDNF expression in hippocampus and forebrain cortex
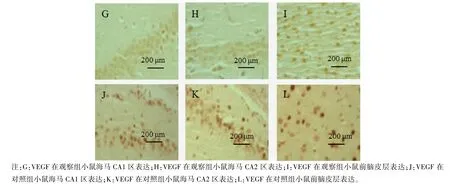
图3 VEGF 在海马和前脑皮层的表达情况Note.G, Expression of vascular endothelial growth factor in the hippocampal CA1 region of the observation group mice.H, Expression of vascular endothelial growth factor in the hippocampal CA2 region of the observation group mice.I, Expression of vascular endothelial growth factor in the forebrain cortex of the observation group mice.J,Expression of vascular endothelial growth factor in the hippocampal CA1 region of the control group mice.K, Expression of vascular endothelial growth factor in the hippocampal CA2.L, Expression of vascular endothelial growth factor in the forebrain cortex of the control group mice.Figure 3 Expression of vascular endothelial growth factor in hippocampus and forebrain cortex
3 讨论
抑郁症是一种情绪障碍性精神病,其主要特点是情绪低落、思维迟钝、语言运动减少、自责自责、得失受挫,甚至有自杀倾向,严重影响了人们的身心健康及生活质量。 随着社会的发展,社会竞争更加激烈,人们的精神压力倍增,抑郁症的发病几率大大增加,现逐渐得到人们的广泛关注。 据报道,强烈应激或长期处于应激状态会对人们的健康产生严重影响[9]。 经多项研究表明,电击足底、高台、禁食、孤独等多种应激原均可引起动物脑内神经递质、神经激素等的改变,导致动物行为及学习记忆功能的损害[10]。 本组实验以小鼠为研究对象,采用多种应激原刺激建立慢性刺激随之的小鼠抑郁模型,观察海马和前脑皮层BDNF 和VEGF 的表达情况,并分析海马和前脑皮层BDNF 和VEGF 表达与慢性应激所致小鼠抑郁的相关性。
海马中含有多种信使受体,特别是皮质类固醇、兴奋性氨基酸和血清素受体,它们是对应激最敏感的区域。 有研究发现,慢性应激会对海马结构产生严重影响,使海马结构产生器质性改变,可能与肾上腺素分泌的糖皮质激素对海马的直接作用有关[11]。 本组研究中,观察组小鼠中央区停留时间、逃避潜伏期、游泳路程及在第二象限的停留时间明显高于对照组,修饰次数、垂直运动得分明显低于对照组(P<0.05 或P<0.01)。 提示慢性应激能够导致学习记忆的损伤,降低小鼠的兴奋性、适应性以及对环境的警觉性。 这可能与慢性应激会使小鼠出现脑体积缩小,海马容量降低等脑内改变有关。 海马区是空间记忆形成和保持的部位,空间学习记忆能力可以作为反应抑郁的重要指标[12]。
近年来,神经营养因子与抑郁症的关系备受人们关注,BDNF 表达水平与抑郁症的发生关系密切。BDNF 是神经营养因子家族的一员,主要表达于中枢神经系统,包括大脑皮层、下丘脑、海马等,是脑内分布最广泛的神经营养因子[13]。 本组研究中,观察组海马CA1 区、CA3 区及前脑皮层BDNF 表达水平明显低于对照组(P<0.05),提示BDNF 可能参与了慢性应激对小鼠海马及前脑皮层的损伤。 BDNF 是一种小分子多肽物质,能够维持神经元功能、促进神经元再生、修复以及预防神经元退行性疾病,而慢性应激会明显减少海马神经元的数量,降低BDNF 表达水平。 与Sobreviela 等[14]研究结果相同。
VEGF 一种高度保守的同源二聚体糖蛋白,能够直接作用于血管内皮细胞,促进血管内皮细胞的增殖,提高血管通透性。 Glat 等[15]认为血管系统是构成海马神经元再生的重要微环境,VEGF 发生可能对抑郁症的发生具有一定影响。 本组研究结果中,观察组海马CA1 区、CA3 区及前脑皮层VEGF表达水平明显低于对照组(P<0.05)。 提示VEGF具有抗抑郁样作用,VEGF 表达下降能够导致抑郁症的发生。 这可能与慢性应激能够明显抑制血管内皮细胞增殖,抑制海马齿状回颗粒细胞层下区的神经祖细胞表达神经元和胶质细胞有关[16]。
综上所述,慢性应激会导致小鼠出现体重减轻、学习记忆损伤、环境警觉性降低等抑郁样行为,慢性应激后,小鼠海马及前脑皮层BDNF 和VEGF表达水平明显降低,其表达与慢性应激所致小鼠的抑郁具有一定相关性。

