加味宫外孕II 号方对人滋养叶细胞Caspase-12通路影响的研究
范 敏郑文兰文晓敏
(1.贵州中医药大学,贵阳 550025;2.贵州中医药大学第一附属医院,贵阳 550001)
内质网应激信号转导通路是目前研究细胞凋亡的热点之一,Caspase-12 作为特有的仅在内质网应激状态下激活的蛋白,与细胞凋亡及疾病发展变化的关系已被逐步揭示。 Caspase-7、Caspase-9 与凋亡靶因子Caspase-3 是Caspase-12 通路中的关键蛋白,研究显示内质网应激介导细胞凋亡时Caspase-7、Caspase-9、Caspase-3 呈高表达[1-2]。 本院基于“瘀”是导致异位妊娠主要病因病机的中医理论,运用加味宫外孕II 号方保守治疗异位妊娠,取得肯定临床疗效,且前期研究证实该方具有诱导细胞凋亡的作用[3],但是否可以通过内质网过度应激Caspase-12 信 号 通 路 调 控Caspase-7、 Caspase-9、Caspase-3 基因表达发挥促细胞凋亡作用尚未可知。本实验运用人绒毛膜滋养层细胞系HTR-8/SVneo代替异位妊娠滋养细胞来研究该方诱导凋亡的机制[4],为中医药保守治疗异位妊娠及药物开发利用提供实验依据。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
健康雌性SD 大鼠36 只,SPF 级,体重(200±20)g,由湖北省实验动物研究中心提供[SCXK(鄂)2015-0018]。 饲养于湖北省预防医学科学院屏障动物实验环境[SYXK(鄂)2017-0065]。 本实验通过湖北省实验动物管理与使用委员会批准(20182901),并按实验动物使用的3R 原则给予人道关怀。
1.1.2 实验细胞
HTR-8/SVneo 人绒毛膜滋养层细胞系来自于武汉华中科技大学同济医学院附属协和医院。
1.2 主要试剂与仪器
加味宫外孕II 号方(丹参、赤芍各15 g,桃仁、三棱、莪术各9 g,蜈蚣4 g,全蝎6 g,土鳖虫10 g,紫草25 g,购于贵州省中医院,熬成3 g/mL 的中药液备用);注射用甲氨蝶呤(广东岭南制药有限公司生产,国药准字H20054692);胎牛血清(美国Gibco);Caspase-9(中国武汉博士德);Caspase-7 (美国CST);Caspase-3(美国Abcam);逆转录及荧光定量试剂盒(中国南京Vazyme);引物(中国武汉擎科生物)。 QuantStudio 6 型实时荧光定量PCR 仪(美国ABI);FEI TecnaiG200 TWIN 透射电镜(美国FEI)。
1.3 实验方法
1.3.1 动物分组及处理
36 只大鼠随机分为6 组,即阴性对照组(B组)、低、中、高剂量的中药加味宫外孕II 号方组(C组、D 组、E 组)、甲氨蝶呤组(F 组)及中剂量加味宫外孕II 号方+甲氨蝶呤组(G 组)。 由人与大鼠等效剂量换算[5],计算出加味宫外孕II 号方低剂量为12 g/(kg·d),中、高剂量分别为24、48 g/(kg·d)。 B组予中药中剂量等体积生理盐水灌胃;C 组、D 组、E组分别予中药低、中、高剂量灌胃;F 组予中药中剂量等体积生理盐水灌胃,G 组予中剂量中药灌胃,两组均在取血前1 h 按7.775 mg/kg 体重肌注甲氨蝶呤;灌胃每天1 次,连续8 d。
1.3.2 含药血清的制备
第8 天末次给药1 h 后心脏采血,3000 r/min离心12 min,分离血清,0.22 μm 滤膜过滤除菌,56℃灭活30 min,将同组大鼠的血清混合、分装,存于-80℃冻存备用。
1.3.3 HTR-8/SVneo 细胞培养及处理
用含10%胎牛血清和1%青、链霉素的RPMI 1640 完全培养基接种细胞于37℃5% CO2培养箱中,细胞贴壁生长至85%左右,胰酶消化传代。 取生长状态良好的细胞接种于六孔板,培养24 h,加入对应组别含药血清,前期研究证实含药血清体积分数10%为最佳,故选用此体积分数含药血清作用于HTR-8/SVneo 细胞24 h,收集细胞进行相关指标检测。 为排除大鼠含药血清对实验结果的干扰,设置未用含药血清处理的细胞作为空白对照组,作为阴性对照组的参照。
1.3.4 Western blot 检 测Caspase-7、 Caspase-9、Caspase-3 蛋白表达水平
提取总蛋白并测定浓度,聚丙烯酰胺凝胶上样,电泳,转膜,5%脱脂奶粉封闭,一抗(Caspase-7 1 ∶1000、Caspase-9 1 ∶500、Caspase-3 1 ∶2000 稀释)4℃孵育过夜,TBST 洗膜,二抗(1 ∶5000 稀释)37℃孵育2 h,TBST 洗膜,ECL 发光液显影,胶片定影,BandScan 软件进行胶片灰度值分析。
1.3.5 Real-time PCR 检测Caspase-7、Caspase-9、Caspase-3 mRNA 表达水平
提取总RNA 并检测纯度和浓度,RNA 定量后逆转录合成cDNA,反应条件为25℃5 min,50℃15 min,85℃5 min,4℃10 min,配制20 μL 体系进行基因扩增,扩增条件为50℃2 min,95℃10 min,95℃30 s,60℃30 s,40 个循环。 以2-△△ct进行所得数据分析。 引物设计序列如下(见表1)。
1.3.6 透射电镜观察细胞超微结构变化
分别用2.5%戊二醛及1%四氧锇酸室温固定,按常规方法乙醇梯度脱水,再使用丙酮和Epon-812包埋剂等体积混合液与纯Epon-812 包埋剂渗透,制成70 nm 超薄切片,2%醋酸双氧铀-枸橼酸铅染色,透射电镜观察细胞超微结构变化。
1.4 统计学方法
GraphPad Prism 5.0 软件进行统计学分析。 数据以平均数±标准差表示,计量资料组间比较采用单因素方差分析(one-way ANOVA),以P<0.05 为差异有统计学意义。
2 结果
2.1 HTR-8/SVneo 细 胞Caspase-7、Caspase-9、Caspase-3 蛋白相对表达量
A 组与B 组比较无差异(P>0.05)。 与B 组比较,C 组Caspase-7 蛋白无差异(P>0.05),D、E、F、G组表达量上调(P<0.05);与C 组比较,E、F、G 组蛋白表达量上调(P<0.05);与D 组比较,E、G 组蛋白表达量上调(P<0.05);与F 组比较,E 组蛋白表达量上调(P<0.05);G 组与E、F 组比较无差异(P>0.05)。 与B 组比较,C、D、E、F、G 组Caspase-9 蛋白表达量上调(P<0.05);与C 组比较,D、E、F、G 组蛋白表达量上调(P<0.05);与D、F、G 组比较,E 组表达量上调(P<0.05);F 组与G 组比较无差异(P>0.05)。 与B 组比较,C、D、E、F、G 组Caspase-3 蛋白表达量上调(P<0.05);与C、D 组比较,E、F、G 组蛋白表达量上调(P<0.05);与F、G 组比较,E 组蛋白表达量上调(P<0.05);F 组与G 组比较无差异(P>0.05),(见图1、表2)。
2.2 HTR-8/SVneo 细 胞Caspase-7、Caspase-9、Caspase-3 mRNA 相对表达量
A 组与B 组比较无差异(P>0.05)。 与B 组比较,C、D、E、F、G 组Caspase-7 mRNA 表达量上调(P<0.05);与C、D 组比较,E、G 组mRNA 表达量上调(P<0.05);与F 组比较,E 组mRNA 表达量上调(P<0.05),G 组无差异(P>0.05);E 组与G 组比较无差异(P>0.05)。 与B 组比较,C 组Caspase-9 mRNA 表达无差异(P>0.05),D、E、F、G 组表达量上调(P<0.05);与C 组比较,E、F、G 组mRNA 表达量上调(P<0.05);与D、F、G 组比较,E 组mRNA 表达量上调(P<0.05);F 组与G 组比较无差异(P>0.05)。 与B 组比较,C、D、E、F、G 组Caspase-3 mRNA 表达量上调(P<0.05);与C 组比较,E、G 组mRNA 表达量上调(P<0.05);与D 组比较,E、F、G组mRNA 表达量上调(P<0.05);E、F、G 组三者比较无差异(P>0.05),(见表3)。
2.3 透射电镜观察HTR-8/SVneo 细胞超微结构的变化
A、B 组细胞包膜完整,表面有微绒毛,见清晰的核膜及核仁,均匀的染色质散布于核膜内,细胞内线粒体、内质网、高尔基体清晰可见,线粒体内外膜完整、形态良好;C、D、E、F、G 组微绒毛减少,其中C、D 组异染色质沿核膜边集,部分线粒体肿胀、脊紊乱或断裂,E、F、G 组细胞核不规则,染色质固缩,边集于核内的异染色质增多,胞浆内布满肿胀的线粒体,部分出现脊紊乱或断裂、甚至消失,线粒体空泡化;E、G 组观察到自噬体形成增多,(见图2)。

图1 HTR-8/SVneo 细胞蛋白表达量Figure 1 Protein expression of HTR-8/SVneo cells
表2 HTR-8/SVneo 细胞Caspase-7、Caspase-9、Caspase-3 蛋白表达量,n=3)Table 2 Protein expression of Caspase-7,Caspase-9 and Caspase-3 in HTR-8/SVneo cells
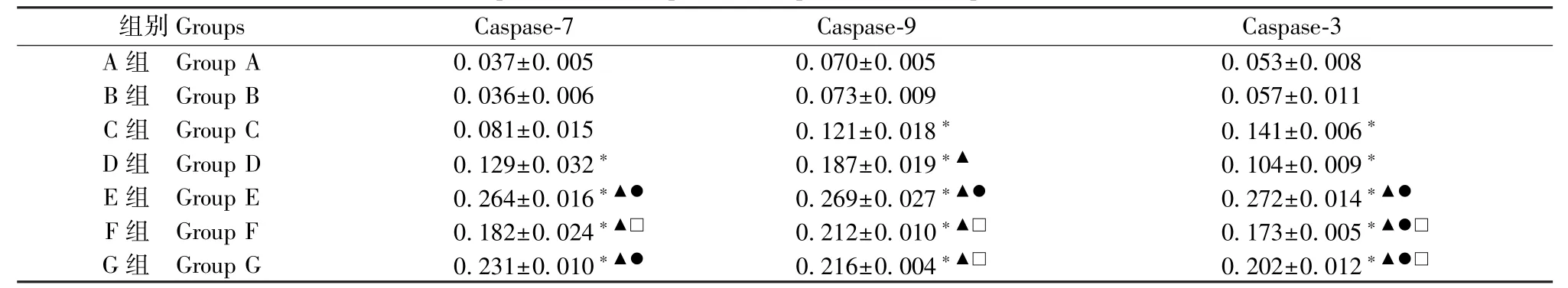
表2 HTR-8/SVneo 细胞Caspase-7、Caspase-9、Caspase-3 蛋白表达量,n=3)Table 2 Protein expression of Caspase-7,Caspase-9 and Caspase-3 in HTR-8/SVneo cells
注:与A、B 组比较,*P<0.05;与C 组比较,▲P<0.05;与D 组比较,●P<0.05;与E 组比较,□P<0.05。Note.Compared with group A and B, *P<0.05.Compared with group C, ▲P<0.05.Compared with group D, ●P<0.05.Compared with group E,□P<0.05.
组别Groups Caspase-7 Caspase-9 Caspase-3 A 组 Group A 0.037±0.005 0.070±0.005 0.053±0.008 B 组 Group B 0.036±0.006 0.073±0.009 0.057±0.011 C 组 Group C 0.081±0.015 0.121±0.018* 0.141±0.006*D 组 Group D 0.129±0.032* 0.187±0.019*▲ 0.104±0.009*E 组 Group E 0.264±0.016*▲● 0.269±0.027*▲● 0.272±0.014*▲●F 组 Group F 0.182±0.024*▲□ 0.212±0.010*▲□ 0.173±0.005*▲●□G 组 Group G 0.231±0.010*▲● 0.216±0.004*▲□ 0.202±0.012*▲●□
表3 HTR-8/SVneo 细胞Caspase-7、Caspase-9、Caspase-3 mRNA 表达量(,n=3)Table 3 Expression of Caspase-7, Caspase-9 and Caspase-3 mRNA in HTR-8/SVneo cells
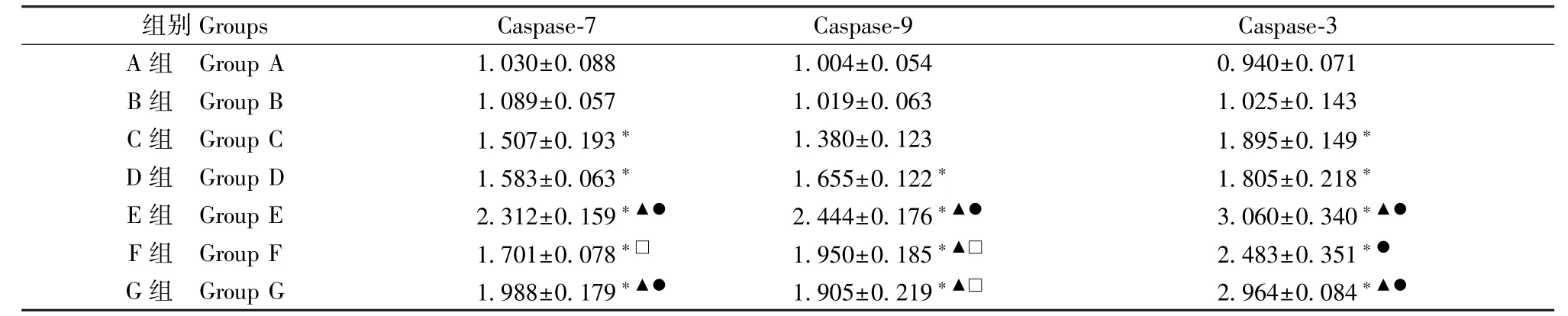
表3 HTR-8/SVneo 细胞Caspase-7、Caspase-9、Caspase-3 mRNA 表达量(,n=3)Table 3 Expression of Caspase-7, Caspase-9 and Caspase-3 mRNA in HTR-8/SVneo cells
注:与A、B 组比较,*P<0.05;与C 组比较,▲P<0.05;与D 组比较,●P<0.05;与E 组比较,□P<0.05。Note.Compared with group A and B, *P<0.05.Compared with group C, ▲P<0.05.Compared with group D, ●P<0.05.Compared with group E,□P<0.05.
组别Groups Caspase-7 Caspase-9 Caspase-3 A 组 Group A 1.030±0.088 1.004±0.054 0.940±0.071 B 组 Group B 1.089±0.057 1.019±0.063 1.025±0.143 C 组 Group C 1.507±0.193* 1.380±0.123 1.895±0.149*D 组 Group D 1.583±0.063* 1.655±0.122* 1.805±0.218*E 组 Group E 2.312±0.159*▲● 2.444±0.176*▲● 3.060±0.340*▲●F 组 Group F 1.701±0.078*□ 1.950±0.185*▲□ 2.483±0.351*●G 组 Group G 1.988±0.179*▲● 1.905±0.219*▲□ 2.964±0.084*▲●
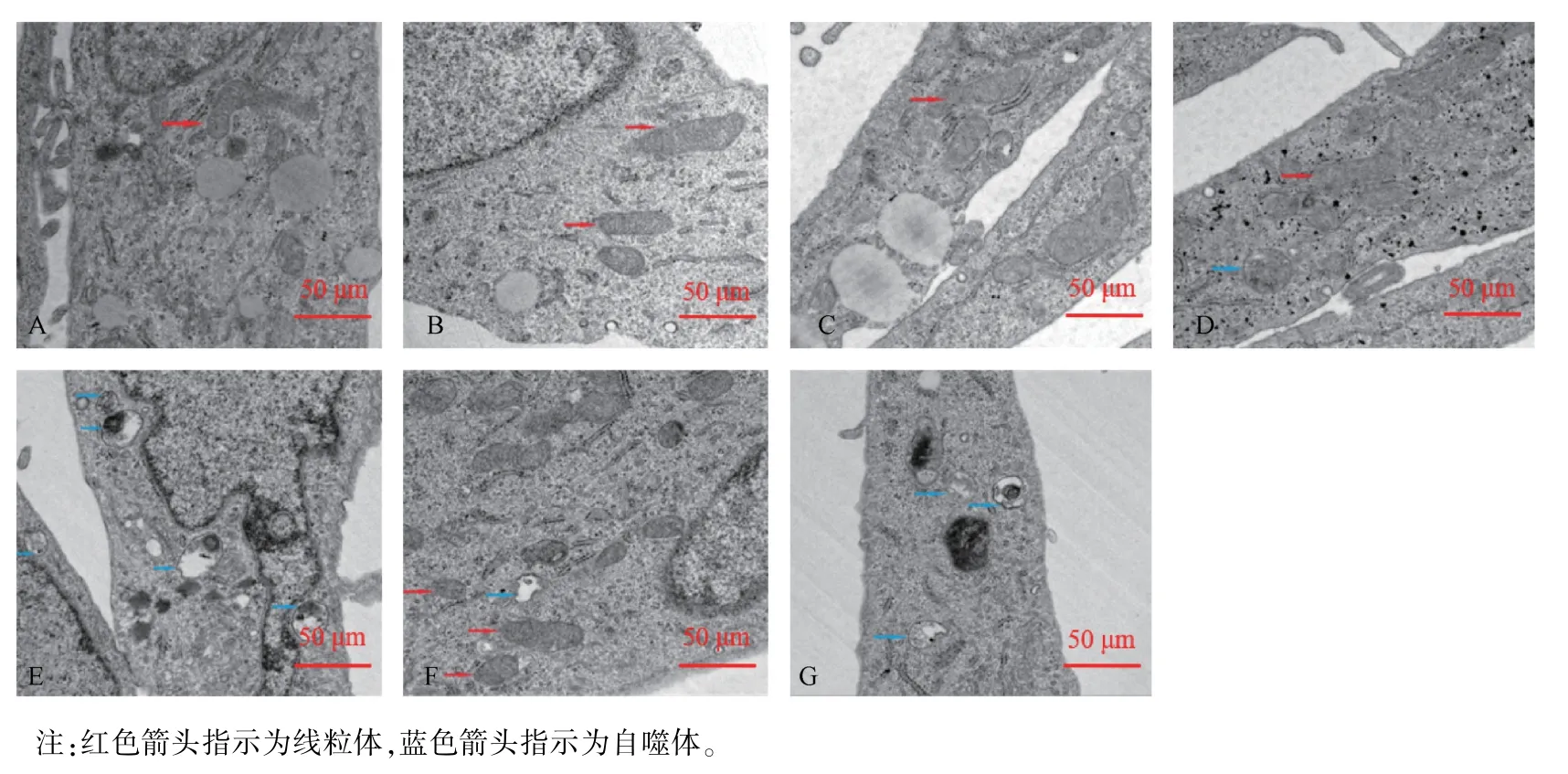
图2 HTR-8/SVneo 细胞透射电镜观察Note.Red arrow indicates mitochondria.Blue arrow indicates autophagy.Figure 2 TEM observation of HTR-8/SVneo cells
3 讨论
本实验从蛋白、基因水平测定及形态学观察,研究妊娠滋养叶细胞凋亡情况。 为排除大鼠含药血清对实验结果的干扰,设置空白对照组作为参照,确保实验结果的准确性。 细胞凋亡是指在多种条件刺激下,多基因、多通路联合调控的细胞主动有序的死亡方式[6]。 细胞凋亡的发生可清除体内有害、多余、突变或衰老的细胞,同时抑制细胞过度增殖[7],在胚胎发育、肿瘤的发生及自身免疫系统疾病中占有重要地位[8]。 现研究的细胞凋亡途径主要有死亡受体、线粒体和内质网途径[9]。 研究显示中药可以通过调控内质网应激对疾病产生影响[10]。 活血化瘀中药可通过死亡受体通路和线粒体通路促使异位妊娠胚胎死亡已有报道,而关于本院经验方加味宫外孕II 号方能否通过内质网应激介导滋养细胞凋亡尚未阐明。 研究表明内质网应激参与子痫前期、妊娠期糖尿病等妊娠相关疾病的发生发展[11-12]。 各种因素如Ca2+紊乱、氧化应激、病毒感染、营养缺乏、缺氧、药物或环境应激引起内质网功能障碍[13-14],蛋白质在腔内正确折叠受阻,出现过量的错误折叠和未折叠蛋白在内质网腔中积累的现象称为内质网应激[15-16]。 适当的内质网应激可促进蛋白质的重新折叠或抑制蛋白质的合成以减轻细胞损伤,同时清除不可逆损伤细胞恢复稳态,而过强的内质网应激超过未折叠蛋白的承受能力无法修复细胞损伤时,则引起Caspase 和相关蛋白酶的激活,引发凋亡级联放大效应[17]。
内质网过度应激时,胞质中的Caspase-7 转移到内质网表面发生蛋白水解,Caspase-7 激活Caspase-12,活化的Caspase-12 裂解Caspase-9,进而分解凋亡效应因子Caspase-3 诱发细胞凋亡[18]。 课题前期研究结果提示加味宫外孕II 号方含药血清处理的HTR-8/SVneo 细胞中仅在内质网应激时活化的Caspase-12 蛋白及基因水平呈高表达。 从以上数据分析,我们发现经中、高剂量中药、甲氨蝶呤及二者联合用药干预后的大鼠血清作用于HTR-8/SVneo细胞,Caspase-7、Caspase-9 蛋白及mRNA 表达水平与所有药物处理组的Caspase-3 蛋白及mRNA 表达量均较空白及阴性对照组增加,中药低剂量组Caspase-7 mRNA、Caspase-9 蛋白表达增加,提示中药及甲氨蝶呤能够上调Caspase-12 通路中凋亡因子的表达。 中药低剂量组Caspase-7 蛋白、Caspase-9 mRNA 表达与空白及阴性对照组比较无差异,考虑可能与此剂量下蛋白剪切激活、转录后修饰有关。经中药中、高剂量与甲氨蝶呤处理的滋养叶细胞蛋白与基因表达处于高水平,说明HTR-8/SVneo 细胞内质网发生过度应激,内质网凋亡通路被激活,通过调控Caspase-12 信号通路发挥凋亡作用。 由此推测,加味宫外孕II 号方及甲氨蝶呤促妊娠滋养叶细胞凋亡的机制之一可能是通过内质网过度应激激活 Caspase-12 通 路 诱 导 Caspase-7、 Caspase-9、Caspase-3 因子活化的凋亡途径。 其中中药高剂量组较中药低、中剂量组表达更显著,说明高剂量较低、中剂量促细胞凋亡作用增强,可达到进一步促进胚胎消亡的功效。 而中药高剂量组杀胚效果与甲氨蝶呤组、中西药结合组相近,郑文兰等[19]研究显示中药加大剂量时杀胚效果增强,且对肝的损伤较使用甲氨蝶呤小,鉴于中药具有高效杀胚且低毒副作用的特点,临床值得推广应用。
本实验还通过细胞形态学、超微结构的变化进一步观察细胞凋亡情况。 发现低、中、高剂量中药、甲氨蝶呤与中西药结合含药血清处理HTR-8/SVneo细胞,出现染色质固缩,异染色质边缘化,部分线粒体肿胀、脊紊乱或断裂、甚至消失,线粒体空泡化等凋亡特征。 电镜下未见明显凋亡小体,可能与细胞尚处于凋亡早期,未进入核碎裂阶段有关。 线粒体在细胞凋亡发生时反应较灵敏,中药高剂量组、甲氨蝶呤组与中西药结合组线粒体损伤严重,且中药高剂量组与中西药结合组可见自噬体形成增多,研究提示细胞自噬过度可启动凋亡,使细胞程序化死亡,二者存在协同关系[20]。 本研究从形态学上证实经不同剂量的中药、西药及中西药结合含药血清处理的细胞存在不同程度损伤和细胞凋亡的典型特征。 因此我们推断加味宫外孕II 号方通过损坏妊娠滋养叶细胞正常形态结构,使线粒体功能障碍,ATP 合成受阻,致妊娠组织失去营养支持而消亡。
综上,加味宫外孕II 号方可破坏滋养叶细胞的超微结构,诱导细胞凋亡,其机制可能是内质网过度应激激活Caspase-12 通路,通过上调Caspase-7、Caspase-9、Caspase-3 凋亡基因的表达促使滋养叶细胞凋亡。 本研究在细胞超微结构中发现大量自噬体形成,可能该方与自噬也存在一定关系,下一步可针对滋养叶细胞自噬机制开展研究,挖掘中医药保守治疗异位妊娠的更多理论依据。

