同型半胱氨酸经内质网应激介导小鼠心肌损伤
杜海林,张文勇,杨绍兵,贾绍斌
血清同型半胱氨酸(Hcy)是人体经食物摄入的一种含硫氨基酸,异常升高的Hcy可通过多种不同机制诱导疾病的发生[1]。在Hcy诱导疾病发生的机制中,内质网应激(ERS)是近年来备受关注的研究热点[2]。生理条件下,ERS相关蛋白胰腺内质网激酶(PERK)处于失活状态。病理状态下,PERK与未正确折叠的蛋白结合,触发未折叠蛋白反应(UPR),从而发挥细胞保护作用[3]。如损伤因素诱发的ERS持续存在,PERK磷酸化为磷酸化PERK(p-PERK),激活CCAAT增强子结合蛋白同源蛋白(CHOP)以及其下游靶点内质网氧化还原酶α(ERO1α),而活化后的CHOP和ERO1α被认为是细胞凋亡的启动因子[4]。本课题组前期研究发现[5],除动脉粥样硬化导致缺血外,Hcy亦是导致慢性心力衰竭的又一独立危险因素[6]。目前Hcy通过ERS导致动脉斑块形成的研究较多,而Hcy对心肌直接影响尚鲜见报道。为研究Hcy是否直接介导了心肌损伤,本课题组设计了此项实验,旨在探讨血清Hcy对心肌的损伤作用及其可能机制。
1 材料与方法
1.1 实验材料
本实验时间为2016年11月10日至2018年1月16日。实验小鼠(SPF级)由北京大学实验动物中心提供,并通过宁夏医科大学实验动物伦理委员会批准;动物生长维持饲料及高蛋氨酸(HM)饲料购自北京科奥协力饲料有限公司;ERS阻断剂4-苯基丁酸(4-PBA),购自Sigma公司;SDS-PAGE凝胶制备试剂盒购自康为世纪;鼠抗β-actin单抗购自中杉金桥;ER-Stress抗体试剂盒购自CST公司;Hcy测定试剂盒购自山东博迈达生物科技有限公司;全蛋白提取试剂盒及BCA蛋白含量检测试剂盒均购自凯基生物。
1.2 动物模型的建立
健康5周龄ApoE基因敲除实验小鼠27只,均于实验动物中心SPF环境下饲养,随机分为对照组、HM组及4-PBA组,每组各9只。对照组给予小鼠生长维持饲料喂养,HM组及4-PBA组给予HM饲料喂养。Hcy是蛋氨酸代谢的中间产物,给予高蛋氨酸饮料喂养用于构建小鼠高Hcy血症模型。所有实验小鼠喂养16周后,4-PBA组给予腹腔内注射ERS阻断剂4-PBA[7],剂量为5 mg/kg,每周两次,共12周,其余两组小鼠均按原饲养方法继续喂养12周。所有小鼠共完成28周干预后处死,快速眼球取血用于后续实验,心脏经多聚甲醛灌注后剥离,留取标本分别固定及冻存,其中固定标本浸泡于4%多聚甲醛,冻存标本经液氮速冻后保存于-80℃冰箱。
1.3 血清Hcy测定
所有小鼠全血经4 000 g离心10 min后取上层血清,使用Hcy测定试剂盒检测血清Hcy浓度,首先用试剂盒内标准样品制作标准曲线,曲线R2=0.997,再将每个样本检测三次,取三次结果的平均值作为该小鼠血清Hcy浓度,分组记录。
1.4 电镜观察心肌细胞器
剥离小鼠心脏后采集心肌组织,在4℃环境下行前固定、后固定、脱水、分组包埋,分别取心肌细胞横轴及纵轴切片,电镜下3 000倍观察细胞器。
1.5 心肌组织苏木素-伊红(HE)染色及免疫组化
所有固定心肌组织经脱水后行石蜡包埋及切片,常规脱蜡、脱水,HE染色观察各组小鼠心肌大体结构及细胞结构。免疫组化切片继续行高压修复,山羊血清封闭,加ERO1α单克隆抗体于4℃冰箱过夜,次日按辣根过氧化物本酶(DAB)显色试剂盒操作,并行HE染色,封片,正置显微镜下观察染色效果,采集图像。
1.6 心肌组织蛋白免疫印迹(Western blot)
称取冻存心肌组织50 mg,使用全蛋白提取试剂盒,按试剂盒操作说明完成蛋白提取,BCA蛋白含量检测试剂盒检测蛋白含量,取60 µg蛋白样品,以10%SDS-PAGE凝胶电泳后转移至聚偏二氟乙烯(PVDF)膜,室温下脱脂牛奶封闭 90 min,加入一 抗PERK(兔 源1 :1 000)、CHOP(鼠源1 :1 000)、ERO1α(兔源1 :1 000)、β-actin(鼠源1 :2 000)于4℃孵育过夜,次日洗膜后加入相应的辣根过氧化物酶标记的二抗,室温孵育 1 h,ClinxChemiScope6300自动曝光,并使用设备配套软件分析条带灰度值,以β-肌动蛋白(β-actin)作为内参。
1.7 统计学方法
本研究所有数据均采用SPSS 21.0 数据统计包分析。连续变量采用±s表示,两组间比较采用t检验;多组之间比较使用方差分析;所有统计均采用双侧检验,当P≤0.05时认为差异具有统计学意义。
2 结果
2.1 血清Hcy测定评估模型建立
与对照组比较,HM组及4-PBA组血清Hcy水平增高,差异均有统计学意义(P均<0.05);与HM组比较,4-PBA组血清Hcy水平差异无统计学意义(P>0.05),如图1所示。

图1 三组小鼠血清Hcy水平比较(n=9)
2.2 心肌组织结构及细胞器的形态学观察
通过光镜观察HE染色的心肌切片,分别在100倍及200倍镜下观察。三组心肌细胞HE染色良好,心壁无明显增厚及变薄,心肌细胞形态正常,胞质均匀,无病理性核分裂相,光镜下各组心肌组织未见明显差异(图2A)。电镜下观察所见,胞核细胞器形态正常,HM组内质网肿胀,结构紊乱,在多个切面可见内质网腔扩张,4-PBA组内质网肿胀及扩张明显减轻,偶有视野可见上述改变(图2B)。
2.3 ERO1α的免疫组化结果
光镜下观察免疫组化效果,由于ERO1α表达于胞浆,先于低倍镜下观察大体表达差异,再计数高倍镜下每视野胞浆着色细胞与该视野细胞总数之比,作为ERO1α表达的定量指标。每组计数五个视野,分别计算每个视野阳性细胞百分数,将五个视野的平均百分数作统计学分析,如图3所示,与对照组比较,HM组及4-PBA组胞浆中ERO1α表达增加,差异均有显著性统计学意义(P均<0.01);与HM组比较,4-PBA组胞浆ERO1α表达减少,差异有显著性统计学意义(P<0.01)。

图2 苏木素-伊红染色光镜观察心肌组织结构及电镜下观察内质网结构

图3 免疫组化法显示ERO1α在不同组间表达
2.4 Western blot检测PERK、CHOP、ERO1α在心肌组织中表达(图4)
PERK、CHOP、ERO1α等内质网应激相关蛋白在对照组心肌细胞有少量表达,与对照组比较,HM组PERK、CHOP、ERO1α表达均明显增高,差异均有统计学意义(P均<0.01);与对照组比较,4-PBA组PERK、ERO1α表达增高,差异有统计学意义(P均<0.01),CHOP表达差异无统计学意义(P>0.05)。与HM组比较,4-PBA组PERK、CHOP、ERO1α表达减少,差异均有统计学意义(P均<0.05)。
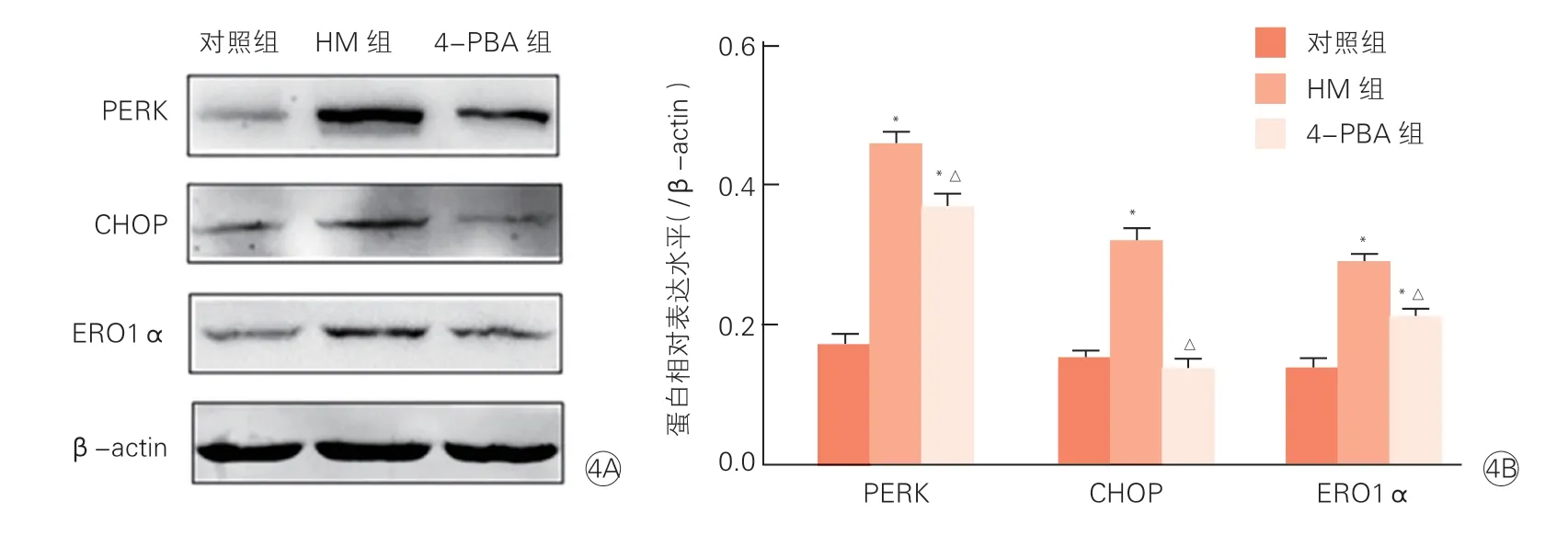
图4 蛋白免疫印迹法显示PERK、CHOP、ERO1α在各组中表达
3 讨论
人体经食物摄入的蛋氨酸经过代谢产生具有毒性作用的中间产物--Hcy,目前各领域相关研究证实其毒性作用表现为致全身多系统疾病,包括2型糖尿病、恶性肿瘤、肾脏疾病及动脉粥样硬化等[8-9],本课题组研究第一次从病理角度观察到Hcy对心肌的直接损伤,在心肌大体组织结构并无明显改变时,Hcy已通过超微结构变化,影响心肌细胞功能。
心血管疾病与肿瘤是近年WHO公布的主要疾病谱,心血管疾病危险因素包括吸烟、高血压、高脂血症、糖尿病等,近年将缺乏运动及血清高Hcy(≥10 µml/L)列为心血管疾病的危险因素[10]。关于Hcy与心血管疾病相关性,目前较为明确的有:(1)Hcy通过影响烷类物质及嘌呤的代谢,导致超氧化阴粒子堆积,诱发氧化应激[11];(2)高血清Hcy导致氧化低密度脂蛋(ox-LDL)异常表达[12],诱导血管中层平滑肌细胞增殖加速动脉粥样硬化(AS)[13];(3)诱导生长抑制因子和DNA损伤诱导因子(GADD34)以及T细胞死亡基因51(TDAG51)表达,诱发ERS[14]。本课题组实验结果显示,给予小鼠28周高蛋氨酸饲料喂养,血清Hcy水平增高,由于4-PBA作用于Hcy所致ERS的下游[15],并未导致HM组与PBA组小鼠Hcy水平的差异,成功构建高Hcy模型。与对照组比较,HM组心肌细胞ERS相关因子PERK、CHOP、ERO1α表达均有增高,尽管光镜下组织大体形态结构没有明显变化,但细胞超微结构已存在改变,给予4-PBA阻断ERS后以上因子表达下降、内质网肿胀亦有所改善,提示血清Hcy水平增高触发ERS,而阻断ERS通路后,CHOP、ERO1α等因子表达下降,细胞超微结构的变化亦有所改善。细胞中表达增高的CHOP及ERO1α的被认为是病理性ERS的触发因子[14],由此证实长时间血清高Hcy水平损伤心肌细胞,其机制可能为高Hcy激活ERS所致,当过度的损伤超过了UPR的代偿能力,细胞内环境的稳定将无法维持,此时ERS会激活线粒体凋亡通路,诱导损伤细胞凋亡[16],心肌细胞凋亡后会继续发生心肌重构,最终导致慢性心力衰竭的发生[5]。
目前对高Hcy的防治主要策略是在食物或药物中加用叶酸及维生素B12加速其代谢[17],这类治疗策略的显著特点是以降低血清Hcy水平为目的。近来一些临床相关的Meta分析显示,补充叶酸治疗可以降低脑血管事件,但并不能降低心血管事件的风险[18]。因此需要探索新的手段对临床高Hcy进行干预。4-PBA作为一种小分子脂肪酸,起初应用于镰状细胞贫血和地中海贫血的临床治疗,近年研究证实其为一种分子伴侣,可逆转未折叠蛋白和错误折叠蛋白而减轻ERS,在本实验中,我们对同样为血清高浓度Hcy的4-PBA组小鼠给予4-PBA干预,目的是通过阻断ERS通路后,检测ERS相关因子的表达,结果显示其ERS相关因子CHOP、ERO1α表达确有下降,电镜下内质网结构也确有改善,再次证实高Hcy血症触发了ERS而介导的心肌损伤。其机制可能是4-PBA作为分子伴侣,协助信号分子指导蛋白折叠,减轻ERS负担,从而抑制 CHOP以及其下激分子ERO1-α转录和翻译,减轻心肌细胞凋亡,发挥心肌保护作用[19]。4-PBA干预后出现细胞超微结构及分子水平的改变进一步佐证Hcy通过ERS介导心肌损伤,并提示阻断ERS可能为干预Hcy所致心脏病的一个新靶点[20]。
此外我们的研究仍然存在不足之处,如未设计正常饲料喂养组并经4-PBA组,无法说明4-PBA对心肌单独效应;未进一步探讨CHOP及ERO1α经过何种改变导致表达增加,如是否和基因的乙酰化和甲基化过程相关等,以上不足。我们将会在后续的细胞实验中加以完善。
利益冲突:所有作者均声明不存在利益冲突

