发酵支原体MALP-2生物学作用研究进展
梁珂莹,刘 君,#,曾焱华,何 军*
(1.南华大学附属南华医院检验科,湖南 衡阳 421002;2.南华大学衡阳医学院病原生物学研究所,特殊病原体防控湖南省重点实验室,湖南 衡阳 421001)
发酵支原体(Mycoplasma fermentans,Mf)是一类缺乏细胞壁的原核细胞型微生物,具有可塑多形性。Mf常寄居于健康人群及先天免疫缺陷患者的黏膜部位,能引起呼吸道疾病、关节炎、泌尿生殖道感染及慢性疲劳综合症等疾病,并与人类免疫缺陷病毒(Human immunodeficiency virus,HIV)感染发展存在一定的相关性。Mf的膜脂蛋白被认为是其主要的免疫原,可直接参与和宿主的相互作用,成为Mf主要致病因素之一。在这些致病相关膜结构分子中,巨噬细胞活化脂肽-2(Macrophage-activating lipopeptide-2,MALP-2)能够活化巨噬细胞,且常作为支原体膜脂蛋白的代表分子得到广泛研究,本文就MALP-2的生物学作用的最新研究进展作一综述。
1 MALP-2的分子结构特点
与其它支原体一样,Mf的细胞膜主要由脂质双分子层和膜蛋白组成,膜蛋白又包括膜本体蛋白和外周膜蛋白。前者紧密镶嵌于细胞膜中,需要用去污剂才能分离;后者又被称为膜脂蛋白,靠静电作用与膜连接,容易释放。MALP-2与很多支原体脂蛋白的结构相似,其N端有一个二酰甘油-半胱氨酸结构,通过二酰甘油的两条脂肪酸链锚定于细胞膜上,并且可通过人工合成获得,避免了直接提取脂蛋白被内毒素污染的风险[1-2]。绝大多数细菌脂蛋白(Bacterial lipoproteins,BLP)N端为三酰化半胱氨酸残基,而MALP-2的N端为二酰化半胱氨酸残基,这可能是导致两者致病机制不同的主要原因之一[3]。MALP-2与模拟合成的二酰脂肽Pam2CSK4具有相同的脂质部分,但其多肽部分不同,从而导致对自然杀伤细胞(Natural killer cell,NK细胞)活化作用存在差异[4]。MALP-2、BLP与Pam2CSK4的分子结构比较见图1。由此推测,MALP-2与其它物质在分子结构上的差异决定了其作用位点及作用方式的特异性。
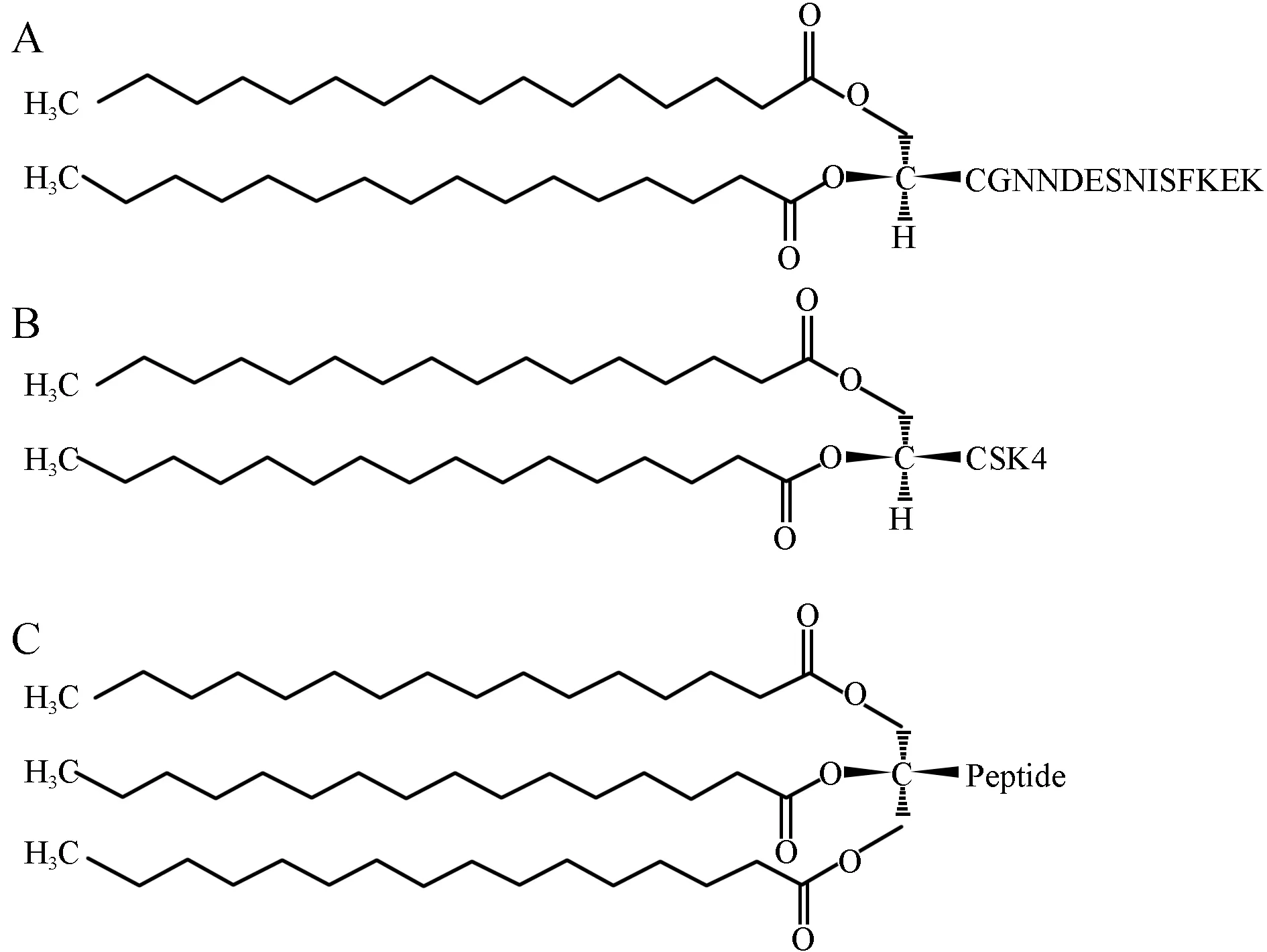
图1 MALP-2、BLP与Pam2CSK4的分子结构图A:MALP-2分子结构图;B:Pam2CSK4分子结构图;C:BLP分子结构图
2 MALP-2的生物学作用
MALP-2作为脂质相关膜蛋白(Lipid associated membrane proteins,LAMPs)的代表被广泛应用到研究中,具有非常重要的生物活性作用。支原体的脂质相关膜蛋白作为其致病的主要毒力因子,常与单核/巨噬细胞表面的Toll样受体(Toll-like receptors,TLR)结合,激活丝裂原蛋白激酶(Mitogen-activated protein kinase,MAPK)以及核转录因子κB(Nuclear factor kappa B,NF-κB)和激活子蛋白-1(Activator protein 1,AP-1),诱导细胞产生各种炎症细胞因子,如白细胞介素1(Interleukin 1,IL-1)、白细胞介素6(Interleukin 6,IL-6)、肿瘤坏死因子(Tumor necrosis factor,TNF)等[5]。TLR6协同TLR2识别并结合MALP-2,介导细胞内信号通路,发挥其生物活性作用,二者在特定细胞表面的表达决定了MALP-2作用细胞的类型。但MALP-2的作用并不局限于表达TLR2及TLR6的细胞,提示MALP-2并不只依赖TLR2/6途径发挥其生物活性作用,可能还存在其它介导途径。MALP-2的生物学作用是多方面的,本文从以下几个方面进行阐述。
2.1 致炎与抗炎作用
MALP-2结合TLR2/6激活NF-κB通路可诱导羊膜间充质细胞分泌IL-6、白细胞介素8(Interleukin 8,IL-8)和粒细胞-巨噬细胞集落刺激因子(Granulocyte-macrophage colony stimulating factor,GM-CSF)引起强烈的炎症反应,导致胎膜早破[6]。有文献报道,MALP-2不仅诱导激活脐带的间充质干细胞中IL-1β、白细胞介素4(Interleukin 4,IL-4)、IL-6、TNF-α及趋化因子配体CCL1、CCL4等细胞因子的表达,也诱导中性粒细胞趋化因子IL-8及生长调节致癌基因GRO-α与单核细胞趋化因子MCP-1、MIP-1α及MIP-1β的产生,促进白细胞浸润[7]。除此之外,MALP-2可诱导大量中性粒细胞及巨噬细胞在小鼠肺组织浸润,并能显著诱导肺血管中血管细胞粘附分子-1的表达[8]。MALP-2能诱导细胞因子、一氧化氮产生及使抗原呈递细胞成熟[9],也可上调树突状细胞(Dendritic cells,DC)表面簇分化抗原CD40、CD54、CD80、CD83、CD86、人类白细胞抗原HLA-ABC及主要组织相容性复合体MHCⅡ的表达,诱导DC成熟,使其发挥抗原呈递等作用[10-11]。Mitsunari M等[12]人发现,MALP-2经NF-κB及MAPK通路介导人胎盘滋养层细胞以浓度依赖的方式诱导产生环氧合酶-2(cyclooxygenase-2,COX-2)及其代谢产物前列腺素E2(Prostaglandin E2,PGE2)。此外,MALP-2经TLR2/6及NF-κB通路诱导小鼠巨噬细胞表达诱导性一氧化氮合酶(inducible nitric oxide synthase,iNOS)[13]。MALP-2还可诱导内皮细胞NADPH氧化酶NOX2及其产物活性氧ROS的生成,上调GM-CSF的释放[14]。以上研究表明,MALP-2通过激活细胞因子、趋化因子、炎症相关酶及其代谢产物等多种炎症相关因子从而发挥致炎作用。
有趣的是,MALP-2能减低过敏性哮喘小鼠的炎症反应,显著刺激小鼠肥大细胞分泌生物调节因子白细胞介素10(Interleukin 10,IL-10)[15]。MALP-2经MAPK及Nrf2通路诱导人单核细胞血红素加氧酶1(Heme oxygenase 1,HO-1)的表达,进而下调COX-2表达,以及经TLR2/6、Btk、Mal及c-Src通路激活PI3K,进而激活Nrf2,诱导HO-1的产生,从而发挥其抗炎作用[16-17]。由此可见,MALP-2除了激发炎症反应,还可下调炎症反应,尽管调控的炎症因子不尽相同,但对机体也具有类似双重调控作用。
2.2 细胞凋亡与抗凋亡作用
Into T等[18]发现,MALP-2经TLR2/6与NF-κB通路诱导细胞凋亡,其NF-κB通路由MyD88/FADD部分介导,而细胞凋亡受p38 MAPK与MyD88/FADD调节。有文献报道称,MALP-2抑制线粒体膜电位的降低,下调活化的Caspase-8,从而抑制TNF-α介导的细胞凋亡[19]。另外,MALP-2也对中性粒细胞的细胞凋亡发挥短效的抑制作用[20]。因此,MALP-2除了诱导细胞凋亡外,亦可对细胞凋亡进行负向调控,这可能随MALP-2诱导浓度,宿主类型及诱导途径的不同而不同,也有待于进一步证实。
2.3 免疫佐剂作用
MALP-2衍生物可以在结核分枝杆菌感染者中诱导DC分泌促炎细胞因子和趋化因子,增强机体对T细胞和B细胞的处理和抗原呈递能力,增强抗原的记忆适应性免疫同时还可以抑制小鼠巨噬细胞内肺结核分枝杆菌的存活,是黏膜和系统性疫苗制剂中极具前途的候选佐剂[21]。MALP-2还可与HIV Tat蛋白、麻疹病毒及化脓性链球菌相关成分组成联合疫苗可增强疫苗效果[22-24]。在COX-2阻滞剂抑制PGE2产生的情况下,MALP-2诱导单核细胞产生干扰素γ诱导蛋白IP-10,进而显著增强NK细胞的细胞毒性,有望成为肿瘤治疗的免疫佐剂[25]。MALP-2应用于肺部肿瘤的免疫治疗时,可通过调节淋巴细胞免疫功能抑制肿瘤以降低癌细胞转移的风险[26]。在小鼠感染流感病毒后的肺炎链球菌二重感染模型中,MALP-2的局部免疫刺激能够增强肺组织的细菌清除能力并提高其生存率[27]。以上证据表明,MALP-2有希望成为一种理想的免疫佐剂。
2.4 生物协同作用
研究发现,MALP-2可上调TNF-α诱导的人肺纤维母细胞IL-6、CXCL1及CXCL8等免疫调节因子的表达[28]。MALP-2促进干扰素-γ上调黑色素瘤细胞趋化因子CXCL10的表达[29]。纤维蛋白能上调MALP-2介导的单核细胞产生细胞因子IL-6、TNF-α与趋化因子MIP-1α、MCP-1[30]。硫酸镍与MALP-2显著上调人肺纤维母细胞趋化因子CXCL8、COX-2及其代谢产物PGE2的表达,并抑制MALP-2介导的趋化因子CXCL10表达[31]。镍与MALP-2经低氧诱导因子-1(hypoxia inducible factor-1,HIF-1)及COX-2通路协同上调人肺纤维母细胞趋化因子CXCL1、CXCL5及血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达,促进其血管生成及纤维化[32]。CD47与MALP-2经MyDD信号通路协同调节中性粒细胞迁移[33]。可见,MALP-2可与多种物质发生生物协同作用,从而进一步提高生物活性作用。
2.5 生物抑制作用
研究发现,经过MALP-2预处理的小鼠巨噬细胞通过影响TLR-MyD88依赖信号通路,使脂多糖(Lipopolysaccharide,LPS)反应中产生TNF-α减少并且损害LPS诱导的NF-κB和c-Jun NH2末端激酶的激活,造成小鼠巨噬细胞对LPS的耐受,反之亦然[34]。有趣的是,其它物质对MALP-2还具有抑制作用。阿托伐他汀明显抑制MALP-2介导的冠状动脉内皮细胞活化,其机制涉及酪蛋白激酶2及SP1的磷酸化[35]。岗松及其有效成分经MyD88及NF-κB通路抑制由MALP-2刺激小鼠单核巨噬细胞白血病细胞RAW264.7产生的细胞炎症反应及iNOS的表达[36]。补骨脂乙素能抑制MALP-2介导的小鼠巨噬细胞iNOS表达[37],也能抑制MALP-2介导的大脑内皮细胞间黏附分子-1(intercellular cell adhesion molecule-1,ICAM-1)的表达[38]。卷曲乳杆菌2029抑制MALP-2介导的宫颈上皮细胞IL-8表达[39]。1,6-二磷酸果糖抑制MALP-2介导的脑血管内皮细胞ICAM-1的表达[40]。从以上抑制和被抑制作用来看,MALP-2可能存在能与多种物质发生反应的多个位点以及如何抑制其生物活性是一个值得探索的方向。
2.6 血管损伤和血管修复作用
已证实肺炎支原体感染与动脉粥样硬化存在一定的关系。Curtiss LK[41]报道称,MALP-2经TLR2/6受体使血浆促炎细胞因子IL-12、IL-23 p40的水平升高,诱导了小鼠的全身炎症反应,使其表现出更高的血浆胆固醇水平,最终导致心脏瓣膜病变。同时,MALP-2还经TLR2/6、NF-κB及ZNF202通路下调人巨噬细胞ATP结合盒转运体A1的表达,进而抑制胆固醇外流,导致动脉粥样硬化的形成[42]。这些结果进一步证实支原体能影响动脉粥样硬化的发生发展。
然而有文献报道,MALP-2经TLR2/6介导白细胞迁移以及GM-CSF和VEGF分泌,显著促进内皮细胞的增殖、迁移及导管形成,进而加速血管生成[43-44]。不仅如此,MALP-2增强了内皮细胞NO的释放,改善了NO依赖性的血管舒张、内皮粘附分子表达以及单核细胞粘附,而巨噬细胞的积累和内皮细胞增殖增加了侧支管直径,促进侧支生长,在功能上改善了缺血小鼠后肢的灌注恢复。MALP-2促进血管生成大多依赖于生长因子GM-CSF的诱导,这有望成为血管修复的一种新的促进剂[45]。
3 总结与展望
MALP-2通过结合TLR2/6激活NF-κB、MAPK等通路,激发或下调炎症因子的分泌以达到对炎症反应的双重调控;不仅如此,MALP-2通过由p38 MAPK和MyD88/FADD介导的NF-κB通路来调节细胞凋亡,又可以抑制线粒体膜电位的降低,来抑制TNF-α介导的细胞凋亡,对细胞的凋亡也具有双重调控作用;同时,MALP-2既可以诱导小鼠的全身炎症反应,使其表现出更高的血浆胆固醇水平,造成对血管损伤,又可以促进内皮细胞的增殖、迁移及导管形成,进而加速血管生成,这也体现出MALP-2对血管作用的双面性。MALP-2还可以通过诱导一些细胞分泌促炎细胞因子和趋化因子,增强机体的免疫能力,有望成为肿瘤治疗以及黏膜和系统性疫苗制剂中的免疫佐剂。MALP-2表现可与硫酸镍、阿托伐他汀、补骨脂乙素等多种物质相互作用,从而进一步提高或抑制生物活性作用。MALP-2除了具有以上各种生物学作用外,还可经TLR2、TAK1及NF-κB通路上调神经元细胞钙蛋白酶抑素的表达。此外,Tschernig T等[46]发现MALP-2能够调节肺组织微囊蛋白1及足细胞标记蛋白的表达,对更深入地研究肺部炎症反应机制很有帮助。尽管以上诸多研究存在局限性甚至对立面,但这些研究为课题组成员更好地理解MALP-2的致病性及支原体的致病机制提供了更多的途径和研究方向。对MALP-2的深入了解将为支原体的致病机制研究及MALP-2的临床应用翻开新的篇章。

