成人型卵巢颗粒细胞瘤1例并文献复习
周 艳,龙 丹,刘伏香,梁珂莹,何 军*
(1.南华大学附属南华医院检验科,湖南 衡阳 421002;2.中国人民解放军联勤保障部队第九二二医院妇产科,湖南 衡阳 421002)
1 病例资料
患者,女性,58岁,因“绝经3年,不规则阴道流血3次,发现附件囊肿8月”于2020年2月26日入院治疗。患者55岁绝经,2019年5月无明显诱因出现阴道不规则流血,量少,无腹痛、腹胀等不适,因阴道流血1+月未干净到当地医院住院治疗,阴道彩超提示:子宫内膜厚20 mm;左附件囊性包块(58 mm×52 mm),行宫腔镜检查+诊断性刮宫;病理回报:子宫内膜息肉,建议患者手术治疗左附件包块,患者拒绝手术而出院。2019年10月患者再次出现阴道流血,口服葆宫止血颗粒、妇炎消胶囊治疗,3天后阴道流血干净。2020年2月15日患者再次出现阴道流血,量少,点滴样,继续口服葆宫止血颗粒、妇炎消胶囊治疗,效果欠佳,1周后阴道流血增多,遂到当地医院就诊,复查阴道彩超示:左附件囊性包块(68 mm×60 mm),即到本院就诊,入院后行阴道彩超检查(图1)提示:子宫内膜不匀质增厚(12 mm);盆腔混合性包块(64 mm×50 mm);子宫壁低回声结节。盆腔磁共振检查(图2)提示:左侧附件区囊实性占位,考虑浆液性囊腺瘤(交界性);子宫内膜稍增厚;子宫平滑肌瘤。CA125,CA199,AFP,CEA均正常,血β-HCG正常。入院后予行诊断性刮宫。病理回报:子宫内膜单纯性增生。术前诊断:盆腔包块性质待查。完善术前准备后在全身麻醉下行剖腹探查术,术中见:盆腹腔无游离液体,左侧卵巢可见一约7 cm×6 cm大小囊性包块,包膜完整,表面光滑,形态欠规则,与周围组织无粘连;双侧输卵管结扎近端增粗、积液,右侧卵巢外观未见明显异常;子宫偏大,前壁扪及一约1.5 cm×1.0 cm肌瘤样结节。术中切除左侧附件后送快速冰冻病理检查,结果回报:(左卵巢)性索-间质肿瘤,考虑卵巢颗粒细胞瘤。下一步行全子宫+右侧附件切除,送检组织(图3)见增生的纤维性间质分割瘤细胞呈巢状、岛状、梁状、滤泡样结构及Call-Exner小体,瘤细胞小而均匀,胞质稀少,细胞核呈圆形或卵圆形,可见纵形核沟,核分裂像1-2/HPF,周边可见少量黄素化卵泡膜细胞。免疫组化:Inhibin-α(+),CK(+),CR(+),WT-1(+),Vimentin(+),Ki-67(3%+),CD99(-),CK7(-),EMA(-),SMA(-)。病理诊断:(左)卵巢颗粒细胞瘤。出院诊断:成人型卵巢颗粒细胞瘤IA期。
本例患者绝经后出现阴道流血,B超发现子宫内膜增厚合并有附件包块,行诊断性刮宫排除了子宫内膜癌,临床医师术前对卵巢颗粒细胞瘤(granulosa cell tumor,GCT)的认识不够,对盆腔包块的鉴别诊断考虑不全面,而遗漏性激素检查项目,并且B超和盆腔磁共振术前诊断也存在遗漏。
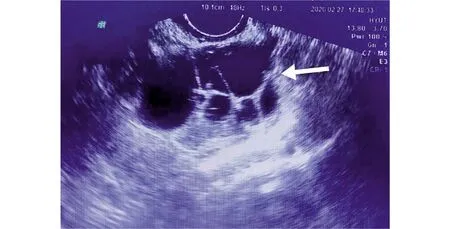
图1 术前彩超图
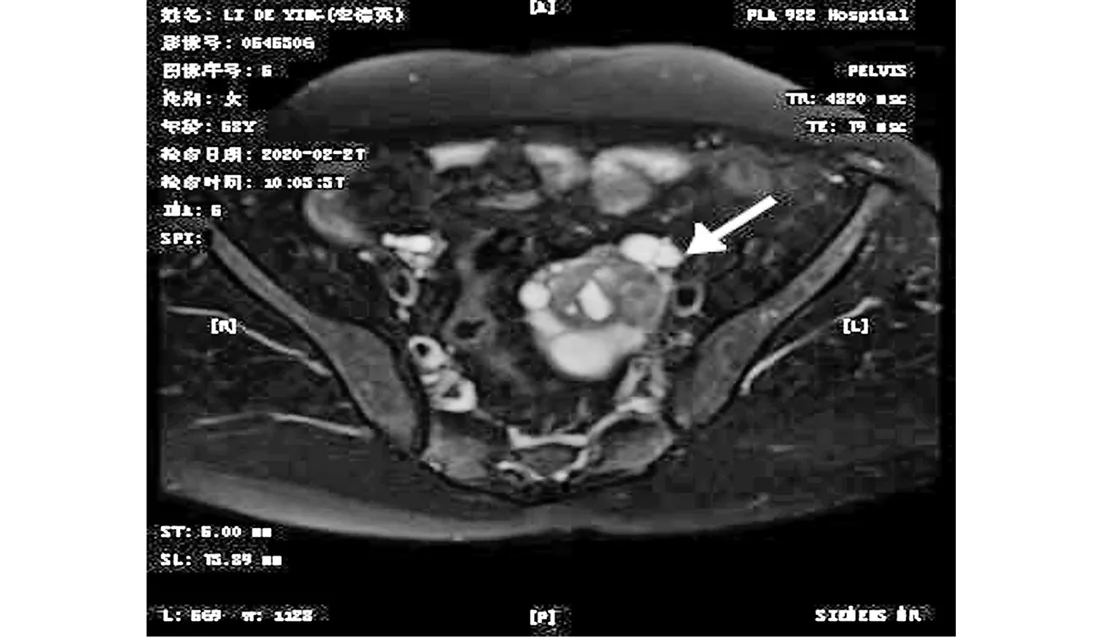
图2 术前磁共振图
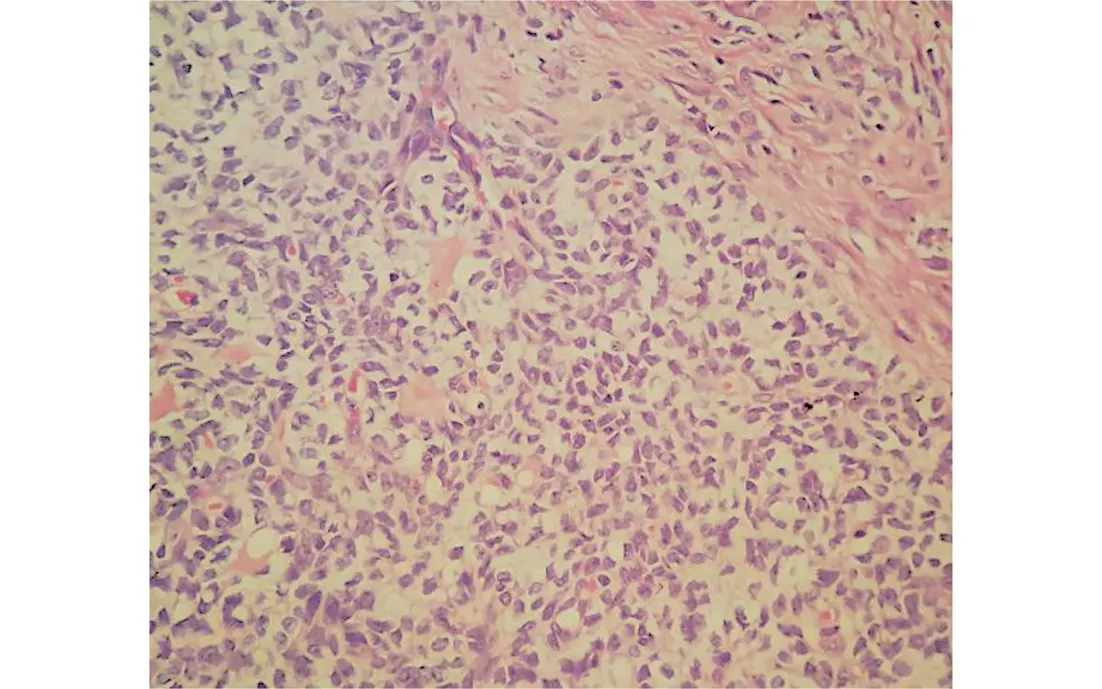
图3 术后病理图(HE,100×)
2 讨 论
GCT是一种较为罕见的卵巢肿瘤,发病率为(0.6~0.8)/100 000[1],肿瘤起源于卵巢间质和性索,占所有性索间质瘤的70%,占所有卵巢恶性肿瘤的3%~5%[1-2]。GCT可分为两种类型:成人型GCT(Adult ovarian granulosa cell tumor,AGCT)和青少年型GCT(Juvenile ovarian granulosa cell tumor,JGCT),AGCT较为常见,而JGCT仅占5%[1-2]。
AGCT平均发病年龄为47.1岁,发病高峰在50岁,绝经后妇女占58.8%[2]。阴道出血(28.4%)和腹部肿块(28.4%)是最常见的症状,17.6%的患者可因肿瘤自发性破裂而出现急性腹痛,22.5%患者无明显症状[2]。肿瘤平均直径为9.2~10.4 cm,单侧居多(98%)[3]。由于雌激素的刺激,AGCT患者常合并有子宫内膜异常增厚,数据显示33.3%患者合并子宫内膜病变:子宫内膜息肉占7.1%,简单型增生过长占7.1%,复杂型增生过长不伴非典型增生占2.1%,复杂型增生过长伴非典型增生占2.1%,子宫内膜癌占1.4%[4]。本例患者为绝经后妇女,绝经3年后出现阴道不规则流血合并左附件包块,并且2次诊断性刮宫病理分别为子宫内膜息肉和子宫内膜单纯性增生,均符合本病的典型临床表现。
AGCT的影像学表现与肿瘤体积相关。体积较小时,表现为实质性;随病情进展,瘤体逐渐增大,局部可出血坏死表现为混合性包块;随着肿瘤细胞的进一步液化坏死,肿瘤可呈完全囊性[5]。由于肿瘤可分泌雌激素,引起子宫的改变,如子宫增大、子宫内膜增生、子宫内膜息肉、子宫肌瘤等。同时由于雌激素的扩血管作用,瘤体实性部分血流信号丰富,阻力指数下降,呈高速低阻型血流频谱[6]。磁共振检查多为附件区实性、囊实性或囊性肿块,肿块边缘清楚,均有假包膜,囊壁及房间隔纤细、光滑,无壁内结节,呈“蜂房样”,增强扫描肿瘤的实性部分及间隔明显强化[5]。血清学抗苗勒管激素(anti-mullerian hormon,AMH)和抑制素B水平在AGCT患者中分别有较高的敏感性(92%和93%)和特异性(82%和83%),在原发性或复发性AGCT患者中均升高,且升高水平与肿瘤大小呈正相关,与肿瘤分期无关[7]。病理诊断标准采用2003年WHO诊断标准[8]:颗粒细胞增生伴纤维母细胞、卵泡膜细胞或黄素化卵泡细胞性的间质。典型的颗粒细胞胞质稀少,细胞核呈圆形或卵圆形,可见纵行核沟。核分裂象<(1~2)/10HPF。瘤细胞排列成多种形式,最常见的为含Call-Exner小体的微滤泡结构,其它包括内衬颗粒细胞的巨滤泡结构、岛状、梁状、弥漫浸润的(肉瘤样)、绸带样。免疫组化呈CD99、α-抑制素、Vimentin、钙网蛋白、S-100及SMA阳性,CK灶阳性,CK7和EMA阴性。
手术是AGCT患者的主要治疗方法,对于早期患者手术应包括子宫切除术和双侧输卵管卵巢切除术,在进行子宫内膜活检排除子宫内膜病变后,可不必常规行盆腹腔淋巴结清扫术。对于病灶局限(IA期)并希望保持生育能力的患者,可以进行患侧输卵管卵巢切除术和全面分期手术,术后妊娠和分娩对预后无明显影响。晚期(Ⅱ~Ⅳ期)患者应进行最大限度的肿瘤细胞减灭术[3,9]。
根据2018年的欧洲肿瘤内科学会(ESMO)非上皮性卵巢肿瘤诊疗指南,对于IA期AGCT患者术后无需任何治疗,对于IC2期患者可考虑行辅助性化疗[10]。最常用的化疗方案是博莱霉素、依托泊苷和顺铂(BEP)[10]。放射治疗可用于缓解晚期孤立性的复发病灶。激素疗法包括孕激素、芳香化酶抑制剂和促性腺激素释放激素激动剂,可用于复发性、转移性、不能耐受化疗或对常规化疗无效者。其它治疗方法包括靶向治疗,如贝伐单抗,可用于复发性患者[3,9-10]。Bonilla L等[11]的最新研究发现,对于难治性或不能耐受常规肿瘤治疗方案的AGCT患者使用激活素A抑制剂STM 434可通过阻断转化生长因子-β(transforming growth factor-β,TGF-β)信号通路发挥抗肿瘤作用。
由于AGCT一般生长缓慢,恶性程度较低且具有典型的临床表现,首次诊断时患者一般处于早期(Ⅰ期74%~95%,Ⅱ期5.1%~11%,Ⅲ期0.8%~10%,Ⅳ期0.5%~8.6%[9]),预后较好,5年和10年总生存率分别为93.3%和84.4%[12]。AGCT的复发率与肿瘤分期密切相关,Ⅰ期为8.1%,Ⅱ期为9.1%,Ⅲ期为40.0%[2]。对于I期患者,肿瘤穿透卵巢包膜或肿瘤破裂(IC期)患者的复发风险显著增加[3]。Suri等[13]人研究发现糖尿病是AGCT复发的高危因素(RR=3.58)。
AGCT有晚期复发的趋势,需要长期随访,随访内容包括体格检查和肿瘤标记物检查(如AMH和抑制素B);对于保留生育能力手术的患者应每6个月进行一次盆腔超声检查。有临床症状或肿瘤标志物升高时,应行CT或MRI检查[10]。最新研究发现35%的原发性AGCT患者和19%的复发性疾病患者的ctDNA(circulating tumor DNA)中发现了FOXL2突变[14],ctDNA FOXL2突变检测可能成为AGCT的非侵入性标志物,为AGCT的特异性分子诊断及预测肿瘤复发提供重要参考。
总之,AGCT是一种相对罕见的卵巢恶性肿瘤,有激素活性,临床表现较为典型,对于围绝经期或是绝经后出现异常子宫出血,合并有附件包块的妇女应考虑到该诊断的可能性,需进一步完善影像学和性激素水平检查,若辅助检查支持诊断,需进一步行诊断性刮宫排除子宫内膜恶性病变。AGCT的治疗以手术治疗为主,对复发和转移病例可采取综合治疗,治疗结束后需长期随访。

