SD大鼠血清TF、TM、vWF的含量与CRT形成的关系
韦 艳应燕萍凌 瑛赵慧函蒋庆娟甘 晓文 萃
(广西医科大学第一附属医院,南宁 530021)
导管相关性血栓(catheter-related thrombosis,CRT)是指导管留置期间或是移除后7 d内,在留置导管的静脉或邻近静脉内以及导管外壁出现血凝块,附壁血栓可自导管向血管腔内延伸扩展[1-2]。有研究报道,CRT 发生率为10.30%~30.77%[3-4],它可致导管功能丧失,增加患者的医疗风险和住院费用[5]。早在19 世纪,Virchow 提出血栓形成条件包括血管内皮损伤、血流状态改变和血液高凝状态[6],该理论同样适用于CRT 的形成。无论是经典理论,还是近来的研究发现,血管内皮损伤始终参与众多血栓性疾病的形成。本研究通过颈外静脉置管构建大鼠 CRT 模型,检测并分析组织因子(TF)、血栓调节蛋白(TM)及血管性假血友病因子(vWF)3 种血管内皮损伤标志物在大鼠血液中的含量变化,探讨其与 CRT 形成的关系,为 CRT 的预防、诊断和治疗提供参考。
1 材料和方法
1.1 实验动物
SPF 级 SD 雄性大鼠 120 只,12 周龄,体重 160~210 g,均购自并饲养于广西医科大学实验动物中心[SCXK(桂)2020-0004],实验前适应性饲养1周,均给标准饲料喂养,自由饮水,湿度为50% ~60%,室温为20℃~25℃,光线和通风情况均良好。无菌手术在广西医科大学实验动物中心屏障动物实验设施进行[SYXK(桂)2020-0003],所有实验操作均获得广西医科大学动物实验伦理委员会的批准(201808009),在研究过程中,实验者严格遵循国际实验动物福利伦理“3R”原则,给予大鼠应有的人道关怀。
1.2 主要仪器与试剂
酶标仪(Thermo 公司);离心机(TD5A-WS,湖南湘仪);切片机(RM2245,德国Leica 公司);生物组织自动包埋机(HD-310,湖北慧达仪器有限公司);紫外可见分光光度计(UV-5200PC,上海元析);正置荧光显微镜(BX53,日本Olympus 公司);大鼠组织因子(TF)酶联免疫试剂盒(96T,武汉华美生物工程有限公司,批号:CSB-E07914r);大鼠血栓调节蛋白(TM)酶联免疫试剂盒(96T,武汉华美生物工程有限公司,批号:CSB-E07939r);大鼠血管性假血友病因子(vWF)酶联免疫试剂盒(96T,武汉华美生物工程有限公司,批号:CSB-E08438r);1%戊巴比妥钠及1#(硅胶)小鼠颈静脉插管(思科诺生物科技(北京)有限公司);10%中性缓冲福尔马林固定液(广州维格斯生物科技有限公司)。
1.3 实验方法
1.3.1 分组及造模
采用sjwz 动物随机分组软件,将120 只SD 大鼠分为空白对照组(n=40 只)、假手术组(n=40只)、模型组(n=40 只),各组又分为术后 1 d、4 d、7 d、10 d、14 d 5 个亚组,每个亚组各 8 只。模型组:参照课题组前期实验手术方式[7],行大鼠腹腔内麻醉(1%戊巴比妥钠,按40 mg/kg 计算),待麻醉满意后,大鼠予仰卧位固定,完成备皮和消毒后,沿颈中线偏右侧(约0.5 cm)作一纵行切口,钝性分离皮下组织,暴露并完全游离右颈外静脉(长约1 ~1.5 cm),在静脉管壁上全层剪一"V"形小口,约占其周长的1/3~1/2,将末端连接有1 mL 注射器的小鼠颈静脉硅胶导管经由"V"形小口处置入2 ~2.5 cm,推抽注射器,见有血液回流且推注顺畅,予0.9%氯化钠注射液冲管后,导管末端用不锈钢堵头封管。以4-0 号线结扎固定近、远心端导管,并将导管连同附近的少许肌肉缝合2 ~3 针进行固定。导管远心端取长约1 ~1.5 cm 埋于手术切口皮下,最后缝合切口。假手术组:暴露右颈外静脉后,不行静脉切开,立即缝合手术切口。空白对照组:不做任何手术处理,予正常饲养。术毕,均以0.5%碘伏消毒手术切口,保温(室温约24℃),大鼠麻醉复苏后予正常分笼饲养。
1.3.2 大鼠样本取材、处理
于术后 1 d、4 d、7 d、10 d、14 d,分别从三组中随机取大鼠8 只,待大鼠麻醉满意后,于腹部作一长约3 cm 纵行切口,暴露腹主动脉后,行腹主动脉采血,每只抽取全血5 mL,采血完成后逐层缝合腹壁切口。将血标本用离心机以4000 r/min 速度离心5 min 制备血清,放入-80℃深低温冷冻冰箱保存备测。大鼠采血后实行安乐死,假手术组与模型组,沿原手术切口切开皮肤,钝性分离皮下组织,暴露右颈外静脉后,截取右颈外静脉至上腔静脉段(长约2 cm)的血管组织作为标本。空白对照组取与假手术组、置管组相同部位、相同长度的血管组织作为标本,用10%福尔马林液固定48 h,脱水后石蜡包埋、切片,并行HE 染色,显微镜下观察血栓的病理情况。取材术后,严格遵照动物实验伦理委员会的要求安置处理所有实验大鼠。
1.3.3 大鼠血清 TF、TM、vWF 浓度检测
血清TF、TM、vWF 含量采用酶联免疫吸附试验(ELISA)法测定,严格按照试剂盒说明书标准进行实验操作,最后通过专业Curve Expert 软件绘制标准曲线,根据标准曲线换算出待测样品的血清TF、TM、vWF 含量。
1.4 统计学方法
采用SPSS 22.0 统计软件分析数据,计量资料以平均数±标准差(±s)表示,多组均数间比较采用单因素方差分析和两两比较的LSD 或Tamhane检验。P<0.05 差异有统计学意义。
2 结果
2.1 动物一般情况及病理学结果
术后所有大鼠精神佳、正常进食、活动良好,实验期间,大鼠均存活。实验中,成功建立大鼠右颈外静脉导管留置模型40 例,置管成功率为100%,并有34 只发生CRT,CRT 发生率为85%。模型组术后1 d、4 d,血栓形成率分别为50.0%(4/8)、75.0%(6/8);术后 7 d、10 d、14 d 血栓形成率均为100.0%(8/8)。笔者前期研究的病理结果示[8]:空白对照组及假手术组,血管内膜完整,管腔内均无血栓形成。模型组术后1~4 d 是CRT 的形成阶段,均为混合血栓,镜下可见血小板小梁及梁间有红细胞分布;术后7~14 d 为CRT 机化的发展阶段,随着时间的推移,镜下可见血栓与血管壁黏连面积增大、纤维增生及毛细血管生成增多,且血管壁炎症浸润程度加重;术后14 d,镜下见血栓被肉芽组织完全替代,血管腔出现再通。
2.2 同组不同留置时间TF、TM、vWF 含量变化
空白对照组及假手术组TF、TM、vWF 的含量在不同时间点的差异无统计学意义(P>0.05)。模型组术后不同时间点TF、TM、vWF 比较,差异有统计学意义(P<0.01),见表1。术后,模型组大鼠血清TF、TM、vWF 含量随时间逐渐增加,其中 TF、vWF 含量在术后1~4 d 急剧上升,术后10 d 达到峰值,随后迅速下降;TM 含量在术后4 ~7 d 骤升,术后7 d达到峰值,随后开始下降并逐渐稳定,但仍高于术后4 d 水平。
表1 模型组不同时间点TF、TM、vWF 浓度比较( ±s)Table 1 Comparison of TF,TM and vWF concentrations at different time points in the model group

表1 模型组不同时间点TF、TM、vWF 浓度比较( ±s)Table 1 Comparison of TF,TM and vWF concentrations at different time points in the model group
注:与术后1、14 d 比较,*P<0.05;与术后4 d 比较,△P<0.05;与术后1、4 d 比较,#P<0.05;与术后7 d 比较,※P<0.05;与术后1 d 比较,$P<0.05。Note.Compared with 1 and 14 days after surgery,*P <0.05.Compared with 4 days after surgery,△P<0.05.Compared with 1 and 4 days after surgery,#P<0.05.Compared with 7 days after surgery,※P<0.05.Compared with 1 day after operation,$P <0.05.
组别Groups只数Number组织因子(pg/mL)Tissue factor血栓调节蛋白(ng/mL)Thrombomodulin血管性假血友病因子(ng/mL)Von Willebrand factor术后1 d 1 d after operation 8 33.802±6.390 13.265±2.845 540.450±101.738术后4 d 4 d after operation 8 46.259±6.953*$ 25.107±2.787 755.475±106.433 $术后7 d 7 d after operation 8 56.836±11.352*△ 51.352±4.223# 770.325±108.022 $术后10 d 10 d after operation 8 60.447±8.523*△ 38.408±4.526#※ 773.775±110.897 $术后14 d 14 d after operation 8 36.865±4.703 40.510±4.439#※ 664.275±117.066 $F /17.738 117.951 6.772 P/0.000 0.000 0.000
2.3 相同留置时间,不同组 TF、TM、vWF 含量变化
模型组发生CRT 大鼠的TF、TM、vWF 含量均较空白对照组和假手术组显著升高(P<0.01),模型组发生CRT 大鼠的TM 含量较未发生CRT 大鼠明显升高(P<0.01),模型组未发生CRT 大鼠的TM 含量较假手术组显著升高(P<0.01),模型组未发生CRT大鼠的TM、vWF 含量较空白对照组明显升高(P<0.01),见表2。术后各个时间点,模型组 TF、TM 含量均较空白对照组及假手术组明显升高(P<0.01),见表3、表4。术后1 d,模型组vWF 含量较空白对照组明显升高(P<0.01);术后 4 d、7 d、10 d、14 d,模型组vWF 含量较空白对照组及假手术组显著升高(P<0.01),见表5。
表2 TF、TM、vWF 的浓度在不同组间比较( ±s)Table 2 Comparison of TF,TM and vWF concentrations among different groups
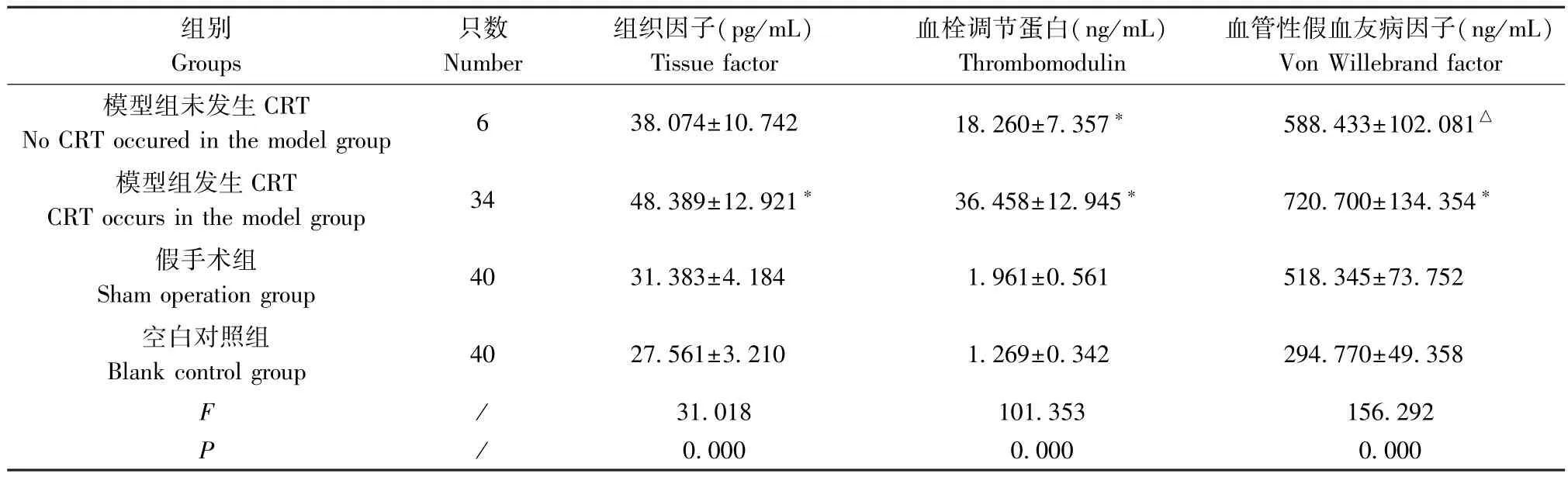
表2 TF、TM、vWF 的浓度在不同组间比较( ±s)Table 2 Comparison of TF,TM and vWF concentrations among different groups
注:与空白对照组及假手术组比较,*P<0.05;与空白对照组比较,△P<0.05。Note.Compared with the blank control group and sham operation group,*P<0.05.Compared with the blank control group,△P<0.05.
组别Groups只数Number组织因子(pg/mL)Tissue factor血栓调节蛋白(ng/mL)Thrombomodulin血管性假血友病因子(ng/mL)Von Willebrand factor模型组未发生CRT No CRT occured in the model group 6 38.074±10.742 18.260±7.357* 588.433±102.081△模型组发生CRT CRT occurs in the model group 34 48.389±12.921* 36.458±12.945* 720.700±134.354*假手术组Sham operation group 40 31.383±4.184 1.961±0.561 518.345±73.752空白对照组Blank control group 40 27.561±3.210 1.269±0.342 294.770±49.358 F /31.018 101.353 156.292 P/0.000 0.000 0.000
表3 术后不同时间点三组大鼠血清中TF 浓度的比较(pg/mL,±s)Table 3 Comparison of serum TF concentration in three groups of rats at different time points after operation

表3 术后不同时间点三组大鼠血清中TF 浓度的比较(pg/mL,±s)Table 3 Comparison of serum TF concentration in three groups of rats at different time points after operation
注:与空白对照组及假手术组比较,*P<0.05。Note.Compared with the blank control group and sham operation group,*P <0.05.
组别Groups只数Number术后1 d 1 d after operation术后4 d 4 d after operation术后7 d 7 d after operation术后10 d 10 d after operation术后14 d 14 d after operation空白对照组Blank control group 40 26.918±2.079 27.372±2.543 27.434±3.060 27.250±5.331 28.829±2.524假手术组Sham operation group 40 28.196±2.532 30.958±3.603 34.018±5.743 31.471±2.920 32.270±3.998模型组Model group 40 33.802±6.390* 46.259±6.593* 56.836±11.352* 60.447±8.523* 36.865±4.703*F /6.240 25.107 33.371 44.752 8.772 P/0.007 0.000 0.000 0.000 0.000
表4 术后不同时间点三组大鼠血清中TM 浓度的比较(ng/mL,±s)Table 4 Comparison of serum TM concentration in three groups of rats at different time points after operation
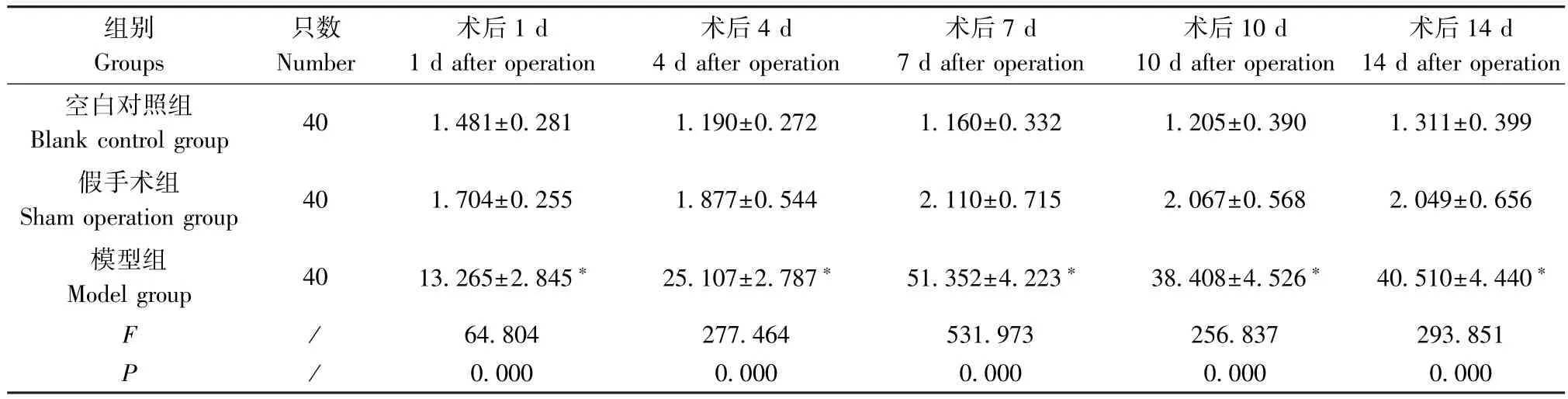
表4 术后不同时间点三组大鼠血清中TM 浓度的比较(ng/mL,±s)Table 4 Comparison of serum TM concentration in three groups of rats at different time points after operation
注:与空白对照组及假手术组比较,*P<0.05。Note.Compared with the blank control group and sham operation group,*P<0.05.
组别Groups只数Number术后1 d 1 d after operation术后4 d 4 d after operation术后7 d 7 d after operation术后10 d 10 d after operation术后14 d 14 d after operation空白对照组Blank control group 40 1.481±0.281 1.190±0.272 1.160±0.332 1.205±0.390 1.311±0.399假手术组Sham operation group 40 1.704±0.255 1.877±0.544 2.110±0.715 2.067±0.568 2.049±0.656模型组Model group 40 13.265±2.845* 25.107±2.787* 51.352±4.223* 38.408±4.526* 40.510±4.440*F /64.804 277.464 531.973 256.837 293.851 P/0.000 0.000 0.000 0.000 0.000
表5 术后不同时间点三组大鼠血清中vWF 浓度的比较(ng/mL,±s)Table 5 Comparison of serum vWF concentration in three groups of rats at different time points after operation

表5 术后不同时间点三组大鼠血清中vWF 浓度的比较(ng/mL,±s)Table 5 Comparison of serum vWF concentration in three groups of rats at different time points after operation
注:与空白对照组及假手术组比较,*P<0.05;与空白对照组比较,△P<0.05。Note.Compared with the blank control group and sham operation group,*P<0.05.Compared with the blank control group,△P <0.05.
组别Groups只数Number术后1 d 1 d after operation术后4 d 4 d after operation术后7 d 7 d after operation术后10 d 10 d after operation术后14 d 14 d after operation空白对照组Blank control group 40 291.975±67.355 300.600±44.561 296.750±43.494 299.400±53.498 285.125±45.979假手术组Sham operation group 40 507.950±42.688 499.250±63.158 531.975±63.284 565.950±114.309 486.600±54.117模型组Model group 40 540.450±101.738△ 755.475±106.433* 770.325±108.022* 773.775±110.897* 664.275±117.066*F 26.199 70.548 76.609 48.078 46.069 P/0.000 0.000 0.000 0.000 0.000/
3 讨论
血管内皮细胞(vascular endothelial cell,VEC),可以把血液中的血小板、凝血因子和有高度促凝作用的内皮下细胞成分隔开,发挥物理屏障作用,而且可分泌多种生物活性物质,维持血管内稳态,抑制血栓形成。经过一个多世纪,Virchow 的血栓形成机制虽已得到不断的丰富和发展,但Virchow 机制中哪个因素对CRT 形成起主导作用,仍有待考究。随着分子生物技术的发展,着手从分子和蛋白水平探讨内皮损伤与CRT 的关系,对深入研究CRT 的形成机制尤为重要。
本研究发现,内皮损伤程度与导管留置时间成正比,内皮损伤越重,CRT 发生率越高。导管从穿刺到留置,都存在血管内皮损伤的危险因素,最终导致CRT 的形成。本研究在建立导管留置模型时,因大鼠无意识、体积小及颈外静脉解剖位置的特殊性,使体表盲穿置管无法进行。因此置管手术只能在大鼠麻醉状态下,通过依层切开皮肤、皮下组织,暴露右颈外静脉后,在血管壁上剪一“V”形小口进行置管,这是血管内皮损伤的直接原因。内皮损伤后,其物理屏障功能遭到破坏,血小板与内膜的接触机会增加,血小板和凝血因子Ⅻ被激活;而且损伤的VEC 会释放促凝因子,激活凝血因子Ⅶ,随着内、外源性凝血过程的启动,促使CRT 的形成。其次,导管作为异物,留置过程中对血管壁存在机械刺激,易致内膜损伤;导管留置使局部血流速度变缓,被激活的凝血因子易在局部达到凝血需要的浓度,而血液瘀滞可引起血管内膜局部缺血缺氧,血管内皮细胞变性,暴露内皮下胶原,从而引发凝血过程[6],加速CRT 的形成。
有研究表明,留置针置管可改变血液凝血物质的水平[9]。组织因子(tissue factor,TF)是凝血级联反应的主要启动因子,血管壁遭到破坏时,VEC 释放的TF 暴露于血液中,与凝血因子Ⅶ/Ⅶa 结合发挥凝血作用,进而激活凝血因子Ⅸ、Ⅹ,可致凝血酶生成[10-11],外源性凝血途径被启动,促使血栓形成。临床研究发现,行全膝关节置换术患者血浆TF 水平与术后 DVT 的发生呈正相关(r = 0.673,P<0.05),TF 的表达在血栓患者中上调[12]。本研究结果表明,模型组TF 含量较空白对照组及假手术组明显升高(P<0.01)。随着血栓的演变,模型组TF含量逐渐升高,术后1 ~4 d 增幅最大,术后10 d 含量达到峰值,随后骤降至术后1 d 水平。血栓调节蛋白(thrombomodulin,TM),在VEC 破坏时会大量释放,其通过凝血酶发挥其生物学效应,还能增加蛋白C 的活化效率来发挥其抗凝作用。在大鼠深静脉血栓(deep venous thrombosis,DVT)模型实验中发现,血栓自然演变过程中,模型组各时间点血浆中sTM 浓度均显著高于对照组[13]。有学者认为,TM 是DVT 形成的重要标志物[14]。不少临床研究也报道,骨外伤、骨折及关节置换术后患者,血栓组TM 水平显著高于非血栓组[15-18]。本研究结果示:模型组未发生CRT 大鼠的TM 含量较假手术组和空白对照组显著升高(P<0.01);模型组TM 含量较空白对照组及假手术组明显升高(P<0.01);模型组TM 含量进行性升高,术后4 d 含量急速上升且在术后7 d 达到最高值,随后逐渐下降并保持着高于术后4 d 的稳定水平。血管性假血友病因子(von Willebrand factor,vWF),在凝血过程中通过发挥桥梁作用来介导血小板与内皮下胶原之间发生黏附,其也是凝血因子Ⅷ在血液中的载体。VEC 损伤时vWF 释放入血,促使血小板与管壁相互作用,引发血小板不断地黏集使血液处于高凝状态,最终导致血栓形成。动物研究发现,兔子耳缘静脉置入留置针后,血浆中vWF 浓度与血栓发生率成正比[9,19]。Liu 等[20]的临床研究报道,血浆中vWF 的浓度与血栓形成正相关。本研究也发现,模型组未发生CRT大鼠的 vWF 含量较空白对照组明显升高(P<0.01);术后 4 d、7 d、10 d、14 d,模型组 vWF 含量较空白对照组及假手术组显著升高(P<0.01);vWF含量随时间逐渐升高,术后1 ~4 d 含量骤升,术后10 d 含量达到峰值,术后14 d 含量急剧下降。
本研究中,置管手术和导管留置直接导致模型组大鼠血管内皮损伤,诱发各种促血栓分子大量释放,这是模型组未发生CRT 大鼠TM、vWF 含量较假手术组或空白对照组升高的原因。这部分大鼠镜下虽未见CRT,但并不排除血栓形成的可能,因早期的新鲜血栓,体积较小,很有可能已被软化、溶解。另外,手术创伤介导的VEC 损伤,引起凝血系统激活及血小板活化迅速启动,可能是模型组术后1~4 d,TF、vWF 含量骤升的主要原因。VEC 自身具有抗凝特性,其合成、分泌的TM 与血液中的凝血酶结合,并激活蛋白C,灭活凝血因子,发挥抗凝作用。因此术后早期TM 含量并没有大幅增加。术后4 d凝血系统激活最为迅速,凝血酶生成增多刺激性引起VEC 释放TM。随着导管留置时间延长,血栓体积增大及不断机化,血液流速渐缓,内膜缺血缺氧加重,VEC 损伤进行性加重,此时促凝因子合成释放增加、凝血系统激活及血小板黏附、黏集反应增强,因此术后1~10 d,TF、TM、vWF 含量总体上呈现时间依赖性上升。术后14 d,血栓已完全机化,毛细血管生成增多,新生内皮细胞逐渐增殖,内皮功能逐渐恢复,凝血系统激活与血小板活化等过程减弱,VEC 释放 TF、TM、vWF 也随之下降。
4 小结
在血管内皮损伤为始发因素的前提下,以VEC损伤介导的凝血系统激活、血小板活化及血液流变学改变等多种因素可能共同参与了CRT 形成,可见CRT 形成的调控网络是一个极其复杂多变的动态过程。本研究发现,TF、TM、vWF 的高表达,与血管内皮损伤程度平行,在CRT 形成过程中,可能起到关键作用。为进一步在分子、细胞层面研究CRT 形成机制奠定了基础。

