转录因子YY1上调PD-L1表达促进胆囊癌免疫逃逸的作用研究
周 杰李敬东权 刚孙 骥
(川北医学院附属医院肝胆外科/川北医学院肝胆胰肠研究所,四川南充 637000)
胆囊癌是发生于胆囊的恶性肿瘤,发病率位居消化道系统肿瘤的第6 位,在中国发病率为(1.00 ~1.30)/10 万,其恶性程度高,预后差[1-2]。最近研究表明,在恶性肿瘤发生发展进程中,人体免疫系统表现乏力,免疫细胞无法识别肿瘤细胞,此外肿瘤细胞还可分泌免疫抑制因子以破坏人体免疫系统[3-4]。因此,近几年探究肿瘤细胞如何逃避免疫系统监视成为研究热点。转录因子阴阳1(Yin-Yang1,YY1)可作为核转录因子广泛表达于多种组织和细胞中,是多梳(polycomb group,PcG)蛋白家族的一员,参与细胞组织分化、染色质重塑、肿瘤发生发展进程[5-6]。程序性死亡分子配体 1(programmed death ligand 1,PD-L1)又称为CD274,在非小细胞肺癌、结直肠癌等多种肿瘤组织中高表达且与其免疫逃逸机制密切相关[7-8]。研究发现,在胆囊癌组织中PD-L1 高表达,是影响胆囊癌患者不良预后的独立危险因素[9]。在胆囊癌中,PD-L1在免疫逃逸中发挥何种作用及调控机制未见相关报道,PROMO 网站预测显示,YY1 序列 3’UTR 区存在3 个PD-L1 结合位点,说明PD-L1 是YY1 的靶基因。因此本研究构建 YY1 siRNA-1675 转染的GBC-SD 细胞进行研究,以期探究YY1 和PD-L1 在胆囊癌免疫逃逸的作用。
1 材料和方法
1.1 实验材料
1.1.1 实验组织
随机选取2017 年7 月-2019 年10 月在本院确诊并行胆囊切除术的胆囊癌组织标本及对应癌旁胆囊组织标本各40 例,所选患者在术前均未接受治疗,临床资料保存完整,患者已签署知情同意书。另随机选取同期因患胆囊结石患者行胆囊切除术的正常胆囊组织标本20 例,患者已签署知情同意书。组织切除后,迅速将组织置于4%中性甲醛溶液中保存。
1.1.2 实验细胞
人胆囊永生化上皮细胞系HGBEC 和人胆囊癌细胞系GBC-SD、SGC-996、IH-GB1 均购自中科院上海细胞库;人T 淋巴细胞购自上海美轩生物科技有限公司。
1.2 主要试剂与仪器
DMEM 培养液、胎牛血清(fetal bovine serum,FBS)均购自北京索莱宝科技有限公司,批号分别:12100、F8250;细胞裂解液购自碧云天生物技术研究所,批号:RG129M;QuantiFast SYBR® Green PCR Kit 试剂盒购自德国QIANGE 公司,批号:MA-1547;EasySep Human T cell Enrichment 试剂盒购自北京诺为生物技术有限公司,批号:Q0412;白细胞介素-2(Interleukin-2,IL-2)、白细胞介素-4(Interleukin-4,IL-4)、白细胞介素-10(Interleukin-10,IL-10)ELISA试剂盒均购自帝肯(上海)贸易有限公司,批号分别: BE53021、BE53041、BE51001; 干 扰 素 γ(interferon-gamma,IFN-γ)ELISA 试剂盒购自上海广锐生物科技有限公司,批号:R-783;质粒载体PGPU6/GFP/Neo 购自上海吉凯化学公司,批号:190416 L;萤火虫荧光素酶(FLUC)检测试剂盒购自美国 GeneCopoeia 公司,批号:SF-1322。DM6M 光学显微镜购自德国徕卡公司;Varioskan LUX 多功能酶标仪购自美国赛默飞世尔科技公司;Mastercycler nexus X2 PCR 仪购自德国艾本德公司;CytoFLEX 流式细胞仪购自美国贝克曼库尔特公司。YY1 siRNA-1675 序列为 5’-GGGAGCAGAAGCAGGTGC AGT-3’、YY1 siRNA-NC 序列为 5’-AGGGCGAAC GGGCGAGTGG-3’,由广州瑞博生物公司合成。
1.3 实验方法
1.3.1 细胞系和细胞转染
细胞培养液由 10% FBS、100 μg/mL 链霉素、100 U/mL 青霉素、80% DMEM 培养液组成,常规培养在相对湿度98%、5% CO2、37℃恒温培养箱中。隔天换液,光学显微镜观察细胞生长情况,胰酶消化传代,取对数生长期HGBEC 细胞、GBC-SD、SGC-996、IH-GB1 细胞、T 淋巴细胞用于实验。取对数生长期GBC-SD 细胞,调整细胞密度为每毫升2×104个,接种至24 孔培养板上,待GBC-SD 细胞平铺占培养板底部约50%时,采用脂质体瞬时转染法,按照Lipo fectamineTM2000 转染试剂盒说明书,转染试剂:质粒=3 μL:1 μg 比例配置质粒粒-质粒体复合物,将 YY1 siRNA-1675、YY1 siRNA-NC(YY1 siRNA无关序列)、空白质粒(BC 组)转染至GBC-SD 细胞中,转染24 h 后弃旧培养液,更换DMEM 常规培养液,置于荧光显微镜下观察转染情况。qRT-PCR 法测定各细胞中YY1 mRNA 水平,继续培养用作实验,实验分为:1)BC 组;2)YY1 siRNA-NC 组;3)YY1 siRNA-1675 组。
1.3.2 免疫组化法检测各组织中YY1 表达
制备常规石蜡切片,进行脱蜡、水化处理,加入Anti-YY1 抗体(1 ∶100),4℃ 孵育过夜,次日 PBS 清洗后,加入二抗(1 ∶2500),37℃孵育 1 h,加链霉素抗生物蛋白-过氧化物酶溶液,37℃孵育40 min 后,进行DAB 显色,苏木素复染,脱水、透明处理,最后用中性树胶封片。每张切片随机取5 个视野(×200)观察分析。评分标准:(1)按细胞染色:未染色为0 分,浅黄色为1 分,棕黄色为2 分,棕褐色为3分;(2)按阳性细胞比例:≤10% 1 分,11%~50% 2分,51%~75% 3 分,>75% 4 分,最终得分=染色得分×阳性细胞比例得分;≤3 分,为阴性或弱阳性,记作“-”;>3 分,为阳性,记作“+”。
1.3.3 qRT-PCR 法测定各细胞中YY1 水平
用200 μL 细胞裂解液裂解培养板中各细胞,离心后取上清液,行逆转录,逆转录体系:RNase-free dH2O 5 μL、Total RNA 2 μL、5X gDNA Eraser Buffer 2 μL、gDNA Eraser 1 μL,逆转录得 cDNA,以 cDNA作为扩增模板用于qRT-PCR 扩增。引物由宝日医生物技术(北京)有限公司合成。YY1 上游引物序列 5’-CCAGAAAACACAAATT-3’,下游引物序列5’-AAAGAAGAGAGAAAAGAGGTT-3’;GAPDH 上游引物序列 5’-GGTGAAGGTCGGAGTCAACG-3’,下游 引物 序列 5’-CCATGTAGTTGAGGTCAAT GAAG-3’。扩增体系:反向引物 2 μL、正向引物 2 μL、RNase-free dH2O 4 μL、2X QuantiFast SYBR Green PCR Master Mix 10 μL、cDNA 2 μL。扩增条件:95℃预变性 5 min,(95℃ 10 s、60℃ 34 s、68℃30 s)×38 个循环,72℃延伸 10 min。每个样本重复6 次。采用 2-ΔΔCT法计算 YY1 相对 GAPDH mRNA表达量。
1.3.4 流式细胞仪测定 PD-L1、CD69、CD25 水平
各组GBC-SD 细胞经胰酶消化后,用DMEM 培养液调整细胞密度为每毫升1×105个,接种至anti-CD3 预包被的96 孔板中,随后加入人T 淋巴细胞,两者按GBC-SD:T(1 ∶5)的效靶比混合,常规培养3 d 后,用 EasySep Human T cell Enrichment 试剂盒收集T 淋巴细胞,流式细胞仪测定GBC-SD 细胞PDL1 水平、T 淋巴细胞 CD69、CD25 水平。
1.3.5 流式细胞仪测定人T 淋巴细胞凋亡率
各组GBC-SD 细胞经胰酶消化后,用DMEM 培养调整细胞密度为每毫升2×105个,接种至 anti-CD3 预包被的24 孔板中,随后加入人T 淋巴细胞,两者按GBC-SD:T(1 ∶5)的效靶比混合,常规培养3 d,收集人T 淋巴细胞,预冷的乙醇固定20 min,离心,调整细胞密度为每毫升1×106个,加入 PI 和AnnexinV-FITC,避光上样,用流式细胞仪检测。
1.3.6 ELISA 检测 IL-2、IL-4、IL-10、IFN-γ 水平
按照“1.3.5”所述培养细胞,取上清液,用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)测定 IL-2、IL-4、IL-10、IFN-γ 水平,操作按照试剂盒说明书执行。
1.3.7 双荧光素酶报告实验验证YY1 与PD-L1 靶标关系
(1)生物学信息预测及突变载体制备
使用PROMO 网站预测YY1 的潜在靶基因,构建PD-L1 3’UTR 区域含有结合位点及突变的序列pMIR-Report-PD-L1-3’UTR 质粒,行双酶切后与同样行双酶切的 pmirGLO 载体连接,构建野生pmirGLO-PD-L1-3’UTR-WT(PD-L1-WT)验证载体及突变型 pmirGLO-PD-L1 - 3’ UTR-Del1-MUT +YY1siRNA-1675 ( PD-L1-Del1-MUT + YY1 siRNA-1675),PD-L1-Del2-MUT+YY1 siRNA-1675,PD-L1-Del3-MUT+YY1 siRNA-1675,PD-L1-Del1、2、3-MUT+YY1 siRNA-1675 组验证载体及对照组PD-L1-WT+YY1 siRNA-1675。
(2)双荧光素酶报告实验
将YY1 siRNA-1675 分别与上述构建的载体共转染,转染24 h 后,加入萤火虫荧光素酶(FLUC)检测试剂,15 min 后测定FLUC 活性值F,随后加入海肾荧光素酶(RLUC)检测试剂,10 min 后测定RLUC活性值R,荧光素酶相对活性用R/F 比值表示,每组实验平行6 次。
1.4 统计学方法
采用SPSS 22.0 统计软件进行数据分析,计量资料以平均数±标准差(±s)表示,n表示样本数,多组间比较行单因素方差分析,进一步两两比较采用SNK-q检验;计数资料用%表示,行卡方检验。P<0.05为差异有统计学意义。
2 结果
2.1 不同胆囊组织中YY1 表达水平比较
YY1 蛋白主要定位于细胞核,阳性细胞呈棕黄色,与正常组织相比,癌旁组织、胆囊癌组织中YY1阳性表达率显著升高(P<0.05),与癌旁组织相比,胆囊癌组织中YY1 蛋白阳性表达率显著升高(P<0.05)。见图1、表1。
2.2 各细胞中YY1 水平比较
收集人胆囊癌 IH-GB1、SGC-996、GBC-SD 细胞和人胆囊上皮HGBEC 细胞,检测 YY1mRNA 水平表达,qRT-PCR 结果显示 YY1 在 IH-GB1、SGC-996、GBC-SD 细胞中相对表达量分别为1.57±0.12、1.62±0.13、1.97±0.15,显著高于在 HGBEC 细胞中相对表达量 1.03±0.11(P<0.05),见图2。
2.3 转染后GBC-SD 细胞YY1 水平比较
转染siRNA-1675 24 h 后,置于荧光显微镜下观察转染情况,YY1 siRNA-NC 组和YY1 siRNA-1675组均已成功转染且转染效率较高,42 h 后收集细胞,提取RNA,qRT-PCR 结果显示,YY1 siRNA-1675组YY1 相对表达量为1.37±0.11 显著低于BC 组和YY1 siRNA-NC 组 YY1 相对表达量为1.96±0.14,1.92±0.16(P<0.05),见图3。
2.4 转染后GBC-SD 细胞PD-L1 水平比较
转染siRNA-1675,42 h 后收集细胞,流式细胞仪测定 GBC-SD 细胞 PD-L1 水平,siRNA-1675 组PD-L1 表达为(20.17±3.16)%,显著低于 BC 组和YY1 siRNA-NC 组 PD-L1 表 达 量 为 (34.18 ±5.21)%,(32.30±5.87)%(P<0.05),见图4。
2.5 转染后GBC-SD 细胞对人T 淋巴细胞凋亡率的影响
转染siRNA-1675,42 h 后收集细胞,流式细胞仪测定人T 淋巴细胞凋亡率,BC 组细胞凋亡率为(16.7±1.8)%,YY1 siRNA-NC 组细胞凋亡率为(17.2±1.9)%,YY1 siRNA-1675 组细胞凋亡率为(8.0±1.2)%,与 BC 组、YY1 siRNA-NC 组相比,YY1 siRNA-1675 组人T 淋巴细胞凋亡率明显降低(P<0.05),见图5。
2.6 转染后GBC-SD 细胞对人T 淋巴细胞CD69、CD25 水平的影响
转染siRNA-1675,42 h 后收集细胞,流式细胞仪测定 T 淋巴细胞 CD69、CD25 水平,BC 组 T 淋巴细胞 CD69、CD25 水平为(64.21±8.37)%、(48.51±5.94)%,YY1 siRNA-NC 组 T 淋巴细胞 CD69、CD25水平为(68.64±7.95)%、(50.48±6.50)%,YY1 siRNA-1675 组 T 淋巴细胞 CD69、CD25 水平为(89.36±10.48)%、(68.87±5.85)%,与 BC 组、YY1 siRNA-NC 组相比,YY1 siRNA-1675 组 T 淋巴细胞CD69、CD25 水平明显升高(P<0.05),见图6。
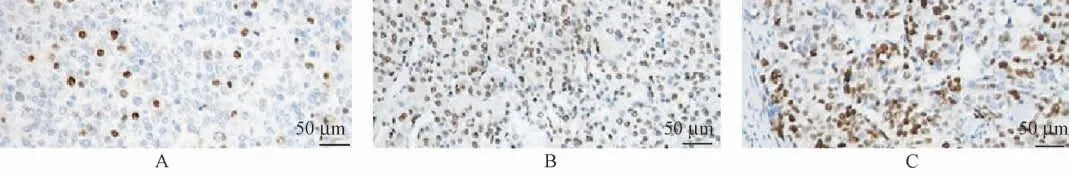
图1 不同胆囊组织中YY1 蛋白表达情况(免疫组化染色)Figure 1 Expression of YY1 protein in different gallbladder tissues (Immunohistochemical staining)

表1 不同胆囊组织中YY1 表达水平比较Table 1 Comparison of YY1 expression levels in different gallbladder tissues



2.7 各组细胞上清液中 IL-2、IL-4、IL-10、IFN-γ水平比较
转染siRNA-1675,42 h 后收集细胞,取上清液,用ELISA 测定 IL-2、IL-4、IL-10、IFN-γ 水平,与 BC 组、YY1 siRNA-NC 组相比,YY1 siRNA-1675 组细胞上清液中IL-2、IL-4、IL-10、IFN-γ 水平显著升高(P<0.05);BC 组和 YY1 siRNA-NC 组细胞上清液中 IL-2、IL-4、IL-10、IFN-γ 水平差异无统计学意义(P>0.05),见表2。
2.8 YY1 与 PD-L1 靶标关系
荧光素酶报告实验显示,与PD-L1-WT 组比,PD-L1-WT+YY1 siRNA-1675 组荧光素酶相对活性明显降低(P<0.05);与 PD-L1-WT+YY1 siRNA-1675 组比,PD-L1-Del1-MUT+YY1 siRNA-1675 组、PD-L1-Del2-MUT+YY1 siRNA-1675 组、PD-L1-Del3-MUT+YY1 siRNA-1675 组、PD-L1-Del1、2、3-MUT+YY1 siRNA-1675 组荧光素酶相对活性显著升高(P<0.05),说明 PD-L1 是 YY1 的作用靶点。见图7。
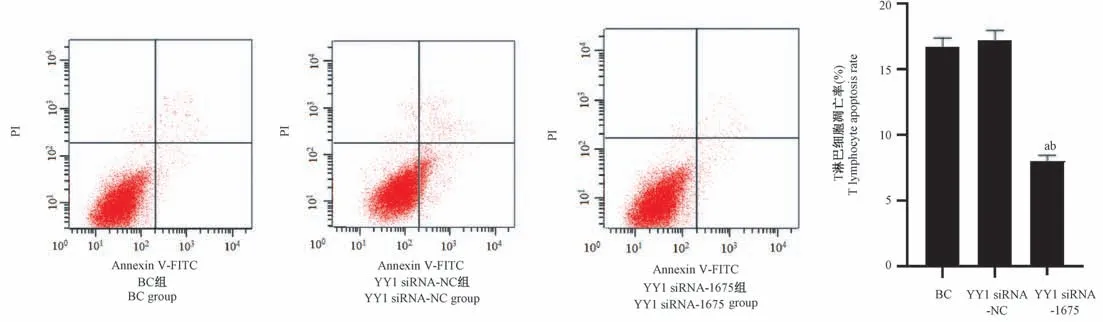
图5 转染后GBC-SD 细胞对人T 淋巴细胞凋亡率的影响Figure 5 Effect of GBC-SD cells on human T lymphocyte apoptosis rate after transfection
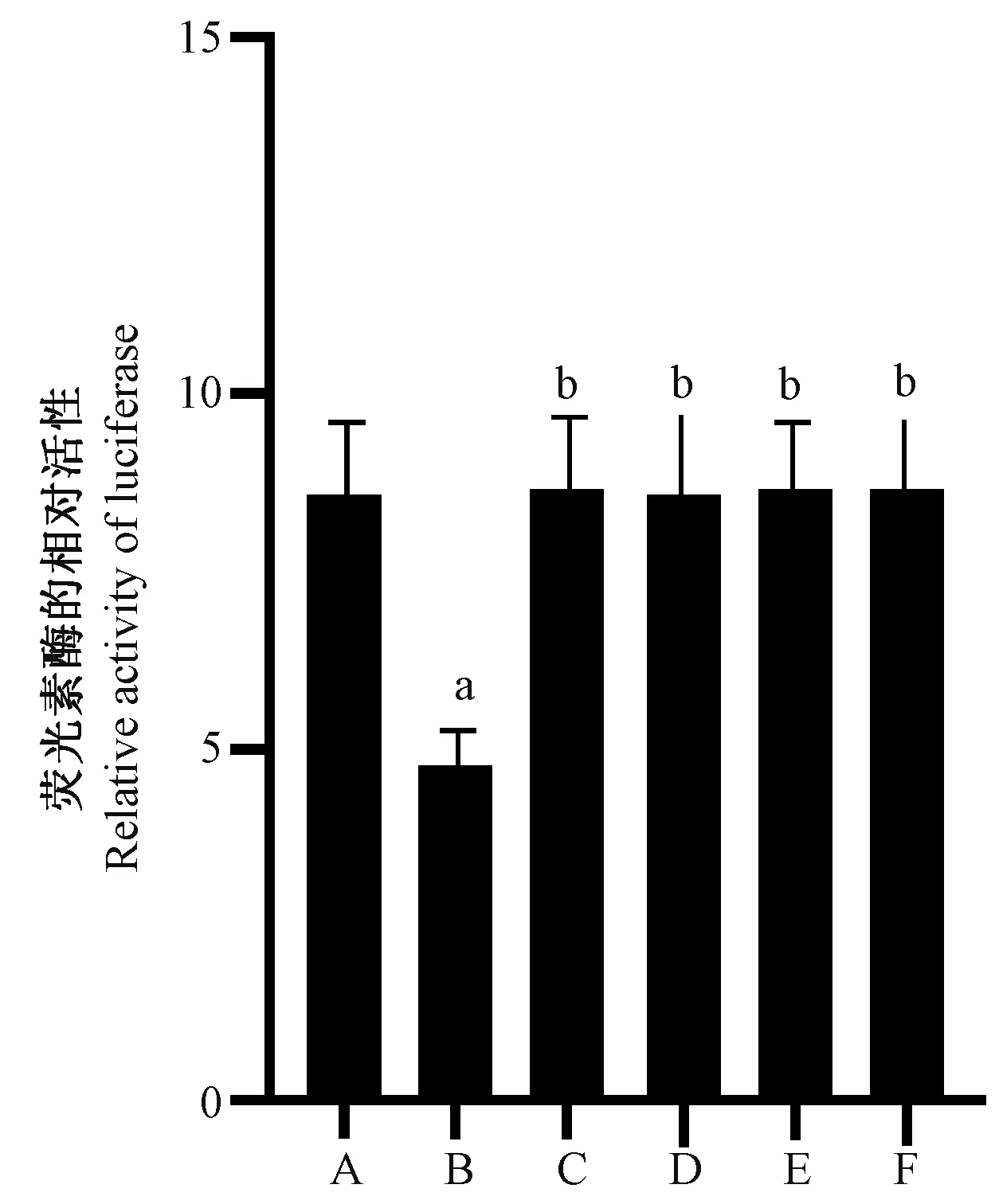
图7 荧光素酶的相对活性Figure 7 Relative activity of luciferase
表2 各组细胞上清液中IL-2、IL-4、IL-10、IFN-γ 水平比较( ±s,n=6)Table 2 Comparison of IL-2,IL-4,IL-10,IFN-γ levels in cell supernatants of each group

表2 各组细胞上清液中IL-2、IL-4、IL-10、IFN-γ 水平比较( ±s,n=6)Table 2 Comparison of IL-2,IL-4,IL-10,IFN-γ levels in cell supernatants of each group
注:与 BC 组相比,aP<0.05;与 YY1 siRNA-NC 组相比,bP<0.05。Note.Compared with BC group,aP<0.05.Compared with YY1 siRNA-NC group,bP <0.05.
组别Groups IL-2(pg/mL)IL-4(pg/mL)IL-10(pg/mL)IFN-γ(pg/mL)BC 组BC Group 527.48±64.83 22.47±5.16 54.14±6.72 615.82±74.08 YY1 siRNA-NC 组YY1 siRNA-NC Group 571.08±52.19 25.1±6.18 57.01±8.29 644.29±80.82 YY1 siRNA-1675 组YY1 siRNA-1675 Group 1745.29±204.86ab 88.34±10.19ab 368.27±48.62ab 2854.07±340.16ab
3 讨论
目前,临床上治疗胆囊癌主要以手术、化疗、放疗和分子靶向治疗为主,但胆囊癌侵袭性强,术后易复发,导致患者生存率低[10]。近几年,随着临床上对肿瘤免疫逃逸机制的深入研究,免疫疗法有望成为治疗肿瘤的新兴疗法[11]。YY1 基因位于人14号染色体端粒区,q32.2,其蛋白含有4 个锌指结构,可与目的基因结合,具有激活或抑制目的基因转录的作用,在多种肿瘤疾病中发挥重要作用[12]。本研究发现,与正常组织、癌旁组织相比,胆囊癌组织中YY1 阳性表达率显著升高,人胆囊癌细胞IH-GB1、SGC-996、GBC-SD 细胞较正常人胆囊上皮HGBEC细胞中YY1 水平升高,说明YY1 与胆囊癌相关,其中以GBC-SD 细胞中YY1 水平最高,因此后续实验以GBC-SD 细胞进行。
PD-L1 是负向免疫调节信号,可抑制肿瘤特异性CD8+T 细胞增殖和免疫活性,参与免疫逃逸,临床上PD-L1 抗体的免疫治疗已经成为抗肿瘤治疗和辅助治疗的重要手段[13]。行PROMO 网站预测发现,YY1 序列 3’UTR 区存在 3 个 PD-L1 结合位点,推测YY1 可调控 PD-L1 表达。本研究发现,转染 YY1 siRNA-1675 后,转染 YY1 siRNA-1675 后,与BC 组、YY1 siRNA-NC 组相比,YY1 siRNA-1675 组GBC-SD 细胞YY1 水平降低,说明YY1 siRNA-1675转染成功,YY1 siRNA-1675 组较BC 组、YY1 siRNANC 组PD-L1 水平随之降低,说明抑制YY1 表达,可下调PD-L1 水平。进一步荧光素酶报告实验证明PD-L1 是YY1 的作用靶点,说明 YY1 可靶向调控PD-L1 表达。
PD-L1 是肿瘤免疫研究的热点,研究发现,PDL1 在三阴性乳腺癌组织中高表达,与淋巴结转移、高组织学级别、肿瘤浸润淋巴细胞PD-1 阳性相关[14]。在胶质瘤组织中PD-L1 阳性表达率显著升高,可促进 T 细胞凋亡[15]。在非小细胞肺癌(NSCLC)患者外周血单核细胞和T 细胞中PD-L1高表达,通过抑制T 细胞增殖,参与NSCLC 细胞免疫逃逸进程[16]。本研究发现,与 BC 组、YY1 siRNA-NC 组相比,YY1 siRNA-1675 组人 T 淋巴细胞凋亡率降低,说明下调PD-L1 能够降低人T 淋巴细胞凋亡率,抑制GBC-SD 细胞免疫逃逸。研究显示,调节性 T 细胞可分泌 IL-2、IL-4、IL-10、IFN-γ 等相关因子,参与细胞免疫和体液免疫[17]。CD25 和CD69 是T 细胞活化的标记物,其水平与T 细胞活性呈正相关[18]。本研究发现,与 BC 组、YY1 siRNA-NC 组相比,YY1 siRNA-1675 组细胞上清液中 IL-2、IL-4、IL-10、IFN-γ 水平升高,T 淋巴细胞CD69、CD25 水平升高,说明下调PD-L1 水平可促进T 细胞活化,从而分泌细胞因子,参与免疫进程。
综上所述,在 GBC-SD 细胞中 YY1、PD-L1 均高表达,YY1 可靶向调控PD-L1 参与胆囊癌免疫逃逸进程。但是YY1、PD-L1 在胆囊癌组织中的表达水平及与临床病理特征的关系有待后续实验探究。

