非透析慢性肾病室性心律失常的发生率及其预测因素分析
师睿,李国良,强华,李红兵,卫月娇,薛小临,孙超峰,殷艳蓉
心源性猝死是透析性慢性肾病(CKD)患者死亡的最常见原因,占总死亡率的20%~30%[1]。研究表明,CKD人群中心源性猝死及心律失常的总体发生率高于冠状动脉(冠脉)事件的发生率,其中室性心律失常的增加被认为是心源性猝死的首要原因[2]。另外,CKD患者更易出现心脏舒张功能障碍、电解质紊乱和相关代谢紊乱等。因此,其相关心律失常尤其是室性心律失常的发生有一定的特征性[3]。目前,对非透析CKD患者室性心律失常的研究仍比较缺乏。因此,本研究旨在通过持续动态心电图监测,对不同程度的非透析CKD患者心律失常的发生情况进行调查,并评估此类患者中室性心律失常的发生率及其预测因素。
1 资料和方法
1.1 研究对象连续入选于西安交通大学第一附属医院就诊的CKD 1~4期患者。入选标准包括:①≥18岁且根据2012年CKD诊断及治疗指南确诊为CKD(1~4期)超过3个月;②检查肾功能、尿白蛋白、电解质、甲状旁腺激素、心脏超声等;③行连续24 h非侵入性动态心电图(Holter)监测。排除标准包括:<18岁、慢性炎症性疾病或感染、活动性恶性肿瘤、人类免疫缺陷病毒、病毒性肝炎、长期使用类固醇药物、急性冠状动脉综合征、结构性心脏病或心脏手术、急性脑卒中、甲状腺功能异常及已行抗心律失常治疗者。收集患者的一般资料、Holter资料、心脏超声、肾小球滤过率(GFR)等相关生化和代谢指标资料。
1.2 CKD的分期根据美国肾脏病基金会KDOQI专家组对CKD的分期方法,依据小球滤过率[GFR,ml/(min·1.73 m2)]的程度,将CKD进行分期:1期(GFR≥90),2期(GFR为60~89),3期(GFR为30~59)和4期(GFR为15~29)。
1.3 动态心电图监测采用美国DMS公司Plus型三通道动态心电图监测分析系统对患者进行24 h Holter监测,记录开始时间为早晨8:00~9:00,于次日8:00~9:00结束。应用人机对话模式排除伪差及干扰,采用BioxWin计算机分析软件对所获取心电图像进行分析,主要记录的心律失常包括:心房颤动(房颤),室性心动过速(室速),窦性停搏(>3 s),二度Ⅱ型或三度房室传导阻滞,室性早搏,房性早搏,室上性心动过速等。其中房颤、室速和窦性停搏这三种类型为主要心律失常。室速指心室率>100 次/min,连续3个或3个以上的自发性室性电除极活动。定义室性早搏数量<30个/h为偶发,≥30个/h为频发。
1.4 心脏超声胸骨旁左室长轴切面测量左房内径、左室舒张末内径、左室收缩末内径、舒张期室间隔厚度、舒张期左室后壁厚度。Devereux公式计算左室心肌质量(LVM)LVM(g)= 0.8×[1.04×(左室舒张末内径+舒张期室间隔厚度+舒张期左室后壁厚度)3-左室舒张末内径3]+0.6。根据结果定义男性左室心肌质量≥134 g/m2,女性>110 g/m2为左室心肌质量增加。心尖四腔和两腔切面测量左室收缩末期容积和舒张末期容积,双平面Simpson法计算左室射血分数。定义左室射血分数(LVEF)≤55%为左室收缩功能障碍。
1.5 实验室检查监测Holter 检查7 d内相关生化和代谢指标包括血红蛋白、GFR、电解质、血脂、血糖等。
1.6 统计学处理所有数据应用SPSS 20.0进行分析,计量资料用均数±标准差表示,用t检验或单因素方差分析(ANOVA)。计数资料用率表示,用卡方检验或Fisher精确检验。根据是否发生室性心律失常,将研究人群进一步分为两组,并进行两组比较。采用多因素logistic回归分析法,评估室性心律失常发生的预测因素,单变量分析中P<0.05的变量纳入多元回归分析。双侧检验P<0.05为差异有统计学意义。
2 结果
2.1 患者基线特征共连续入选非透析CKD患者84例,男性53例,平均年龄(62±11)岁,其中大多数患者处于CKD3期(31%)和4期(40%),并且分别有30%和28%的患者存在超重或肥胖,主要合并症是高血压(41%)和糖尿病(33%)。超声显示左心房内径平均(43.6±0.8)mm,其中左房内径≥40 mm者39例(占46%),26%的患者存在左室心肌质量增加,11%的患者有左心室收缩功能障碍。心律失常的整体发生率为34%(表1)。
2.2 基本药物治疗分析大多数患者使用了利尿剂(81%),β受体阻滞剂(51%),血管紧张素转换酶抑制剂(46%)或血管紧张素受体拮抗剂(30%),他汀类药物(32%)。此外,有12例(14%)使用钙基磷酸盐结合剂,11例(13%)使用钙三醇,10例(12%)使用红细胞生成刺激剂。

表1 非透析慢性肾病患者基本特征及心律失常
2.3 基础心律患者24 h的平均心率、最快心率、最慢心率分别为(74±7)次/min、(107±13)次/min、(62±7)次/min。其中平均心率>100次/min的发生率为6.2%,平均心率<60 次/min的发生率为5.9%。
2.4 心律失常的发生率患者的心律失常(发生率)包括:房颤(1 7%),非持续性室速(29%),室性早搏(20%),窦性停搏(4%),室上性心动过速(8%),二度Ⅱ型或三度房室传导阻滞(4%),房性早搏(30%)。其中三种主要心律失常的发生率随着慢性肾病程度的加重而显著增加(P<0.05),如图1所示。

图1 非透析慢性肾病的程度与心律失常
2.5 室性心律失常及预测因素共34例患者(40%)在Holter监测中发现室性心律失常,包括室性心动过速(29%)和频发室性早搏(20%),其中12例患者并存室上性心律失常。与无室性心律失常组进行比较,有室性心律失常组患者的年龄更大[(64±12)岁 vs.(56±11)岁,P=0.013],GFR更差[(31±14 )ml/min·1.73 m2vs.(40±15)ml/min·1.73 m2,P<0.001],血红蛋白更低[(93±21)g/L vs.(98±23)g/L,P=0.003]。另外,室性心律失常组患者的左室心肌质量更严重[(120±6)g/m2vs.(94±8)g/m2,P<0.001],其左室收缩功能更差[(56 ± 10)% vs.(64±9)%,P<0.001],两组详细比较如表2所示。
表2 两组患者基本特征的比较(±s)
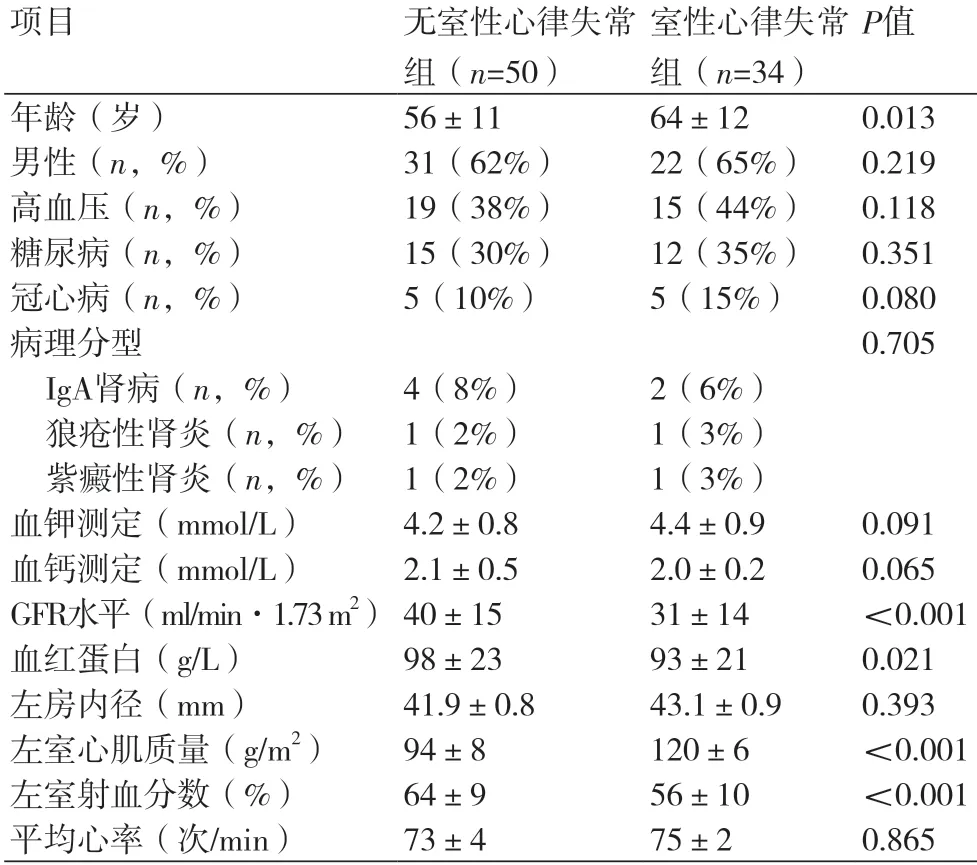
表2 两组患者基本特征的比较(±s)
项目 无室性心律失常组(n=50)室性心律失常组(n=34)P值年龄(岁) 56±11 64±12 0.013男性(n,%) 31(62%) 22(65%) 0.219高血压(n,%) 19(38%) 15(44%) 0.118糖尿病(n,%) 15(30%) 12(35%) 0.351冠心病(n,%) 5(10%) 5(15%) 0.080病理分型 0.705 IgA肾病(n,%) 4(8%) 2(6%)狼疮性肾炎(n,%) 1(2%) 1(3%)紫癜性肾炎(n,%) 1(2%) 1(3%)血钾测定(mmol/L) 4.2±0.8 4.4±0.9 0.091血钙测定(mmol/L) 2.1±0.5 2.0±0.2 0.065 GFR水平(ml/min·1.73 m2) 40±15 31±14 <0.001血红蛋白(g/L) 98±23 93±21 0.021左房内径(mm) 41.9±0.8 43.1±0.9 0.393左室心肌质量(g/m2) 94±8 120±6 <0.001左室射血分数(%) 64±9 56±10 <0.001平均心率(次/min) 73±4 75±2 0.865
逐步logistic多因素回归分析显示:年龄(OR=1.08,95%CI:1.02~1.14,P=0.004),GFR水平(OR=1.34,95%CI:1.06~1.84,P=0.021)和射血分数(OR=0.94,95%CI:0.91~0.98,P=0.008)是非透析CKD患者室性心律失常发生的独立预测因素。
3 讨论
CKD是危害人类健康、死亡率极高的一种慢性疾病,其人群患病率约为11%~13%[1]。普通人群中心源性猝死的发生率为1/1000人年,而CKD患者心源性猝死的发生率高达7.8/1000人年。既往研究显示,eGFR下降是CKD患者发生急性心肌梗死,心力衰竭,血栓栓塞性疾病和心源性猝死等心血管事件的独立危险因素[4,5]。而且,eGFR每下降10 ml/(min·1.73 m2),其猝死风险比增加1.1倍[6]。另外,透析CKD患者的猝死率高于非透析CKD患者,并且随着透析时间的增加,CKD患者的猝死风险可增加10倍[7,8]。
本研究结果显示,非透析CKD患者的心律失常主要包括房颤、室速和窦性停搏,且这三种主要心律失常的发生率随着慢性肾病程度的加重而加重。多因素回归分析发现,年龄,GFR水平和射血分数是非透析CKD患者室性心律失常发生的独立预测因素。非透析CKD患者发生心律失常的原因主要包括:心脏结构改变(如心室肥厚),心肌灶性坏死,心功能减退,自主神经功能异常等,这些因素能导致心肌电活动的不稳定性增加,心肌兴奋性和传导性异常,进而产生异位搏动和心律失常[2]。此外,代谢异常如糖代谢异常、代谢性酸中毒、高钾血症等也是发生心律失常的常见原因[9]。
病理生理学机制表明室性心律失常是由于受损心肌被局灶触发所致。在无CKD的个体中,动脉斑块破裂、局灶性心肌瘢痕或左心室射血分数减少导致的心肌缺血是室性心律失常发生的基质[10]。普通人群中,衰老与致命性室性心律失常发作密切相关[11]。同时,本研究也显示衰老是非透析CKD患者发生室速/室早的独立预测因素。这可能与衰老过程导致的心血管系统变化,如动脉粥样硬化程度增加,收缩期心室壁应力增加和心室舒张功能障碍有关[4,12]。另外,本研究还显示非透析CKD患者室性心律失常的发生与左室心肌质量及左室收缩功能异常密切相关,这也与之前的研究结果相似[4,13]。这些改变在CKD患者中非常普遍,也提示CKD患者高度具有发生室性心律失常风险。
CKD合并室性心律失常的治疗主要包括抗心律失常药物、经皮导管射频消融术(RFCA)和心脏再同步化治疗(CRT)/埋藏式心律转复除颤器(ICD)[9,14]。另外,最大限度地降低CKD患者猝死的危险因素也非常重要,这包括严格控制血压,体液平衡,血清磷酸盐,贫血和避免低血钾和高钾血症等。需要注意的是,抗心律失常药物有致心律失常作用;再加之CKD因药代动力学和药效学的变化,容易导致药物在体内蓄积,因此,使用抗心律失常药物时应非常慎重[9]。尽管缺乏大型随机对照临床研究的验证,β受体阻滞剂因能显著降低心血管死亡率和猝死风险,故被认为是CKD合并室性心律失常安全、有效的药物。其有效机制可能与减轻CKD患者左室心肌质量和减缓心力衰竭有关,且也不增加低血压的风险[9]。
综上,非透析CKD患者发生室性心律失常的风险非常高,这与衰老、GFR水平降低、左室心肌质量增加及左室收缩功能降低密切相关。在治疗上,由于存在CKD基础疾病,应慎重选择抗心律失常药物的使用。严密监测下,这些患者中应用β受体阻滞剂是相对安全的。

