组氨酸激酶基因envZ调控禽致病性大肠埃希菌生物被膜的机制研究
冯寒霜,薛 媚,卢会奇,谷 一,邵 颖,宋祥军,涂 健,祁克宗
(安徽农业大学 兽医病理生物学与疫病防控安徽省重点实验室,安徽 合肥 230036)
禽致病性大肠埃希菌(Avian pathogenicEscherichiacoli,APEC)作为禽类疾病重要的病原菌之一[1],常引起禽类呼吸道感染、心包炎、败血症、腹膜炎、肝周炎和气囊炎等[2],给家禽业造成巨大的经济损失[3-4]。二元调控系统是细菌感知和响应环境的主要手段[5-7],通常包含接收外部输入信号的传感器—组氨酸激酶和传递细菌细胞生理学变化的响应调节剂[8-11]。
envZ是构成ompR/envZ系统的组氨酸激酶基因[12-15]。在鼠伤寒沙门氏菌中envZ参与调控数百种与毒力、孔蛋白形成和鞭毛组装等相关的基因的表达[16]。在肺炎克雷伯菌中ompR/envZ是调节c-di-GMP信号通路、3型菌毛表达以及在渗透压应激下产生的生物被膜量的关键因素[17]。生物被膜通常由胞外多糖、蛋白质和核酸组成[18],可以使内部细菌逃避抗生素或机体免疫系统的作用,造成机体持续性感染或免疫性疾病。细菌从游离状态到聚集形成成熟生物被膜牵涉到复杂的调控机制[19],例如在放线杆菌中组氨酸激酶基因arcB可以感知氧化还原的生长条件并调节生物被膜的形成[20],但在APEC中envZ与生物被膜形成之间可能存在的调控联系尚不明确。本研究用Red同源重组方法构建envZ基因缺失株,对其生物被膜形成特性以及可能参与的调控通路进行研究分析,为探索APEC的生理学功能提供理论基础。
1 材料与方法
1.1 菌株、质粒
APEC菌株AE17由安徽省兽医病理生物学与疫病防控省重点实验室保存。质粒pKD3(氯霉素抗性)、pCP20(氯霉素和氨苄青霉素抗性)和pKD46(氨苄青霉素抗性)均购自Takara公司。
1.2 主要试剂和仪器
2×PCR Mix、DL2000 DNA marker、高保真PCR酶购自南京诺唯赞生物科技公司,质粒提取试剂盒购自北京天根生化科技有限公司,L−阿拉伯糖购自Sigma公司,PCR扩增仪购自美国Bio-Rad公司,凝胶成像系统购自北京新技术公司,电转化仪购自美国BTX公司。
1.3 引物设计
根据NCBI公布的envZ基因序列,利用Primer 5.0软件并结合Red同源重组原理设计envZ基因缺失引物和缺失鉴定引物(表1),引物由北京擎科新业生物技术有限公司合成。

表 1 envZ基因缺失和缺失鉴定引物Table 1 Primers used for construction and identification of envZ gene deletion
1.4 envZ基因缺失株的构建
根据Red同源重组系统原理及方法[21],将扩增的含氯霉素抗性片段的envZ基因同源臂电转化入AE17-pKD46感受态细胞中,涂布氯霉素抗性平板筛选基因缺失株。挑取单克隆菌落,PCR鉴定envZ基因是否缺失成功,若成功,则利用pCP20质粒在42 ℃环境中诱导消除pKD46,缺失成功的菌株命名为 AE17ΔenvZ。
1.5 生长曲线的测定
野生株AE17和缺失株AE17ΔenvZ培养至对数生长期,调整D600 nm=1.0,按体积比 1∶100 接种于LB培养基,37 ℃、200 r/min条件下振荡培养,每隔1 h取样并测定菌液的D600 nm,记录并绘制细菌生长曲线。
1.6 envZ缺失对生物被膜形成的影响
1.6.1 生物被膜形成能力观察 野生株AE17和缺失株AE17ΔenvZ培养至对数生长期,用经高压灭菌的LB液体培养基按体积比1∶50稀释菌液,加入到96孔聚丙烯板中,每孔200 μL,每组3次重复。28 ℃ 条件下培养 48 h 后,吸出菌液,每孔加 200 μL PBS缓冲液洗涤3遍,晾干后每孔加入200 μL 0.1%(φ)结晶紫溶液,37 ℃ 条件下染色 20 min 后用PBS缓冲液洗涤3遍,晾干。拍照留图后,每孔加入 200 μL 33%(φ)乙酸溶解 10 min,然后使用酶标仪测定D620 nm。
1.6.2 扫描电镜观察细菌生物被膜 在6孔细胞板中放入细胞爬片,加入 2 mL 菌液 (1×108CFU),在28 ℃培养箱中静置培养48 h。扫描电镜观察前处理方法如下。
1)样本制备:将培养的细胞爬片取出,用PBS缓冲液清洗3遍,晾干。
2)固定:用 2.5%(φ)戊二醛溶液固定 2 h,用PBS缓冲液清洗3遍,尽快将样本放入3%(φ)戊二醛溶液中,置于4 ℃条件下固定6 h,用PBS缓冲液漂洗3次,每次20 min。
3)梯度脱水:使用体积分数分别为50%、70%、80%、95%和100%的乙醇溶液依次处理20 min;弃去乙醇溶液后,用丙酮处理20 min,重复2次。
4)干燥:将处理好的样本浸泡在丙酮中送至安徽农业大学生物科技楼公共平台中心进行真空冷冻干燥。
5)黏台:用导电胶将干燥后的样品固定于样品台上。
6)喷金:在不导电的样品表面喷镀一层约10 nm厚的贵金属。
7)进样观察。
1.7 基于RNA-Seq技术筛选envZ缺失株差异表达基因
分别提取AE17和AE17ΔenvZ菌株的总RNA,采用琼脂糖凝胶电泳分析RNA降解程度以及是否有污染,采用Nanodrop检测RNA的纯度(D260 nm/D280 nm),采用Qubit对RNA浓度进行精确定量并采用Agilent 2100精确检测RNA完整性的方法对总RNA样品进行检测。样品检测合格后,进行文库构建,之后库检以保证文库质量。库检合格后,把不同文库按照有效浓度及目标下机数据量的需求汇集后进行HiSeq/MiSeq测序。下机数据的处理由北京诺和致源科技股份有限公司完成,参照文献[17]进行数据处理分析。以log2F的绝对值大于1且q小于0.005为标准筛选差异基因,其中,F是样本间表达量差异倍数,q为校正后的P值。
1.8 实时荧光定量PCR检测部分基因转录水平
参照文献[22-23],分别提取野生株AE17和缺失株AE17ΔenvZ的RNA,利用反转录试剂盒将RNA反转录为cDNA进行实时荧光定量PCR检测,反应体系为 20 μL:SYBRGreen PCR Master Mix 10 μL,上下游引物 (表 2)各 1 μL,cDNA 模板 2 μL,补足双蒸水至 20 μL。反应条件:95 ℃ 2 min;95 ℃5 s,60 ℃ 10 s,40 个循环。采用 2−ΔΔCT法[24]分析基因转录水平,并利用SPSS软件对RNA-Seq和实时荧光定量PCR 2种方法的结果进行相关性分析。

表 2 实时荧光定量PCR引物Table 2 Primers used in real time fluorogenic quantitative PCR
2 结果与分析
2.1 envZ基因缺失株的构建和鉴定
对AE17和AE17ΔenvZ进行PCR鉴定,结果显示,野生株可以扩增到499 bp的内侧条带和2 012 bp的外侧条带,而envZ缺失株不能扩增到相应的内侧条带,且外侧扩增到的条带为976 bp(图1),表明envZ的缺失株构建成功。

图 1 envZ基因缺失株AE17ΔenvZ的鉴定Fig.1 Identification of envZ deletion strain AE17ΔenvZ
2.2 生长曲线的测定
野生株AE17和缺失株AE17ΔenvZ的生长曲线(图2)表明,envZ基因缺失对AE17菌株在LB液体培养基中的生长性能无明显影响(P>0.05)。
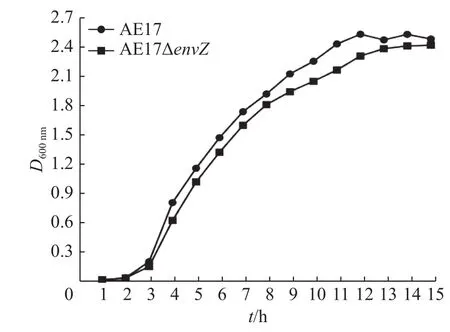
图 2 AE17和AE17ΔenvZ的生长曲线Fig.2 Growth curves of AE17 and AE17ΔenvZ
2.3 生物被膜形成能力检测
AE17和AE17ΔenvZ在96孔板中培养48 h后,利用酶标仪检测其生物被膜形成能力,结果如图3所示,envZ缺失使AE17生物被膜形成能力显著减弱(P<0.05)。结晶紫染色观察生物被膜结果如图4所示,培养48 h后,AE17ΔenvZ的生物被膜生成量比AE17显著减少(P<0.05)。
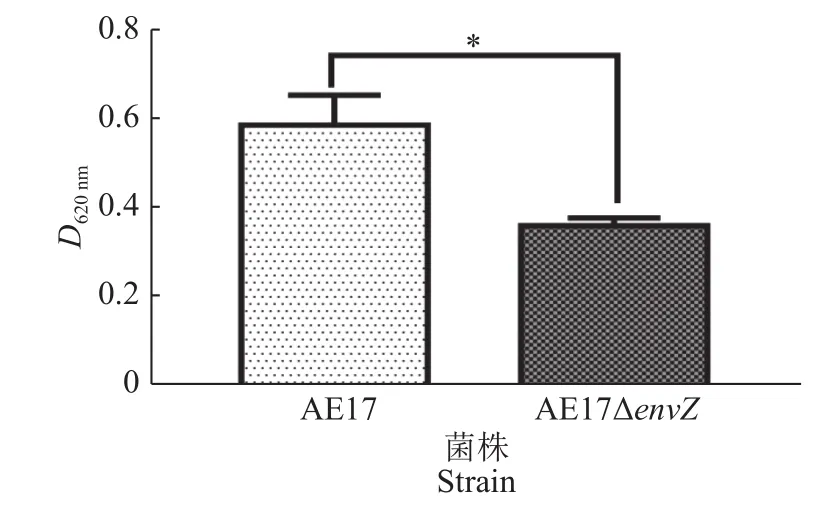
图 3 酶标仪测定AE17和AE17ΔenvZ生物被膜形成能力Fig.3 Biofilm formation abilities of AE17 and AE17ΔenvZ detected by microplate reader

图 4 培养48 h后结晶紫染色观察AE17和AE17ΔenvZ生物被膜生成量Fig.4 Biofilm formation amounts of AE17和 AE17ΔenvZ observed by crystal violet staining after 48 hours’cultivation
2.4 扫描电镜观察AE17ΔenvZ生物被膜
在6孔板中放入细胞爬片,分边加入AE17和AE17ΔenvZ在6孔板中培养,经过处理后进行扫描电镜观察,结果如图5所示。相对于野生株AE17形成的较厚的生物被膜以及菌与菌之间的紧密连接,AE17ΔenvZ生成的生物被膜比较薄且菌体之间的分布相对松散,说明缺失株AE17ΔenvZ形成生物被膜的能力减弱。
2.5 RNA-Seq测序数据分析
2.5.1 差异基因GO功能分类 共筛选到711个差异表达基因,其中,表达上调基因303个,表达下调基因408个(图6)。筛选出的差异基因GO功能分类结果(图7)显示,注释到GO数据库的差异基因共有269个,得到1 163个GO功能注释,涉及分子功能、细胞组分及生物学过程3大功能。在生物学过程方面,共发现664个功能注释,占57.1%;细胞组分方面,共发现71个功能注释,占6.1%;在分子功能方面,共发现428个功能注释,占36.8%。差异表达基因在生物学过程、细胞成分、分子功能中涉及的显著性GO功能分析以及差异基因参与情况见图7。

图 5 扫描电镜观察AE17和AE17ΔenvZ生物被膜Fig.5 Biofilms of AE17 and AE17ΔenvZ observed by scanning electron microscope

图 6 AE17ΔenvZ差异表达基因火山图Fig.6 Volcano map of AE17ΔenvZ differentially expressed genes

图 7 差异表达基因的GO功能分类Fig.7 GO functional classification of differentially expressed genes
2.5.2 生物被膜差异表达基因调控通路 大肠埃希菌中与生物被膜形成有关的基因有鞭毛蛋白合成基因、抗原43合成基因等。鞭毛相关基因如flhD、flhC、fliA和fliZ等表达下调并间接参与生物被膜形成的调控。转录组数据中参与生物被膜调控的基因变化如表3所示。
2.5.3 差异表达基因的KEGG 信号通路功能分类 KEGG信号通路结果显示,被注释的661个差异表达基因共涉及78个信号通路,主要涉及氮代谢、β−内酰胺抗性、精氨酸和脯氨酸代谢、缬氨酸和亮氨酸以及异亮氨酸的降解、乙醛酸和二羧酸酯代谢等通路。其中有6个基因参加生物被膜调控通路。差异表达基因富集KEGG功能分类以及差异基因参与情况见图8。

表 3 生物被膜相关的差异表达基因Table 3 Differentially expressed genes associated with biofilm

图 8 差异表达基因的KEGG功能分类Fig.8 KEGG functional classification of differentially expressed genes
2.6 实时荧光定量PCR验证部分基因转录水平
实时荧光定量PCR验证鞭毛基因fhlA、flhD、flhC与生物被膜基因mlrA、mcbR的转录水平与转录组学差异倍数的相关系数为0.82,是正相关关系(图9),说明转录组测序数据结果可靠,进一步证实envZ缺失在转录水平上调控与生物被膜相关的基因的表达。

图 9 差异表达基因的验证Fig.9 Verification of differentially expressed genes
3 讨论与结论
感应环境渗透压的大肠埃希菌ompR/envZ双组分调节系统由组氨酸激酶基因envZ和响应调节剂基因ompR组成[25]。其中envZ有2个跨膜螺旋,一个为周质结构域,另一个是在His-243处经历自磷酸化的细胞质结构域,envZ就是通过细胞质结构域感知渗透压的变化。转录组学是研究转录组的学科,广泛用于各物种生理生化特征以及分子调控机制的研究,可用于解析基因组与表型之间的关系[26]。本研究利用这一组学技术挖掘了envZ与生物被膜形成特性之间可能存在的调控关系,为进一步研究该基因在禽致病性大肠埃希菌中的作用[27]提供参考。
envZ基因缺失后,生物被膜形成能力减弱。结合转录组数据分析可知这一结果可能是调控生物被膜形成的基因表达下调导致的。flhD编码1类启动子,其与flhC形成转录激活物复合物FlhD4C2,决定细菌是运动还是非运动,其在帮助大肠埃希菌在较长时间内维持生物被膜的生物量方面发挥重要作用[28]。mlrA参与编码形成MerR家族转录调节剂,是csg基因激活剂,与ydaM互作,调控csgD基因表达,csgD编码LuxR家族转录调节剂,是生物被膜形成的关键调节因子。lsrR是大肠埃希菌群体感应的主要调节器,大肠埃希菌中生物被膜的数量和结构均受此独特机制调控[29]。mcbR是荚膜异多糖和生物被膜基因的转录调节因子,可通过下调生物膜相关基因bcsA、fliC、wcaF和fimA的转录而减少生物被膜的形成[30-31]。bdcA可降低c-di-GMP的浓度,进而通过降低鞭毛旋转、卷曲纤维素合成使生物被膜形成量减少[32]。tabA编码含DUF386结构域的毒素−抗毒素生物被膜蛋白,可通过抑制1型菌毛使生物被膜形成量减少[33]。
envZ不仅对APEC的生物被膜有调控作用,且更广泛地参与调控其他特殊基因及信号通路,如已知的其他的二元调控系统的组氨酸激酶基因evgS、barA,如调控新陈代谢基因,尤其是碳代谢和氮代谢。碳、氮是生物体生长的基本元素,envZ缺失后大量的代谢基因发生显著变化。本研究推测envZ可能还参与细菌能量代谢基因的调控。
本论文研究了组氨酸激酶基因envZ对APEC生物被膜形成能力的影响,并采用转录组学方法研究了envZ对生物被膜可能的调控机制,发现envZ缺失可减弱细菌成膜能力,与生物被膜形成相关的基因表达显著下调。

