大气NO2湿沉降对桑树叶片光系统的影响
夏凡育,郑美慧,李晓娜,王彦力,王 月
(东北林业大学生命科学学院,哈尔滨 150040)
0 引言

目前普遍认为NO2为一种具有一定毒性的气态大气污染物[2,4,5],但从NO2对植物生理生态的影响方面来考虑,不同浓度NO2对不同植物的影响有差异,同时植物对其的应答机制也是复杂的[13]。一些研究已经阐明,较高浓度水平的NO2对植物生理代谢有着不利影响,但一些研究同时也表明,NO2浓度的适度提高可促进植物生长[14-16]。相关试验也证明了NO2可以作为氮源参加氮代谢途径,但同时也可以作为信号分子来调控植物体的相关生理活动[16]。基于此,对于大气NO2沉降对植物的生理生态学研究不能单纯着眼于相关逆境应答机制的探索,也要针对植物对NO2的相关代谢过程做好定量与定性的深入研究。
桑树(Morusalba)系属桑科桑属落叶乔木或灌木,是一种经济效益与生态效益俱佳的优良树种[17],在我国分布广泛。桑树具有良好的温度耐受力与水分耐受力,环境适应性很强,生态幅较大,可作为先锋树种进行环境植被修复[18-19]。传统的桑树开发主要集中于纺织与中药领域,但现今对于桑树价值的开发较以往更加多元。桑叶饲料的营养价值较传统饲料更占优势[20],一些研究还发现桑叶和桑葚有调节免疫功能、抗氧化等效用,具有一定的药理活性功效[21]。因此,桑树不但具有良好的生态效益,也是我国饲料工业和食品工业中重要的原料树种、经济树种[18-22]。
一些研究已经证明,桑树对酸雨的适应性较强[23],相关报道也说明了NO2熏蒸桑树可在一定程度上促进桑树的光合与生长发育[24]。但大气氮素通过湿沉降途径对桑树产生的相关影响研究仍未深入。为研究大气NO2湿沉降对桑树叶片光合特性的影响,以黑龙江省推广的耐盐碱桑树品种“秋雨桑”为材料,以不同浓度的NH4NO3对桑树叶片进行喷施处理,并探讨NO2湿沉降逆境胁迫对桑树光合特性的相关系列影响机制,其结果可为植物对大气NO2多途径沉降的应答机制以及NO2进入植物体后的代谢过程研究提供相关数据或证据,以期为农业生产与环境评估提供一定的参考。
1 材料与方法
1.1 试验材料
试验于2019年6月—11月在东北林业大学植物生理实验室进行,供试桑树品种为黑龙江省推广种植的主栽品种——秋雨桑,种子由黑龙江省蚕业研究所提供。发芽培育后,待供试苗木生长到20 cm时,移栽到直径12 cm、高15 cm的培养钵中。为保证试验材料的相对一致性,在移植时去掉桑树幼苗分支和叶片,只保留主根和主茎各5 cm。每钵定植2株,共计60株。培养基质由草炭土和蛭石均匀混合而成,待供试苗木生长到30~40 cm时,选用长势一致的桑树幼苗进行模拟NO2湿沉降处理。
1.2 试验方法
为模拟NO2湿沉降,取NH4NO3[10,25]溶于水。根据相关研究[26],本试验设置3个氮沉降梯度[26],分别为20 mmol/L(D20)、35 mmol/L(D35)、50 mmol/L(D50),另以清水对照组(CK)。为排除NO2湿沉降对桑树根系的影响,在喷施时用塑料布将盆体上层浮土覆盖,以减少根系吸收。考虑到气孔分布因素,同时对桑叶片正反面喷施酸雨,直到重度胁迫处理叶片出现病症时开始检测各指标项目。每个处理梯度设置5次重复。
1.3 测定项目及方法
利用M-PEA型植物效率仪(Hansatech,英国生产)测定30 min暗适应后的桑树幼苗叶片第3片完全展开叶片的叶绿素荧光动力学曲线(OJIP曲线)和820 nm光吸收曲线。在OJIP曲线测定过程中,诱导光强为3 000 μmol·m-2·s-1的脉冲红光。从10 μs开始记录相对荧光强度(Fv),至2 s结束,其中曲线上O、J、I和P点分别表示当时间为0、2、30和1 000 ms时曲线上对应的点。参照Stasser[27]的计算方法进行JIP-test分析,测定PSⅡ最大光化学效率(Fv/Fm)、PSⅡ潜在光化学活性(Fv/Fo)、光能吸收性能参数(PIABS)、PSII受体侧QA的积累(VJ)、PQ 库的异质性(VI)、QA氧化还原次数(N)、光化学反应集聚能量 (ABS/RC)、QA氧化还原反应消耗能量 (TRo/RC)、光化学反应中心捕获的用于电子传递能量 (ETo/RC)、光化学反应消耗能量 (DIo/RC)和单位面积有活性的反应中心数目(RC/CSm)。PSⅠ反应中心活性通过820 nm光吸收的最大值(Io)与最小值(Im)差值的相对值来表示,即△I/Io=(Io-Im)/Io。
1.4 数据分析
运用Microsoft Excel(2010)和DPS(7.05)软件进行数据统计分析,使用单因素方差分析(One-way ANOVA)和最小显著差异分析(LSD)方法进行数据组间的差异分析。
2 结果与分析
2.1 不同浓度NO2湿沉降对桑树叶片OJIP曲线的影响
在不同浓度梯度处理下,桑树叶片OJIP曲线形态发生了较为明显的变化。在O点,各组的相对荧光强度变化并未出现显著性差异,但在分析各组J点、I点和P点时,不同的浓度,组间变化非常明显,其中I点和P点变化较为显著。定量分析发现:D20组的J点、I点和P点3点皆高于CK组;D35组的J点、I点和P点3点皆低于CK组;D50组的J点、I点和P点同样均低于CK组,但较D35的3点明显处于相对更低的荧光水平。

图1 不同浓度NO2湿沉降对桑树叶片OJIP曲线的影响Fig.1 Effects of different concentrations of NO2 wet deposition on OJIP curves of mulberry leaves
2.2 不同浓度NO2湿沉降对桑树叶片PSI活性参数ΔI/Io的影响
从图2可以明显看出,不同处理组的820 nm光吸收值差异明显,即PSI活性参数变化较为明显。在低浓度处理下,叶片PSI活性较CK明显提高,D20组的ΔI/I0值明显高于对照组(CK),幅度较比CK增长了36%(P<0.01)。而在高浓度处理下,D35、D50组的PSⅠ最大氧化还原能力均低于CK,且在所设置的最高浓度组D50组中下降最为显著,两组中D35组较CK下降幅度为21.8%(P<0.01)、D50组较CK下降幅度为40%(P<0.01)。在高浓度NO2湿沉降处理下,植物叶片光系统的PSⅠ活性受到了一定程度的抑制,但相对于两个高浓度处理组,在低浓度NO2湿沉降处理下,植物叶片的PSⅠ活性明显受到了促进。

图2 不同浓度NO2湿沉降对桑树叶片PSI活性参数ΔI/Io的影响Fig.2 Effects of wet deposition of different concentrations of NO2 on PSI activity parameters ΔI/Io of mulberry leaves
2.3 不同浓度NO2湿沉降对桑树叶片Fv/Fm、Fv/Fo、Fo/Fm和PIABS的影响
图3表明,在经过NO2湿沉降处理后的桑树叶片上,其Fv/Fm、Fv/Fo、Fo/Fm、PIABS发生了一定程度的变化。与CK相比,D20处理组的Fv/Fm、Fv/Fo、PIABS3个参数各增长了4.2%(P>0.05)、16.2%(P<0.01)和78.8%(P<0.01),而两个高浓度处理组的Fv/Fm、Fv/Fo、PIABS3个参数均低于CK组,且D50组下降程度明显高于D35组,可以看出Fv/Fo、PIABS变化程度较为显著,Fv/Fm同样产生变化,但整体幅度并不明显。上述变化反映了叶片PSⅡ的光化学活性受到了抑制,从而抑制了光化学反应,降低了PSII最初光能转换效率以及电子传递速率,导致原初反应受到抑制,说明低浓度NO2湿沉降处理对PSⅡ反应中心活性具有促进作用,但在相对高浓度时,抑制了反应中心活性。
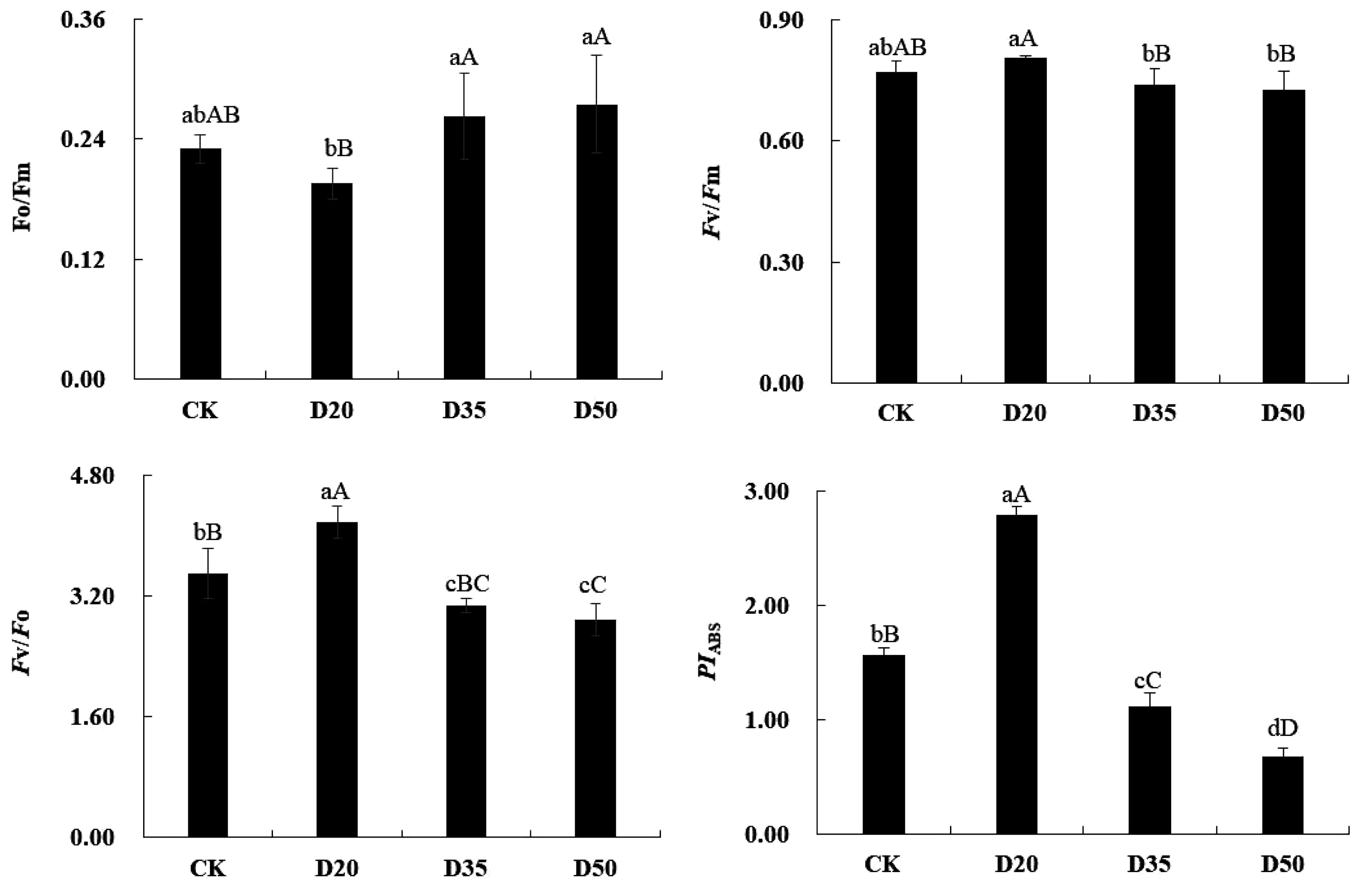
图3 不同浓度NO2湿沉降对桑树叶片Fv/Fm、Fv/Fo、Fo/Fm、PIABS的影响Fig.3 Effects of different concentrations of NO2 wet deposition on Fv/Fm,Fv/Fo,Fo/Fm and PIABS of mulberry leaves
2.4 不同浓度NO2湿沉降对桑树叶片Area、VJ、VI、Sm、N的影响
Area可代表PSⅡ受体侧PQ库对电子接受能力的大小,各组材料的电子接受能力为D20>CK>D35>D50。VJ在不同浓度处理下所表现出的变化不同。高浓度处理相对于CK抑制了反应中心的开放,但低浓度下有效促进了反应中心的开放程度。VI代表电子经过QB时的能量耗散比率,由图4可知,只有D35组相较于CK上升了3.7%(P>0.05),而其他两个处理组皆低于对照组。Sm表示质体醌库大小,可以看出随着处理浓度的提高,整体质体醌库大小随浓度呈现正比例关系,D50>D35>D20>CK,N的变化较为明显,随着处理浓度的增加,各组均呈现高于CK对照组的情况,其中D50>D35>D20>CK。

图4 不同浓度NO2湿沉降对桑树叶片Area、VJ、VI、Sm、N的影响Fig.4 Effects of different concentrations of NO2 wet deposition on Area,VJ,VI,Sm and N of mulberry leaves
2.5 不同浓度NO2湿沉降对桑树叶片ABS/RC、DIo/RC、TRo/RC、ETo/RC的影响
ABS/RC、DIo/RC、TRo/RC、ETo/RC是4个重要的单位反应中心比活性参数。图5表明,经NO2湿沉降处理后的桑树叶片QA处于可还原态时,PSⅡ反应中心传递情况随湿沉降处理浓度的改变同样产生了变化。低浓度水平下,单位反应中心吸收的光能(ABS/RC)、用于还原QA的能量(TRo/RC)、用于电子传递的能量(ETo/RC)及耗散的能量(DIo/RC)均变小,而在高浓度水平下,各部分捕获或耗散的能量较低浓度处理组开始升高,其中除ETo/RC外,普遍高于CK。低浓度D20组的ABS/RC、DIo/RC、TRo/RC、ETo/RC较CK数据水平分别降低了34.1% (P<0.01)、42.0% (P<0.01)、30.4%(P<0.01)、20.6%(P<0.01)。而高浓度组的相关数据较D20组显著升高,并且随着处理浓度的加大,能量流参数值升高程度也随之提升,普遍呈现出D50>D35>D20的情况。

图5 不同浓度NO2湿沉降对桑树叶片ABS/RC、DIo/RC、TRo/RC、ETo/RC的影响Fig.5 Effects of different concentrations of NO2 wet deposition on ABS/RC,DIo/RC,TRo/RC and ETo/RC of mulberry leaves
3 讨论
通过整个试验发现NO2湿沉降处理下NO2处理浓度与叶片光合特性的关系,在相对低浓度处理时呈现促进光合现象,在相对高浓度处理时呈现抑制光合现象。
叶绿素荧光与植物的原初反应关系密切,为了解植物PSⅡ原初反应相关情况,对样品进行了快速叶绿素荧光诱导动力学曲线(OJIP曲线)及JIP-Test分析[28]。通过OJIP曲线形状可以看出,曲线形状在不同浓度处理下发生的变化较为显著,PSII的结构和功能受到了不同处理条件的影响。整体来看,较比CK曲线,在低浓度湿沉降处理下,20 mmol/L(D20)处理组有相对更高的曲线,说明植物叶片的原初反应呈现更加活跃的趋势,这与刘会芳等人[29]的结果类似。而在高浓度处理时,整体原初反应受到抑制,这与王月等人[23]和胡月等人[30]的试验结果较为相似。在Fv/Fm、Fv/Fo、Fo/Fm等数据中,样品的整体最大光化学效率浮动幅度并不明显,这表明了光系统II 反应中心的先增进活性再抑制活性的过程。Vj反映了PSII有活性反应中心的关闭程度,与对照植物相比,低浓度下Vj明显下降,可初步证明PSII反应中心的活性和反应中心的开放程度得到了加强,这一点亦可从OJIP曲线J点前部分得到证明。D20组具有更小的荧光信号,反应中心的开放促进了叶片的电子传输,从而加速了NADPH和ATP的合成以及转化。胡彦波等人对杨树研究发现[31],高浓度NO2熏蒸所模拟的NO2干沉降处理抑制了叶片的最大光化学效率。而本试验中,随着处理浓度加大,不同浓度处理组的性能指数PIABS表现不同,低浓度处理组(D20)的性能指数和CK相比提高,而高浓度处理组的性能指数相对于对照组明显下降,可见高浓度湿沉降处理下的桑树的光合性能明显受到了抑制。
一般认为,植物在逆境情况下,其光系统会产生不同程度的光抑制[32-33],而在光系统Ⅰ中,PSⅠ最大氧化还原能力是目前经常用来讨论PSⅠ功能活性的重要参数[34-35]。王帅等人发现,在氮肥施加下,可以提高玉米的PS1活性参数ΔI/I0,但高浓度的效果差于低浓度[36]。在本试验中可以看到,PSⅠ的功能活性呈现低浓度促进、高浓度抑制的趋势,高浓度的处理会造成反应中心的功能性衰减。PSⅠ和PSⅡ之间存在着连续性作用[37],相关研究也证实了PSⅠ的活性受PSⅡ影响较大[37],且有研究表明PSⅡ活性下降时,PSⅠ的光抑制现象可以得到缓解[38]。但本试验中,低浓度组的PSⅠ活性仍呈高位,说明低浓度处理组在电子传递增加的情况下,处理条件增强了PSⅠ反应中心的功能活性。而在高浓度处理时,尽管电子传递能力变弱,但PSⅠ的反应中心却产生了损伤,导致最大氧化还原能力下降。
ABS/RC、TRo/RC、DIo/RC、ETo/RC是反应中心比活性参数,可以用来讨论反应中心能量流的大小[28]。其中,整体呈现出低浓度组低于对照,而高浓度区间高于对照且呈现正比例关系。低浓度组下各项指标的下降原因,结合活性参数分析,该浓度下整体光合效率较比CK得到了提升,而在光系统活性与开放程度皆得到提升的情况下,吸收的光能更多地用于光合作用,所以使得整个系统呈现出一种低耗能高效率的运行状态;而高浓度组则恰恰相反,整体光系统的活性与光合效率由于受到反应中心功能活性的抑制或破坏,同时也存在着与碳同化产生竞争性抑制的可能,故呈现出高耗能低效率的能量利用情况。
模拟NO2湿沉降对电子传递情况也产生了显著影响。在Vj与Vi上升时,电子传递链中电子传递受阻[39];PSⅡ电子链受体侧的变化可以在Area中反映出来[40-41],但Area的变化却呈现低浓度高水平。而高浓度低水平的现象;PIABS光合系统性能指数既可以反映原初光化学量子产额,也可反映出反应中心的密度、电子在PSI和PSII间的传递情况以及光系统的活性。很多时候,当Fv/Fm未出现明显波动时,PI参数已经发生很大变化[42]。可以看到,Sm(质体醌库)随浓度不断升高;N,即QA周转次数的变化呈现先低后高的态势;高浓度处理下的PS I和PS II间的电子传递显著降低,这说明了电子传递链的受体侧已经出现抑制甚至破坏现象。
4 结论
本试验说明了大气NO2湿沉降对桑树叶片光合特性的影响非常明显,但不同浓度的湿沉降对植物的影响效应不同。在低浓度下呈现出促进光合的现象,主要因低浓度湿沉降处理条件促进了光系统Ⅰ和光系统Ⅱ的活性以及反应中心的开放程度,而在高浓度下则导致抑制光合现象的出现,这是由于反应中心活性受到抑制、光合反应中心开放程度减小、电子链传递能力降低所导致。可以初步证明,大气NO2湿沉降对桑树的光合特性具有高抑制、低促进的两重性。

