奶牛临床型乳房炎中血红素氧合酶/一氧化碳(HO/CO)作用探究
尹福,张全伟,张博皓,白旭,石军,马友记,张勇1,,赵兴绪1,
(1.甘肃农业大学动物医学院,甘肃 兰州 730070;2 甘肃农业大学生命科学技术学院,甘肃 兰州 730070;3.甘肃动物生殖生理及繁殖调控重点实验室,甘肃 兰州 730070;4 甘肃农业大学动物科学技术学院,甘肃 兰州 730070)
奶牛乳房炎(mastitis)是由微生物感染、理化和机械等刺激因素造成的奶牛乳腺间质或实质局部炎症性疾病[1-2].按照奶牛临床表现可将乳房炎分为临床型和亚临床型(通常称为隐性乳房炎)[3].患临床型乳房炎的奶牛具有典型的“红热肿胀”等明显临床表现,严重者导致泌乳量减少或无奶[4].目前兽医临床上多采用抗生素疗法进行乳房炎治疗并取得了较好的效果[5].抗生素可增强奶牛免疫力和抑制炎症反应从而达到治疗乳房炎的效果.但自2018年起,我国正式启动实施兽用抗菌药使用减量化和饲料“禁抗”养殖“减抗、限抗”等政策[6].抗生素用于奶牛乳房炎防治明显受限.因此,筛选和开发奶牛乳房炎防治的替抗产品已成为当前兽医临床研究的重点.
血红素氧合酶(heme oxygenase,HO)/一氧化碳(carbon monoxide,CO)系统在动物和人体内发挥抗炎、抗氧化、氧化应激保护、抑制细胞凋亡等作用[7-10].血红素在NADPH及细胞色素还原酶的作用下被降解产生一氧化碳、胆绿素和铁蛋白[11-12],胆绿素经胆绿素还原酶作用生成具有抗氧化作用的胆红素,共同构成HO/CO系统[13].HO催化降解血红素是产生内源性CO的主要途径[14],而内源性CO是机体内一种重要调节作用的气体信号分子.研究表明血红素氧合酶有诱导型血红素氧合酶(HMOX1)、结构型血红素氧合酶(HMOX2)、血红素氧合酶(HMOX3)三种同工酶.HMOX1又称为热休克蛋白32,其发挥细胞保护、减轻炎症反应等作用[11,15].Yu等[16]研究脂多糖诱导的大鼠急性肺损伤机制中发现HMOX1表达上调可发挥保护作用.大鼠缺血-再灌注损伤模型中,氯化血红素诱导HO-1过表达可降低肝硬化大鼠的氧化应激、细胞凋亡和炎症反应[17-18].HMOX2主要参与血红素的稳态调节,调控机体抗胁迫(如低氧)代谢[19].Han等[20]研究表明HMOX2通过降解血红素调节小鼠肝脏缺氧损伤.HMOX3与HMOX2组成及结构类似,但具体功能和作用机制尚不清楚.
HO/CO系统相关研究主要集中在心血管疾病、肺、肝脏、肠损伤等[9-10,21].乳房炎发生和发展过程中HO/CO系统是否参与其调控,目前尚不清楚.为探讨HO/CO系统在奶牛临床型乳房炎发病过程的调控机制,本研究以健康奶牛(对照组)和患临床型乳房炎奶牛乳腺组织为研究对象,检测乳腺组织中内源性CO、HMOX1和HMOX2基因和蛋白的表达特点和表达规律.探究HO/CO系统在奶牛临床型乳房炎发病过程的作用,以期为基于气体信号分子开发奶牛乳房炎防治的替抗产品提供参考.
1 材料与方法
1.1 试验材料
本试验所用奶牛以兽医临床症状和兰州乳房炎检验法(Lanzhou Mastitis Test,LMT)为判断奶牛乳房健康与否的标准.采集泌乳期健康荷斯坦奶牛(正常组,Control,n=3)和患临床型乳房炎荷斯坦奶牛(试验组,Mastitis,n=3)的乳腺组织,部分组织置于4%多聚甲醛溶液固定,部分组织置于液氮冷冻保存备用.
1.2 试验方法
1.2.1 内源性一氧化碳(CO)测定 取液氮冷冻保存的乳腺组织100 mg,生理盐水制备10%组织匀浆液,2 500 r/min离心10 min取上清,根据内源性一氧化碳(CO)试剂盒(测组织)操作说明(A101-2-1),采用分光光度计法,检测各组乳腺组织中碳氧血红蛋白浓度(HbCO%)、血红蛋白(Hb)含量、蛋白含量和内源性一氧化碳(CO)含量.
1.2.2 总RNA的提取及cDNA的合成 取100 mg乳腺组织,经液氮迅速研磨后,按照TransZol UP RNA提取试剂盒(北京全式金生物公司)操作说明[22],提取各组乳腺组织总RNA,超微量核酸测定仪测定其总RNA浓度和纯度,根据测定结果,统一调至700 ng/mL,按Evo-MLV反转录试剂盒II(AG艾克瑞生物)操作说明合成cDNA,产物于-20 ℃保存备用.
1.2.3 引物设计 根据NCBI数据库中牛GAPDH基因(NM_001034034.2),HMOX1基因(NM_001014912.1)及HMOX2基因(NM_001035087.2)CDS序列,使用Primer Premier 3.0设计各基因的特异性引物,引物由西安擎科泽西生物科技有限责任公司合成(表1).

表1 引物序列信息
1.2.4 荧光定量PCR 以cDNA为模板,GAPDH为内参,进行PCR扩增反应,反应体系20 μL:包括2×SYBR Green ProTaqHS Premix *6 10 μL,上下游引物各0.5 μL,cDNA 1 μL,RNase free water 8 μL.PCR反应程序采用两步法:95 ℃ 30 s;95 ℃ 5 s;58 ℃ 30 s;共40个循环.每个样本重复3次,待反应结束,观察扩增曲线和溶解曲线,采集Ct值.采用2-ΔΔCt法[23]分析基因的表达量.
1.2.5 免疫印迹 称取各组乳腺组织100 mg,经液氮充分研磨后,加入1 mL含1%苯甲基黄酰氟(phenylmethyl sulfonyl fluoride,PMSF)和蛋白酶抑制剂(protease inhibitor mixture,PIC)的高效细胞组织裂解缓冲液(radio immunoprecipitation assay buffer,RIPA),4 ℃裂解30 min,12 000 r/min、离心取上清液.BCA蛋白浓度测定试剂盒(碧云天生物技术有限公司)测定各个样本蛋白浓度,取适量蛋白与5×蛋白上样缓冲液混合,100 ℃变性10 min后,于-20 ℃保存备用[24].每孔总蛋白上样30 μg,经5% SDS-PAGE浓缩胶和12%分离胶电泳分离蛋白,湿转,封闭后,加兔源β-actin一抗(1∶4 000)、HMOX1一抗(1∶500)和HMOX2一抗(1∶600)(抗体均购自北京博奥森生物技术有限公司),4 ℃孵育过夜,辣根过氧化物酶 (horseradish peroxidase,HRP)标记的羊抗兔 IgG (1∶5 000)、 (1∶8 000),37 ℃ 50 r/min孵育1 h,加底物化学发光液(electronchemi-luminescence,ECL)发光显色 、化学发光仪曝光.Image J软件扫描HMOX1、HMOX2 和内参β-actin蛋白灰度值,每个条带重复3 次后进行数据分析.
1.2.6 苏木精-伊红染色及免疫组织化学染色 苏木精-伊红染色(hematoxylin-eosin staining,H&E):将固定好的乳腺组织包埋,制备石蜡切片厚度为4~5 μm,经脱蜡、苏木素染色、伊红复染、树胶封片后,镜下摄片并分析数据.免疫组织化学染色(immunohistochemistry,IHC):组织切片60 ℃烘3 h,二甲苯脱蜡,梯度酒精水化,抗原修复.按照免疫组化试剂盒说明书[25],依次加3% H2O2,室温10 min,封闭液(A 液)室温30 min、兔源HMOX1一抗(1∶200)、兔源HMOX2一抗(1∶240),阴性对照加磷酸盐缓冲液,4 ℃过夜孵育、试剂B 和试剂C孵育30 min、DAB 显色、苏木素复染、1%盐酸酒精分化、流水冲洗返蓝、梯度酒精脱水,二甲苯透明,树胶封片,使用Olympus Dp71生物显微镜摄像[26].
1.3 统计学分析
2 结果与分析
2.1 奶牛临床型乳房炎乳腺组织中内源性一氧化碳(CO)的含量
两组乳腺组织中碳氧血红蛋白浓度、血红蛋白含量、蛋白含量以及内源性CO含量均有差异(图1),与正常组相比较,临床型乳房炎乳腺组织中碳氧血红蛋白浓度降低(图1-A);血红蛋白含量降低(图1-B);蛋白含量升高(图1-C);内源性CO含量上调,显著高于正常组(P<0.01)(图1-D).
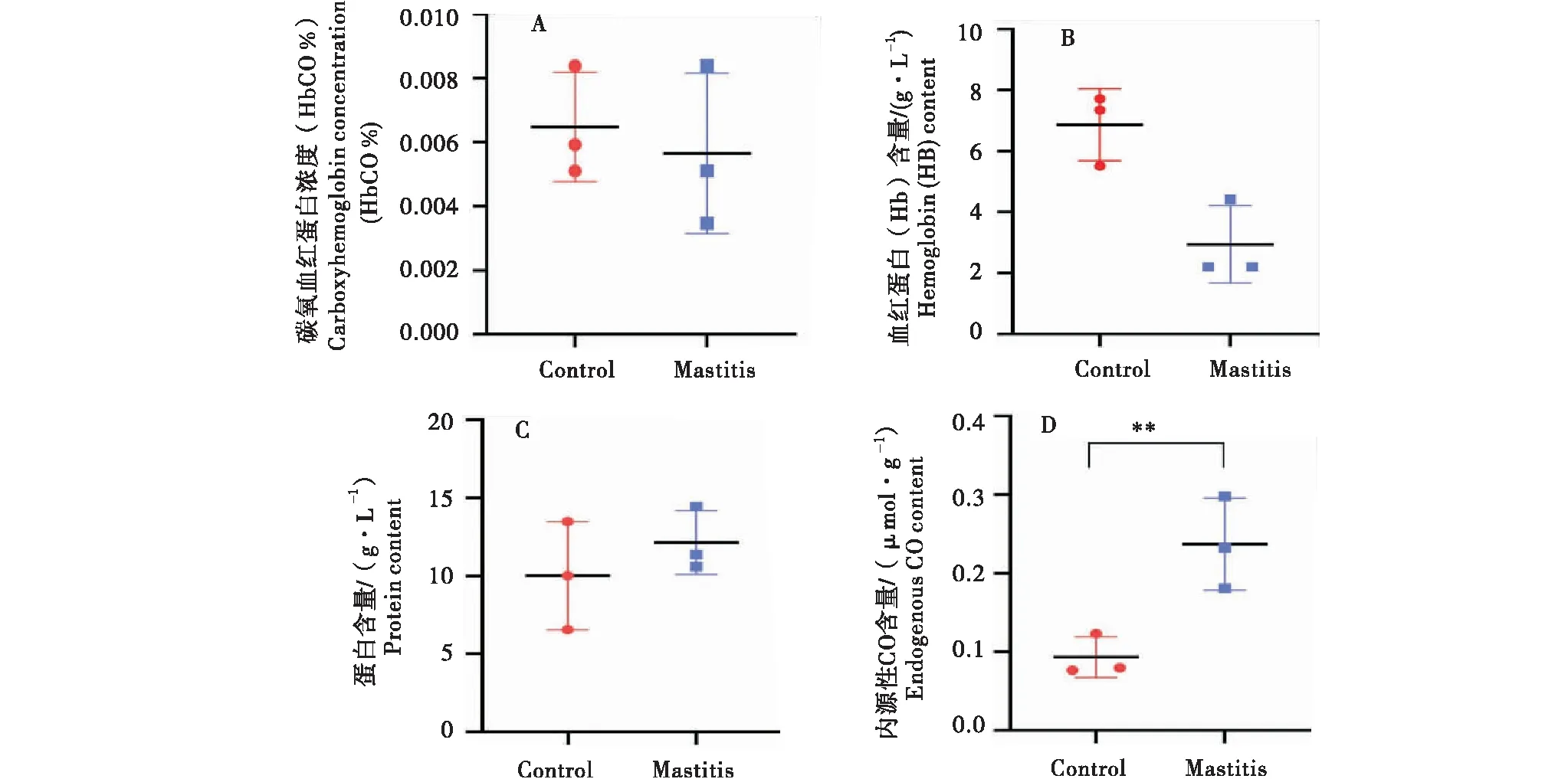
A:碳氧血红蛋白浓度(HbCO%);B:血红蛋白(Hb)含量;C:蛋白含量(g·L-1);D:内源性CO含量(μmol·g-1).A:Carboxyhemoglobin concentration (HbCO%);B:Hemoglobin (HB) content;C:Protein content (g/L);D:Endogenous CO content (μmol/g).图1 奶牛临床型乳房炎乳腺组织中的内源性一氧化碳(CO)含量Figure 1 Content of endogenous carbon monoxide (CO) in mammary gland tissue of dairy cows with clinical mastitis
2.2 奶牛临床型乳房炎乳腺组织病理形态观察
经H&E染色后观察两组乳腺组织的病理变化(图2),结果发现,正常组乳腺组织无病理变化,各结构完整,上皮细胞排列有序,腺泡充盈,内有大量乳汁,处于泌乳期(图2-A);患临床型乳房炎奶牛乳腺组织呈现典型的病理形态如乳腺结构模糊,腺泡腔塌陷、变形,部分上皮细胞脱落,腔内含有大量白细胞,其中又以噬中性粒细胞居多(图2-B).
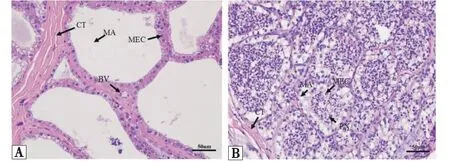
A:正常组;B:临床型乳房炎组;CT:结缔组织;MA:乳腺腺泡;BV:血管;MEC:乳腺上皮细胞;PN:噬中性粒细胞.A:Control group;B:Clinical mastitis group;CT:connective tissue;MA:mammary gland acinus;BV:blood vessel;MEC:mammary epithelial cells;PN:phagocytic neutrophils.图2 奶牛临床型乳房炎乳腺组织病理形态观察(H&E染色)Figure 2 Histopathological observation of mammary gland in dairy cows with clinical mastitis (H&E staining)
2.3 奶牛临床型乳房炎乳腺组织中HMOX1和HMOX2蛋白表达定位
两组乳腺组织中均可见HMOX1和HMOX2蛋白(棕黄色颗粒)的表达(图3).正常组乳腺组织结构完整(图Control),临床型乳房炎组可见明显乳腺组织病变(图Mastitis).
HMOX1和HMOX2蛋白在乳腺组织均有表达,主要在乳腺上皮有阳性表达,临床型乳房炎组和正常组相比,HMOX1蛋白相对表达量增加(图3-A3),HMOX2蛋白相对表达量下降(图3-B3).
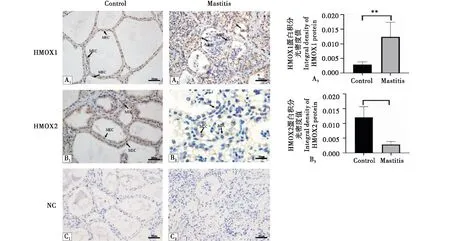
A:HMOX1蛋白表达分布;B:HMOX2蛋白表达分布;C:阴性对照组;1为正常组;2为临床型乳房炎组;箭头表示阳性表达,MEC:乳腺上皮细胞.A:HMOX1 protein expression and distribution;B:Hmox2 protein expression distribution;C:Negative control group;1 as normal group;2 for clinical mastitis group;The arrow indicates positive expression,MEC:mammary epithelial cells.图3 奶牛临床型乳房炎乳腺中HMOX1和HMOX2蛋白定位表达Figure 3 Expression of HMOX1 and HMOX2 in mammary glands of dairy cows with clinical mastitis
2.4 奶牛临床型乳房炎乳腺组织中HMOX1和HMOX2 mRNA表达规律
两组乳腺组织中均有HMOX1和HMOX2mRNA表达(图4).与正常组中目的基因HMOX1和HMOX2表达量相比较,试验组中HMOX1显著上调,差异极显著(图4-A)(P<0.01);相反,试验组中HMOX2表达量显著下调,差异极显著(图4-B)(P<0.01),且HMOX1的差异表达倍数远高于HMOX2.
2.5 临床型乳房炎奶牛乳腺组织中HMOX1和HMOX2蛋白的表达规律
两组乳腺组织中均有HMOX1和HMOX2蛋白表达(图5).与正常组相比较,试验组中HMOX1表达量明显上调(图5-A和5-B),而HMOX2表达量明显下调(图5-A和5-C),均存在显著性差异(P<0.05).HMOX1和HMOX2在组内也存在一定的差异.
3 讨论
血红素氧合酶(HMOX)催化血红素降解生成CO、胆红素和铁蛋白,内源性CO作为内源性气体信号分子参与和调节许多细胞内的生化反应,进而调节生理功能,在不同细胞起到抗炎、抗凋亡、抗氧化应激和扩张血管等作用[8].目前研究发现,HO/CO系统与临床疾病的发生、发展及转移等过程密切相关,并且在不同病变组织中差异表达.Ibrahim等[27]通过氯化血红素诱导血红素加氧酶(HMOX)活性改变内源性一氧化碳(CO)生成,发现可以明显减轻大鼠胃粘膜损伤;胡修忠等[28]通过建立H2O2诱导牛子宫内膜上皮细胞损伤模型后,发现HMOX1表达量升高,对牛子宫内膜上皮细胞存在调控作用,降低氧化应激对细胞的损伤;王云涛等[29]在切口痛大鼠模型中发现HMOX1蛋白表达增加,可降低炎症因子释放,减轻炎症反应的破坏,发挥细胞的保护作用.本研究首先通过测定内源性CO含量发现临床型乳房炎乳腺组织中内源性CO明显高于正常组,再通过qRT-PCR、Western blot技术发现HMOX1 mRNA和蛋白表达显著上调,这可能是由于乳腺组织在病变过程中巨噬细胞参与免疫,释放出多种细胞趋化因子产生诱导HMOX1表达的产物,如炎症因子、内毒素等,诱导HMOX1表达,催化反应生成CO,说明HO/CO对乳房炎发病过程中具有重要作用.近年来研究发现HMOX2是血红素氧感受器[19],HMOX2通过自身降解来响应细胞血红素缺乏,帮助恢复血红素的动态平衡[30].本研究发现HMOX2 mRNA和蛋白在患临床型乳房炎乳腺组织中表达量较正常组显著下降,HMOX2可能通过自身表达调控,在HO/CO中发挥作用.HMOX1广泛分布于脾脏、肝脏和骨髓等代谢活跃的器官;HMOX2主要分布于脑内,在血管平滑肌和内皮细胞也有表达[13].本研究通过免疫组织化学染色观察到HMOX1蛋白和HMOX2蛋白在乳腺组织均表达,与mRNA呈正相关,且阳性表达主要分布在乳腺上皮细胞,保护损伤的细胞,更进一步说明HO/CO对维持乳腺组织生理起重要的作用.HMOX1和HMOX2两种同工酶活性一增一减,调节内源性CO含量,共同调节乳腺组织生理功能,发挥其保护作用.综上所述,内源性CO、HMOX1、HMOX2与其蛋白在对照组和患临床型乳房炎奶牛乳腺组织中均表达且表达趋势存在差异,HO/CO系统参与细菌性奶牛临床型乳房炎的发生与发展,其可能调控乳腺上皮细胞的功能,发挥抗炎和细胞损伤保护等作用.这将为奶牛临床型乳房炎及相关疾病中HO/CO系统功能的研究提供理论参考,也为开发奶牛乳房炎防治的替抗产品提供参考依据.
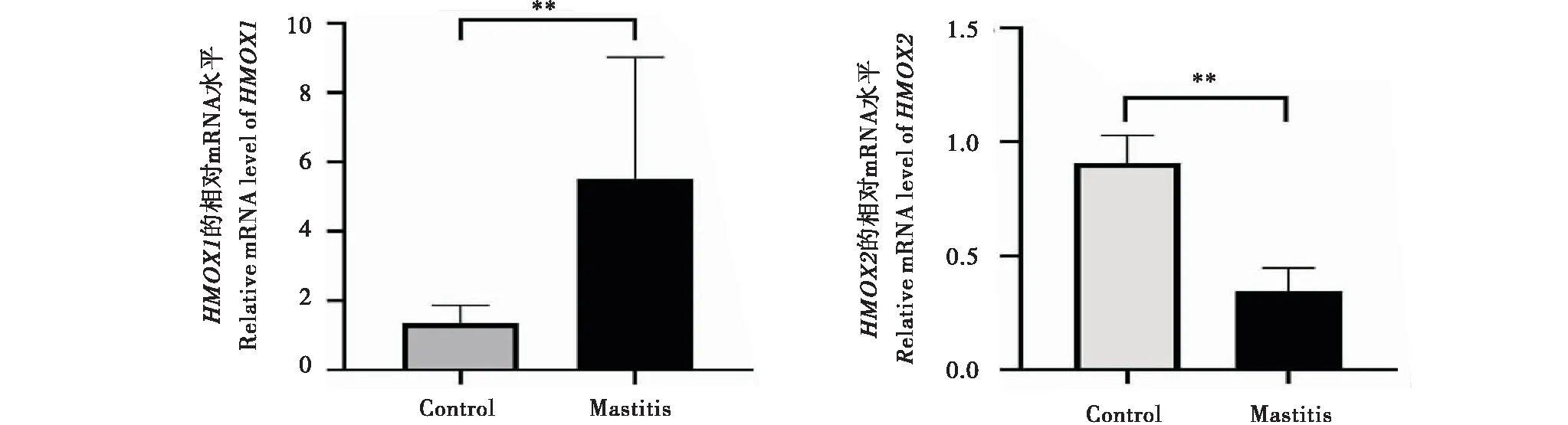
A:HMOX1 的相对mRNA 水平;B:HMOX1的相对mRNA水平(内参基因:GAPDH;n=3).**表示差异极显著(P<0.01).A:The relative mRNA level of HMOX1;B:The relative mRNA level of HMOX1 (internal reference gene:GAPDH;n=3).** The difference was very significant(P<0.01).图4 奶牛乳腺组织中HMOX1和HMOX2 mRNA表达规律Figure 4 Expression of HMOX1 and HMOX2 mRNA in mammary gland of dairy cows
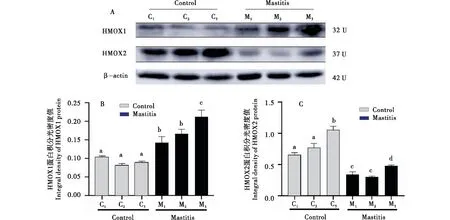
A:乳腺组织中HMOX1和HMOX2蛋白Western blot结果;B:HMOX1蛋白的相对表达量;C:蛋白的相对表达量 (内参:β-actin 蛋白;n=3).相同字母表示无差异,不同字母表示差异显著(P<0.05).A:HMOX1 and HMOX2 protein in breast tissue were detected by Western blot;B:The relative expression of HMOX1 protein;C:The relative expression of protein (internal reference gene:β-actin protein;n=3).There was no difference in the same letters,but significant difference in different letters(P<0.05).图5 奶牛临床型乳房炎乳腺组织中HMOX1和HMOX2蛋白的表达规律Figure 5 Expression of HMOX1 and HOMX2 protein in breast tissue of dairy cows with clinical mastitis

