《中国药典》在临床用药安全中发挥的保障作用
洪小栩
(国家药典委员会,北京 100061)
1 引言
2020年6月24日,国家药品监督管理局与国家卫生健康委员会联合颁布了2020年版《中华人民共和国药典》(以下简称《中国药典》)[1],并于2020年12月30日起正式实施。2020年版《中国药典》是新中国成立以来的第十一版药典。其编制工作认真贯彻“最严谨的标准”要求、紧跟国际药品标准发展趋势,对标国际先进标准,兼顾我国药品生产实际。不断完善药品质量控制理念,加强国家药品标准体系建设,对药品全程质量控制进行了强化,从整体上提升了我国药品的质量。在保证《中国药典》科学性、先进性、实用性、规范性的同时,通过药典品种的收载、通用性技术要求的完善、先进分析检验技术的应用、检测项目和限量的设置、相关技术指导原则的制定,进一步发挥药典标准对药品质量控制的前瞻性和导向性作用。2020年版《中国药典》的颁布实施对整体提升我国药品标准、进一步保证药品质量、保障公众用药安全、促进我国医药产业健康发展,产生积极而深远的影响。
2 《中国药典》的作用
国家药品标准,是国家为保证药品质量对药品的质量指标、检验方法等作出的强制性技术规定。新修订的《中华人民共和国药品管理法》[2]进一步强化了国家药品标准的法定性作用,指出“国务院药品监督管理部门颁布的《中华人民共和国药典》和药品标准为国家药品标准”。2020年7月1日正式实施的《药品注册管理办法》[3]中也明确规定“药品注册标准应当符合《中华人民共和国药典》通用技术要求,不得低于《中华人民共和国药典》的规定”。《中国药典》是国家药品标准的重要组成部分,是国家药品标准体系的核心,是药品生产经营者的基本遵循,是药品监督管理工作的准绳。
药典是药品科学技术发展成果的结晶,是一个国家药品产业发展水平的标志。一个国家有没有本国药典、能不能独立制定药典,是衡量其药品监管机构能力的体现。世界各国高度重视药品标准的制定。目前,世界共有49个国际性、区域性及国家的药典机构,遍布全球41个国家。世界卫生组织(WHO)是唯一的国际性药典机构。
各国药典标准制定机构肩负着共同的责任,即科学地制定药品质量标准、保障药品质量的可控性,从而保障公众用药安全和可及性。2020年10月,WHO首次发布了《药典标准对于获得优质药品的价值》(ValueofPharmacopoeialStandardsforAccesstoQualityMedicines,以下简称《WHO白皮书》)[4],着重强调了药典在保障药品质量以及为公众提供优质价廉药品所发挥的不可替代的作用。《WHO白皮书》中重申了药典制定的核心目的是确保药物及其成分安全有效和质量可靠;在药典内容上,涵盖了上市药物在整个货架期内必须符合的技术规范;在药典作用上,明确了药典标准可作为质量的基准,支持药物的总体安全性,并对保护公共卫生做出重要贡献。WHO强调了药典提供了对药品及其成分质量特性的业界共同理解,有助于简化制造商和监管机构之间的沟通,有利于各国药品监管机构在标准合规方面达成一致看法,并促进各国药典之间的协调和趋同。药典标准的制定秉承公开、公正、公平的原则,树立了药典标准的科学性和权威性,提升了公信度,被行业广泛遵从。
随着我国医药产业的飞速发展,我国药品标准整体水平不断提升,在国际上《中国药典》日益受到广泛关注,且国际影响力也日益增长,已步入世界先进药典行列(见图1)。
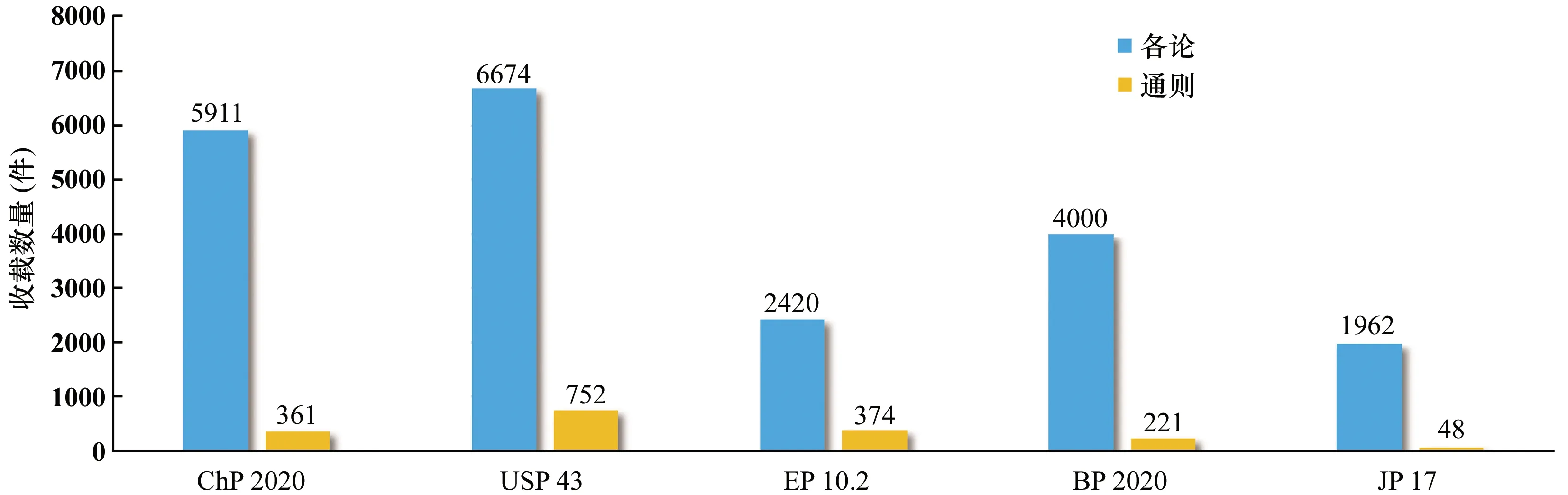
ChP:《中国药典》;USP:《美国药典》;EP:《欧洲药典》;BP:《英国药典》;JP:《日本药局方》
3 《中国药典》的特点
与《欧洲药典》和《美国药典》相比,《中国药典》具有以下特点:① 标准体系更为健全。《中国药典》是国家药品标准体系的核心,不但包涵了凡例、制剂通则、总论、检验方法以及指导原则等通用性技术要求,收载标准涉及中药、化学药、生物制品、原料药、药用辅料、药包材,是目前世界上收载药品标准门类最齐全的药典。② 中药标准引领国际。中药是我国传统医药的瑰宝,《中国药典》收载中药标准涉及中药材、中药饮片、中药提取物、中药成方制剂等,品种齐全。在中药质量控制标准的长期发展中,形成了较为完善的中药质量控制标准体系。无论是在中药质量控制理念、收载品种,还是在安全性、有效性控制研究和标准建立方面,《中国药典》始终走在国际的前沿,并被WHO、欧盟及各国药典所参考借鉴。③ 纸质标准和数字标准相互依托。随着先进检测技术在药品质量控制的推广和应用,《中国药典》标准的形式也呈现多元化。除了传统的纸质标准,作为标准的数字化表现形式,中药的显微鉴别、中药薄层图谱、中药指纹图谱、化学药品鉴别红外图谱、核酸标准序列等数字化标准和数据库也在不断地建立和完善。药品标准以数字化方式呈现,与纸质标准相互依托,成为《中国药典》标准的重要组成部分。④ 完善的生物制品标准体系。由于生物制品管理模式的差异,《中国药典》在生物制品标准体系建立和质量控制标准制定比欧洲、美国、日本等国家药典有着更大的优势。目前《中国药典》收载的生物制品涵盖了预防类产品(细菌性和病毒性疫苗)、治疗类产品(人和动物组织材料来源产品和重组生物技术产品)、单克隆抗体产品以及作为药品管理的诊断试剂产品。《中国药典》是目前世界上收载人用生物制品品种最齐全的药典。针对不同种类生物制品,建立了相应的通则、总论、通用检测法和技术指南。随着标准体系的日益健全,将不断强化全过程、全生命周期的管理。
4 药典标准体系建设
4.1 药典标准体系建设的重要性
《中国药典》之所以成为国家药品标准体系的核心,是因为国家药品监管机构批准的任何药品标准,都不能脱离《中国药典》而独立存在,都必须执行并符合《中国药典》相关通用性技术要求,包括凡例、通则(总论)以及检验方法等(见图2),是当前我国已经上市和研制申报药品(不论国内还是国外产品)都应遵守的技术规范。
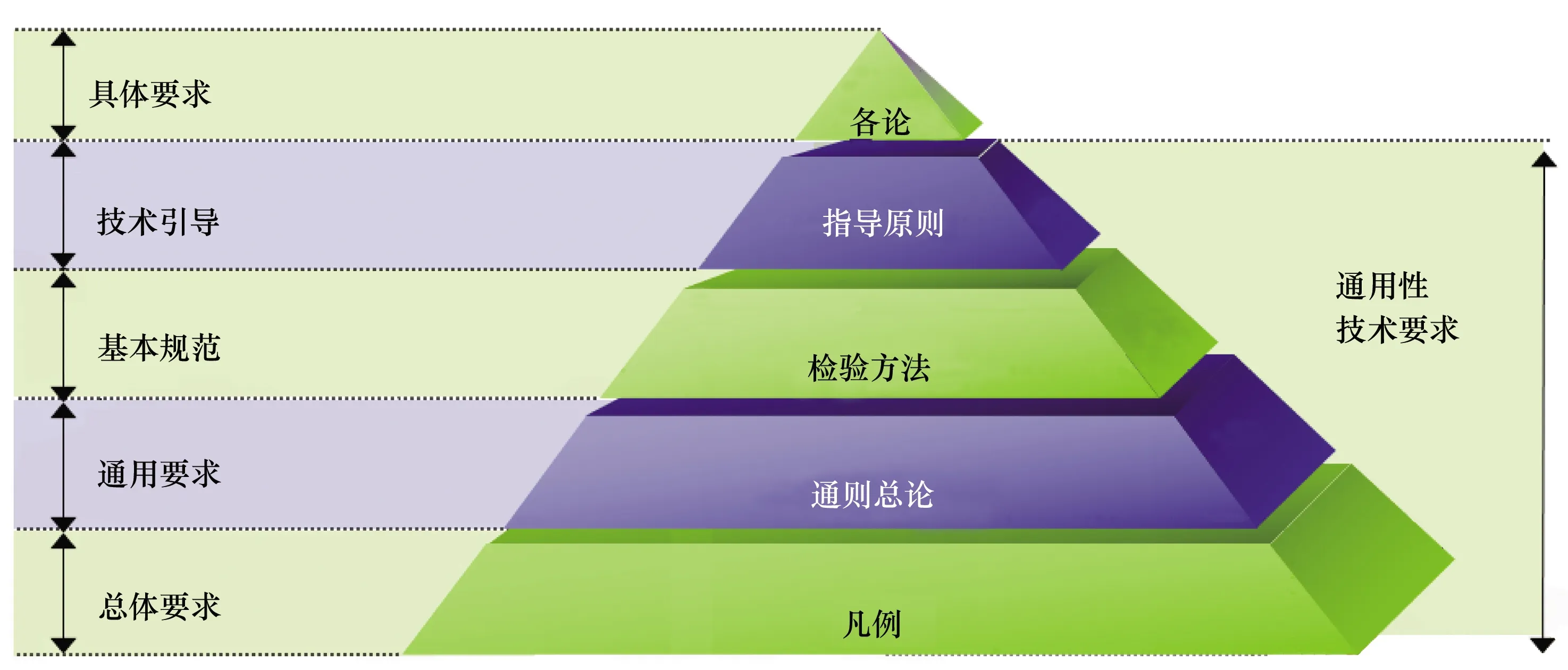
图2 《中国药典》结构框架
4.2 药典标准体系建设的要求
2020年版《中国药典编制大纲》[5]的重点工作目标是健全《中国药典》标准体系,强化药品质量全程管理的理念。通过进一步提高覆盖中药、化学药、生物制品、原料药、药用辅料、药包材以及标准物质的质量控制技术要求,进一步完善药典凡例、制剂通则、总论、检验方法以及指导原则的制定和修订。贯彻药品质量源于设计,有赖于全过程控制保障的监管理念,逐步完善涉及药品研发、生产、检验、流通和使用等环节的通用性技术要求的制定,全面推进《中国药典》标准体系建设。
4.3 贯彻生产全过程控制理念
① 建立生产全链条质量控制体系。2020年版《中国药典》通过对制剂通则(通则0100)的系统修订,贯彻生产全过程控制理念。加强了对药品生产原料药、药用辅料、药包材、生产和制剂工艺、中间品和成品、包装与使用、贮存与运输等控制要求,在保证终端产品质量的同时,将质量控制由终端逐步向生产过程和源头控制延伸,将风险控制点前移,进一步降低生产过程可能引入的风险,逐步形成以保障制剂质量为目标的原料药、药用辅料和药包材标准体系,为实施原料药、药用辅料和药包材关联审评审批制度提供技术支撑。
② 基于风险分级控制。通过完善制剂质量控制要求,建立基于风险防控的生产全过程控制要求,特别是对高风险制剂(如吸入制剂、注射剂及眼用制剂)。基于风险评估,制定原料药、药用辅料、药包材相应的安全控制项目和限度标准,进一步提升高风险药品的安全性。
③ 保障产品质量稳定性。建立相应的生产过程控制要求,完善质量评价体系,制定合理的检测限度,加强药品批间一致性、稳定性,减小批间差异,提高药品质量可控性。
4.4 药典标准安全体系建设
4.4.1探索形成中药安全标准控制体系
中药安全性控制是中药质量控制的重点,随着对中药质量标准研究的不断深入,结合临床实际应用,《中国药典》中药安全性控制体系正逐步地形成(见图3)。
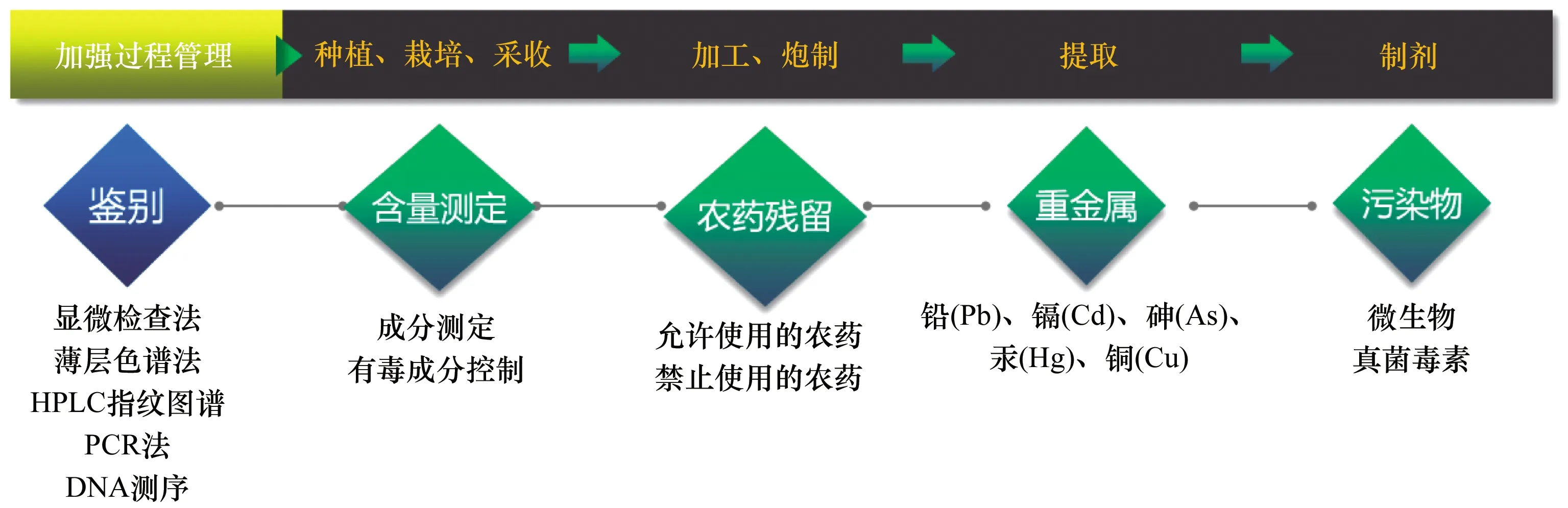
HPLC:高效液相色谱;PCR:聚合酶链反应
① 完善中药材与饮片鉴别检查。2020年版《中国药典》不断加强中药材与饮片鉴别的控制,既保证了中药的有效性,也保障了其安全性。《中国药典》在保留传统的形态学和显微检查法的同时,不断将现代检测技术应用到中药材与饮片的鉴别中,形成以形态学检查、显微检查法、薄层色谱法、HPLC指纹图谱、PCR法、DNA测序等中药材与饮片多维度的鉴别检查方法,以应对当前中药材与饮片形式多样化所面临的掺伪、掺假等诸多问题。
② 有害污染物控制。中药材与饮片的安全性面临的最大挑战,是内源性有毒成分和外源性有毒有害物质的污染。内源性安全考虑主要针对中药自身含有的毒性成分(如生物碱类、苷类、萜类、金属元素类等);外源性污染主要涉及重金属及有毒有害元素、农药残留,特别是有机氯类农药,此类物质可在人体内累积,对人体的正常功能造成伤害。中药材与饮片微生物污染问题也不容忽视,其可能存在大量致病菌和某些真菌毒素,给临床使用带来安全性问题。近年来,随着对中药安全控制的重视程度越来越高,对有毒药材有毒成分控制,中药材与饮片农药残留、植物生长激素、重金属及有害元素的控制,以及易霉变中药材与饮片真菌毒素的控制等,已成为中药安全控制的重中之重。
③ 加强生产全过程管理。由于中药制备材料来源多样、制备工艺各异、成分复杂多变,给中药安全性控制带来了极大挑战。终端产品控制远不能保证中药安全控制的需要,只有逐步实施生产全过程控制,加强中药材种植、栽培和采收管理,规范中药饮片炮制规范,才能最大程度地降低中药安全性风险。因此,将过程管理纳入中药安全控制体系,是中药安全性的重要保障,这也将成为中药标准的重要组成部分。
4.4.2不断完善化学药品安全控制体系
化学药品安全控制体系主要涉及化学活性成分的鉴别检查,有关物质(聚合体、降解产物等)、残留溶剂、元素杂质、基因毒性杂质控制、无菌制剂的无菌检查和非无菌产品的微生物限度控制要求等。对于高风险制剂中,注射剂及眼用制剂的抑菌剂、抗氧剂,注射剂中非水溶剂,静脉输液及滴眼液的渗透压控制等,也是保证制剂安全设定的控制项目(见图4)。
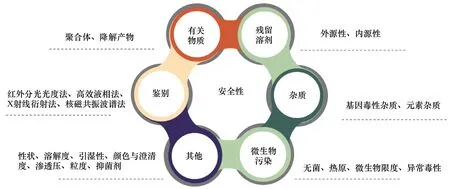
图4 化学药品安全控制标准体系
4.4.3不断强化生物制品安全控制标准体系
生物制品安全控制贯穿生产全过程,对生物制品生产用起始材料,如菌毒种、生产用细胞基质、人或动物来源组织材料的使用、重组制品生产用工程细胞的控制等方面,都建立了严格的控制措施。不断强化生产过程的控制和风险防控,强化病毒安全控制要求,加强对动物来源材料的安全控制,严格对内源性和外源性污染因子的控制,规范病毒灭活/去除工艺的验证,以保证病毒灭活工艺的可靠性和稳定性。同时,加强对生产中引入的残留溶剂和制品中杂质的控制方法的建立,以及限度标准的制定如宿主细胞蛋白(HCP)、宿主细胞DNA残留检测等,以进一步提高产品临床使用的安全性。
4.4.4逐步弥补药用辅料标准体系的空白
随着《总局关于调整原料药、药用辅料和药包材审评审批事项的公告》(2017年第146号)[6]的实施,加强了《中国药典》中药用辅料标准的制修订,逐步形成了药用辅料标准体系(见图5)。
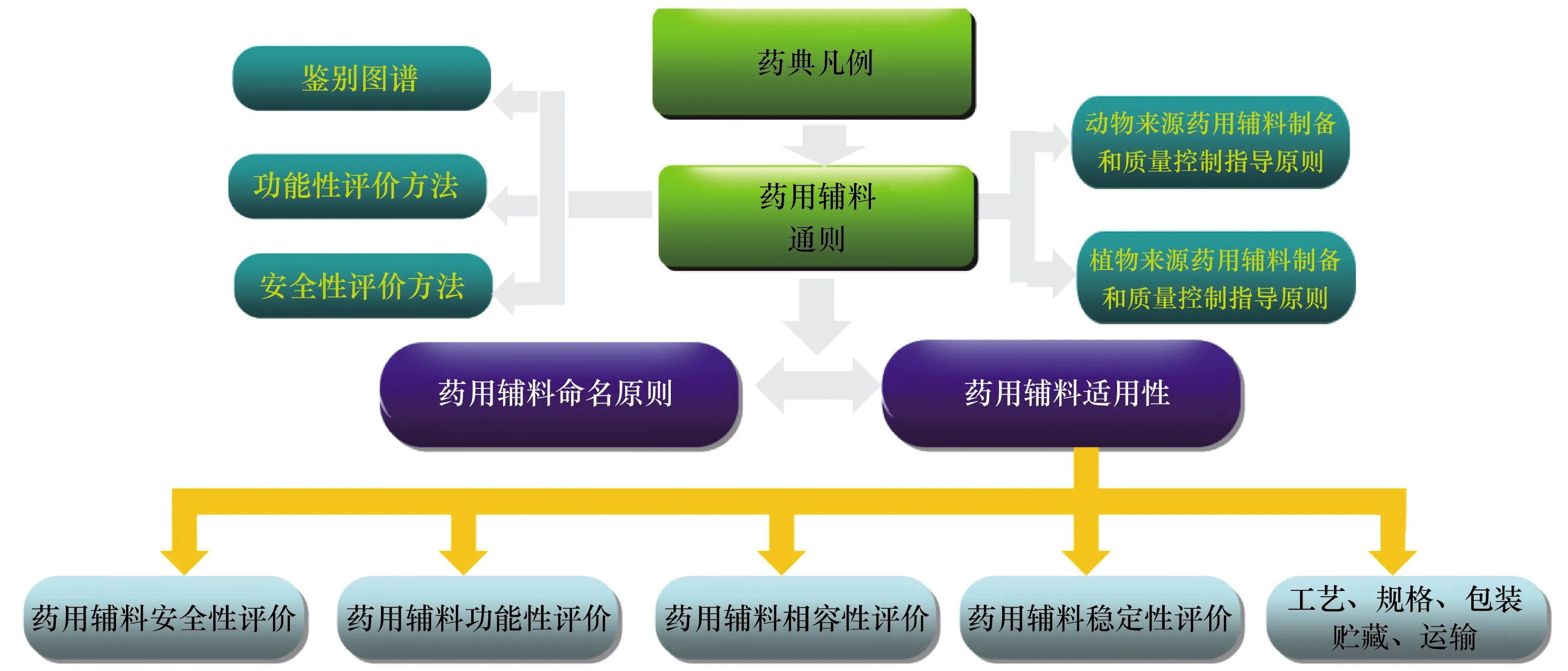
图5 药用辅料标准体系
药用辅料安全性体现在辅料本身的安全性,以及与原料药、辅料、药包材之间的相容性评价。药用辅料标准体系建设的重点是:① 基于给药途径,对药用辅料实施分级管理,对高风险制剂(注射剂、吸入制剂、眼用制剂等)药用辅料实施更为严格的控制要求。② 加强药用辅料安全性评价,特别是对新辅料、新用途辅料(如由低风险改为高风险给药途径等情况)进行安全性评估,保证辅料的使用安全;对于动物来源药用辅料,加强生物安全控制,避免外源因子的引入,同时严格药用辅料中存在安全风险杂质的控制。③ 完善药用辅料功能性评价,根据辅料的功能性不同进行规格细分,指导药品研发机构开展药用辅料适用性研究,规范制剂生产药用辅料的选择(见表1)。

表1 《中国药典》药用辅料功能性评价指标
4.5 搭建药包材标准体系框架
基于应用制剂风险的等级,对药包材实施分级管理,尤其加强对应用于高风险制剂的药包材的管控。根据药包材的材质,制定玻璃、弹性体、塑料类材料的通用性技术要求;根据包装类型,制定相关类型的包装容器通则,包括玻璃瓶、输液瓶、输液袋、药用瓶、预灌封注射器等。初步搭建起药包材质量控制体系(见图6)。
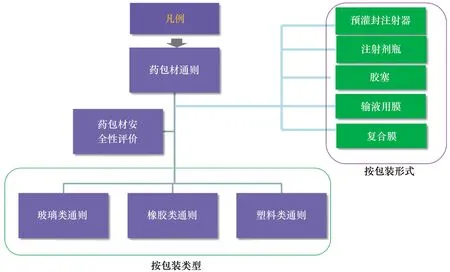
图6 药包材标准体系
5 整体提升药品安全性
2020年版《中国药典》对药品安全控制的要求明显加强,通过整体提升药品安全性控制、推动药品生产工艺升级改造、淘汰落后产品、加快产品更新换代,进一步保障了药品临床使用安全。近几版《中国药典》提升了药品安全性控制要求(见表2)。
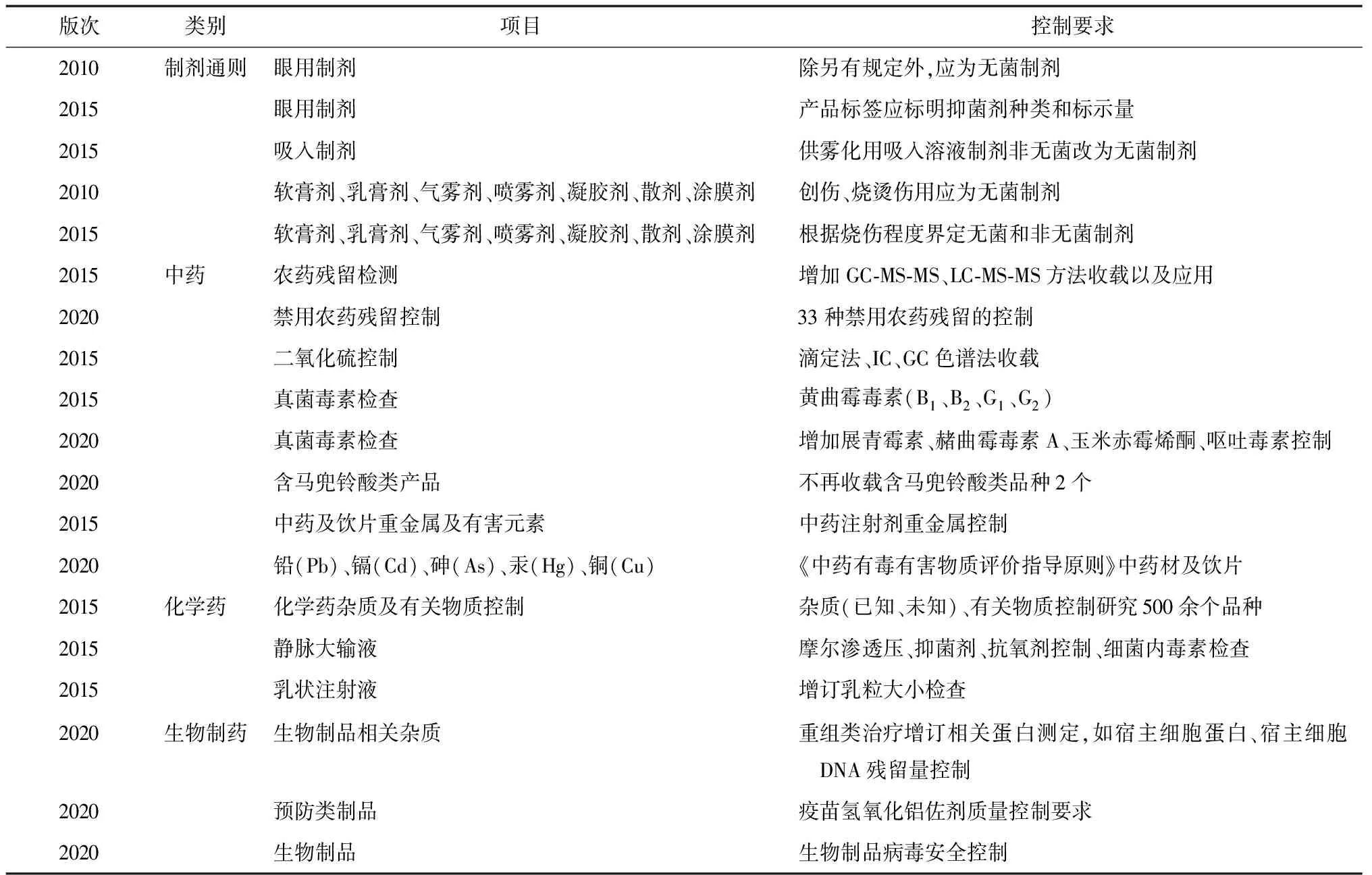
表2 《中国药典》药品安全性控制要求的提升
6 检验技术在药品安全性控制的应用
检测技术的应用和方法的建立,是实施药品安全性控制的基础。《中国药典》不断将先进、成熟的检测技术应用到药品检验中,特别是针对药品安全性的控制。① 扩大了HPLC、GC在药品安全控制项目上的应用,如在药品鉴别检查、含量测定、有关物质检查项等(见图7);② 为进一步提高检测能力,近年来在MS、HPLC-MS、LC-MS-MS/GC-MS-MS的应用呈明显上升趋势(见图8)。如中药材及饮片二氧化硫残留量测定建立了IC和GC法,以进一步提高二氧化硫检测的灵敏度,原采用GC只能检测22种农药残留,现采用GC-MS-MS法,可将检测能力扩大到600余种;③ 加强检测技术储备,建立了中药材DNA条形码分子鉴别、色素测定法、中药中真菌毒素测定法、中药有害残留物限量制定等指导原则。酶联免疫吸附测定(ELISA)法作为一种快速、简便、高通量的免疫学检测技术,日益用于真菌毒素的检测。
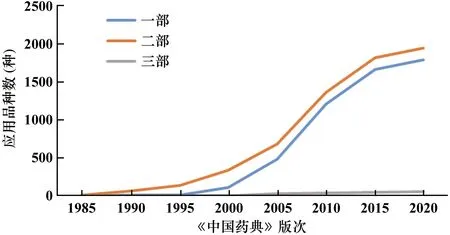
图7 HPLC在药典中的应用情况
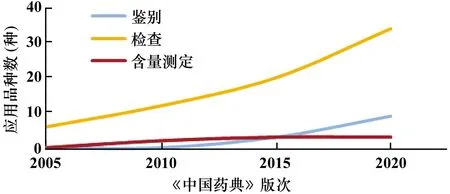
图8 MS、HPLC-MS、LC-MS-MS、GC-MS-MS在药典质控中的应用
7 结语
随着“提高国家药品标准行动计划”的实施,我国药品标准的整体水平迈上了一个新台阶,药品质量有了极大的提升,对推动我国医药产业整体水平的提高,发挥了至关重要的作用。《中国药典》为公众用药安全构筑起了一道坚实可靠的“防护墙”,为支撑药品监管建立起了一条科学规范的“基准线”,为促进我国医药产业又好又快地发展提供了一个精确灵敏的“导航仪”。保障临床用药安全是药典标准制修订的根本目标。全面落实“建立最严谨的标准”要求,坚持以临床为导向、防范系统风险、守住药品安全底线、不断完善国家药品标准、促进我国制药产业高质量发展,将是今后《中国药典》标准制修订的工作方向。

