耐药革兰阴性杆菌在腹腔感染中作用研究进展
崔建 王毅 刘威 于湘友
腹腔感染是脓毒症发病及导致患者高病死率的重要原因[1-2]。资料显示[3],约1/4的脓毒性休克是由腹腔感染引起的,腹腔感染是继肺部感染后,脓毒性休克的第二大病因。腹腔感染的诊疗目前仍存在诸多难题,需要多学科协作。尽管外科技术的发展及肠内营养的改良改善了此类患者的治疗预后,但在复杂腹腔感染(complicated intra-abdominal infection,c-IAI)患者的管理中及时恰当的抗生素治疗对于预防发生脓毒性休克及减少晚期相关并发症仍起着重要作用[4-5]。然而细菌耐药,尤其是革兰阴性杆菌,严重影响了临床感染诊疗的成功率[6-7]。革兰阴性杆菌的耐药率不断上升,已成为医院感染管理的难题,也是全球健康的重大威胁,主要包括肺炎克雷伯菌、鲍曼不动杆菌和铜绿假单胞菌的流行[8]。笔者就腹腔感染中耐药革兰阴性杆菌的流行病学及抗菌药物的应用策略进行综述。
一、腹腔感染的相关定义及分类
(一)一般腹腔感染
腹腔感染是一种可致腹腔内器官发生严重功能损害的感染性病变,常表现为单个器官的炎症反应、不同形式的腹膜炎或腹膜内、腹膜后、实质脓肿等[9]。按照病理机制可分为:(1)单个器官的感染(如胆囊炎、阑尾炎、胰腺炎等),尽管不伴有腹腔脏器穿孔,但也有可能发生腹膜炎。(2)感染性腹膜炎(原发性腹膜炎、继发性腹膜炎和第三型腹膜炎)。(3)腹腔内脓肿。按照感染环境可分为社区获得性腹腔感染(community-acquired intra-abdominal infection,CA-IAI)和医院获得性腹腔感染(healthcare-acquired intra-abdominal infection,HA-IAI)。按照感染累及范围主要分为非复杂腹腔感染和复杂腹腔感染。
(二)复杂腹腔感染
c-IAI是指感染灶穿透腹腔内的空腔脏器,进入腹膜腔,伴有腹腔内脓肿形成或腹膜炎,治疗上需要感染源的有效控制和合理抗生素的联合应用,分为腹腔脓肿型和腹膜炎型[1]。
(三)感染性腹膜炎
感染性腹膜炎是指腹腔内感染过程中由细菌、真菌或其毒素引起的局部炎症[9]。主要分为:(1)原发性腹膜炎是指无胃肠道穿孔的情况下发生的腹膜炎,如肝硬化、慢性腹膜透析、结核性肉芽肿等所致的自发性腹膜炎。(2)继发性腹膜炎是指继发于胃肠道等穿孔导致的腹膜炎:①由于腹腔内器官急性炎症、肠缺血、盆腔炎等造成的穿孔。②术后腹腔器官吻合口裂开、吻合缝线裂开或肠手术残端裂开等造成的穿孔。③开放性或闭合性腹部创伤导致的穿孔。(3)第三型腹膜炎是指在经过一次以上感染源清除治疗来控制感染但失败而造成复发或持续的腹腔内感染。多与被低致病性微生物污染有关,如无菌性、真菌性及低致病性细菌引起的腹膜炎等。
(四)腹腔脓肿
腹腔脓肿是指在异物和微生物等因素共同作用下导致局部的低pH环境,损害了吞噬细胞的功能,也阻碍了免疫细胞和抗生素的渗透,进而导致腹腔内脓肿的形成,由于有腹膜包裹,全身炎症反应可能很小或没有。根据脓肿位置可分为:(1)腹膜内脓肿(如膈下、肝下、盆腔脓肿等)。(2)腹膜后脓肿。(3)腹腔实质器官脓肿(如肝、脾、肾脓肿等)[1, 9]。需要指出的是,腹腔脓肿可单发,也可多发,甚至不同类型的腹腔脓肿可同时存在。
二、常见腹腔感染致病微生物特点
一个世纪前,临床医师只能将引起腹腔感染的可能原因分为需氧细菌和厌氧细菌。随着细菌检验技术的进步,到20世纪70年代中期,人们逐渐认识到严重的腹腔感染可能涉及多种细菌的协同效应[10]。
(一)消化道常见共生菌
引起腹腔感染的细菌主要源于胃肠道的内源性菌群,因此了解胃肠道内的正常微生物群是预测腹腔感染致病菌的关键因素之一。人体肠道的正常共生菌可达500多种,消化道不同部位的菌种不同[11]。(1)胃内主要包括链球菌、乳杆菌属等。(2)胆道正常状态下无菌,也可能包括大肠埃希菌、肠球菌等。(3)近端小肠主要包括大肠埃希菌、克雷伯菌属、乳杆菌属等。(4)远端小肠主要包括脆弱拟杆菌、梭菌属、大肠埃希菌等。(5)结肠主要包括拟杆菌属、梭菌属、大肠埃希菌等。因此,各部位腹腔感染的主要致病菌存在差异,导致患者的预后也存在差异[12]。
(二)腹腔感染常见分离菌
一项关于中国三级医院胃肠瘘患者细菌学和细菌耐药性变化趋势的研究显示[13],共有47.2%的患者同时感染了多种微生物菌株,革兰阴性菌占总体分离菌的73.0%,以大肠埃希菌最常见,占总体分离菌的24.2%;其次是肺炎克雷伯菌占总体分离菌的14.1%;其他分离菌包括肠球菌属(10%)、鲍曼不动杆菌(9%)、铜绿假单胞菌(8%)等。调查结果表明[13-14],目前革兰阴性杆菌仍是腹腔感染最常见的致病菌。需要注意的是,根据抗菌药物耐药性趋势监测研究(study for monitoring antimicrobial resistance trends,SMART)的相关数据,与CA-IAI不同,HA-IAI革兰阴性杆菌致病菌耐药的形势近年来愈发严重,临床医师选择抗生素的难度也越来越大[15]。导致腹腔感染的主要致病革兰阴性杆菌包括大肠埃希菌、肺炎克雷伯菌、鲍曼不动杆菌、铜绿假单胞菌等。
1.大肠埃希菌
大肠埃希菌是腹腔感染致病菌中检出率最高的菌种[12-13]。根据CHINET监测数据[16],大肠埃希菌占总体分离菌株的19.47%,其中产超广谱β-内酰胺酶(extended spectrum beta-lactamases, ESBL)菌株的检出率为45.2%,对青霉素、头孢菌素等抗生素的耐药率明显高于非产ESBL菌株。腹腔感染患者中产ESBL的大肠埃希菌检出率呈逐年上升趋势,中国地区达55.6%,显著高于亚洲其他地区[17]。中国不同地区的检出率也存在不同。2019年全国大肠埃希菌对第三代头孢菌素的耐药率平均为51.9%,较2018年下降了1.1%,但仍然处于相对较高的水平,其中河南省最高(62.0%),天津市最低(45.7%)[18]。值得注意的是,大多数编码ESBL酶的基因位于质粒上。因此,产ESBL的细菌通常对其他如氨基糖苷类和喹诺酮类药物也具有附加耐药机制,进而导致细菌多重耐药[19]。另一项腹腔感染革兰阴性杆菌相关调查结果也显示[20],对于产ESBL的大肠埃希菌分离株,碳青霉烯类及阿米卡星是其最有效的抗菌药物,鉴于喹诺酮类药物耐药性较高,建议临床实践中审慎对待。
耐碳青霉烯肠杆菌科细菌(carbapenem-resistant enterobacteriaceae,CRE)主要由细菌产碳青霉烯酶等引起,某些菌株可因产ESBL和(或)头孢菌素酶(AmpC酶)及存在外排泵过度表达或膜孔蛋白突变而导致耐药[21]。目前,中国大肠埃希菌对碳青霉烯类药物的耐药率多在10%以下[16]。SMART研究中尚没有中国产碳青霉烯酶肠杆菌科细菌导致腹腔感染的数据,将来需要继续对腹腔感染致病菌进行流行病学调查进一步加强监测[22]。
2.肺炎克雷伯菌
克雷伯菌属属于肠杆菌科,肺炎克雷伯菌是临床上最常见的克雷伯菌属细菌,常分布于人体的胃肠道、皮肤和鼻咽部,是人类感染的常见致病菌[22]。在腹腔感染分离菌株中,肺炎克雷伯菌的检出率仅次于大肠埃希菌[12-13]。2016年CHINET数据显示[16],肺炎克雷伯菌的检出率为13.86%。在呼吸道标本的分离菌株中,肺炎克雷伯菌的检出率已经超过鲍曼不动杆菌,上升至第1位。2019年全国细菌耐药监测报告提示[18],肺炎克雷伯菌对碳青霉烯类药物的耐药率全国平均为10.9%,较2018年上升了0.8%;其中河南省最高(32.8%),西藏自治区最低(0.6%),总体耐药率呈缓慢上升趋势。根据CHINET最新数据[24],2021年上半年肺炎克雷伯菌分离菌株对亚胺培南和美罗培南的耐药率分别达到了25.5%和27.1%,较前有明显上升。产碳青霉烯酶肺炎克雷伯菌(carbapenemase-producing klebsiella pneumonia,CR-KP)全球范围内的流行已经成为各国各地区的重大难题[25-26]。
CR-KP的耐药性涉及多种机制,包括碳青霉烯酶的产生(如KPC、NDM、VIM等)、膜孔蛋白缺失导致细胞膜通透性降低及外排泵功能上调降低抗生素在细胞质的浓度,后两种机制通常伴有高水平的其他类型β-内酰胺酶(如AmpC酶等)的产生[27]。由多重耐药性肺炎克雷伯菌(multidrug resistant Klebsiella Pneumoniae,MDR-KP)引起的感染与临床实践中患者病死率高于40%~50%具有相关性,特别是对于重症患者和接受实体器官移植的患者[28-29]。此外,自1986年在中国台湾首次分离报道高毒力肺炎克雷伯菌(hypervirulent klebsiella pneumonia,hvKp)以来,hvKp引起的感染呈上升趋势[30-31]。hvKp常同时引起多部位的感染或出现感染后传播转移的现象,且经常需要进行感染源控制(如脓肿引流等)。与经典肺炎克雷伯菌(classical klebsiella pneumonia,cKp)不同的是,hvKp可能会引起中枢神经系统和眼内感染,对其引发的感染需要快速识别并进行感染灶的定位[31]。目前hvKp经常在年轻和健康的宿主中引起危及生命的社区获得性感染,尽管通常对抗生素敏感,但有研究显示[32],hvKp和MDR-KP的克隆均具有细菌代谢普遍存在的特征,在环境等因素的影响下两者可能会结合产生高耐药性和高毒力的双重风险菌株。
Zhang等[20]的研究结果显示,HA-IAI患者中产ESBL的肺炎克雷伯菌的检出率高于CA-IAI患者,CA-IAI中产ESBL肺炎克雷伯菌的易感性低于HA-IAI。这与先前的SMART研究结果一致[33]。鉴于肺炎克雷伯菌耐药性的逐年增加,建议临床中对于高危腹腔感染患者常规实施CR-KP的筛查,以期能够早期识别干预[34]。
3.鲍曼不动杆菌
鲍曼不动杆菌也是一种革兰阴性球杆菌,已成为医院感染甚至社区感染日益普遍的致病菌,引起了全球医疗卫生领域极度重视[35-36]。对于鲍曼不动杆菌,最令人担忧的是其积累了多种产生抗生素耐药性机制的能力,目前已经出现对所有商品化抗生素均耐药的菌株[37-38]。根据中国CHINET数据[16],不动杆菌属占总体分离菌株的10.77%,而其中的90.6%为鲍曼不动杆菌。2019年全国细菌耐药监测报告数据显示[18],鲍曼不动杆菌对碳青霉烯类药物的耐药率全国平均为56%,较2018年下降了0.1%,其中河南省最高(78.6%),西藏自治区最低(24.4%)。CHINET最新数据显示[24],2021年鲍曼不动杆菌对亚胺培南和美罗培南的耐药率分别达到了69.21%和70.5%。在WHO公布针对耐药细菌的新抗生素研发优先等级中,按照致病菌感染的可治疗性、病死率、医疗负担及10年耐药趋势计算,排名第一位的细菌即为耐碳青霉烯的鲍曼不动杆菌[7]。鲍曼不动杆菌可以定植于人体皮肤、伤口及呼吸道和胃肠道,干燥环境下可以存活数周,这一特性增加了其院内传播致病的机率[39]。
院内鲍曼不动杆菌最常见的耐药机制也涉及产ESBL、细胞壁膜孔蛋白的改变及外排泵的过度表达,还可以通过gyrA和parC基因的突变对喹诺酮类药物耐药,通过表达氨基糖苷类修饰酶对氨基糖苷类药物耐药[40]。也有研究描述[41],在鲍曼不动杆菌的基因组中含有45个耐药性基因的“耐药性岛”。这些研究促使临床医师对其新型耐药性相关因子的识别鉴定,也极大地改变了研究人员对细菌耐药性进化的思考方式。
鲍曼不动杆菌的感染多发生于衰弱的患者。而c-IAI接受手术、中心静脉置管、机械通气、肠内喂养以及碳青霉烯类或第三代头孢菌素等抗生素治疗的患者,复合鲍曼不动杆菌感染的机率会明显增加[42-43]。院内爆发流行鲍曼不动杆菌常可以追溯到污染源,因此临床中有针对性的院感控制措施应继续加强[44]。
4.铜绿假单胞菌
铜绿假单胞菌是一种机会致病菌,能够在各种环境条件下生存和生长。该细菌能够通过内在和获得性机制对抗生素产生耐药性且有多样的致病机制[45]。铜绿假单胞菌可以引起血流、肺部、腹腔等感染。既往史中长期住院、机械通气、伴有其它基础疾病(APACHE-II评分>16分)及不恰当的广谱抗菌药物治疗均是其致病的高危因素[46]。根据中国CHINET数据[16],铜绿假单胞菌的检出率为8.66%。根据2019年全国细菌耐药监测报告数据[18],中国铜绿假单胞菌对碳青霉烯类药物的耐药率全国平均为 19.1%,较2018年下降了0.2%,上海市最高(28.8%),西藏自治区最低(7.1%)。近几年铜绿假单胞菌对碳青霉烯类药物的耐药率稳中有降。而CHINET最新数据提示[24],2021年铜绿假单胞菌对美罗培南和亚胺培南的耐药率达到了20.2%和24.7%,较去年有一定程度的反弹,值得临床医师对其加以防控警惕。
铜绿假单胞菌的耐药机制复杂,包含先天对某些抗生素耐药,如野生型菌株对阿莫西林、部分头孢菌素及厄他培南等药物天然耐药;也可以类似肠杆菌科细菌产生AmpC酶对β-内酰胺类抗生素耐药;通过对膜孔蛋白、外排泵的调节导致细胞通透性降低、外流增加对碳青霉烯类药物产生耐药;基因水平的突变、携带耐药基因的染色体或质粒在细胞间的转移、核糖体甲基化及脂多糖修饰等机制也使得铜绿假单胞菌对氨基糖苷类及粘菌素类等多种药物产生耐药[19, 21, 45]。对于铜绿假单胞菌流行率高的地区应加强医院环境中该菌定植的筛查,有效的院感防控联合规范的抗菌药物使用可能更有助于其流行趋势的控制[47]。
三、耐药革兰阴性杆菌腹腔感染的抗菌药物应用策略
(一)腹腔感染抗菌药物的选择策略
随着可视化技术的发展,从疑似患者的识别到腹部(增强)CT、超声引导下细针穿刺活检以及剖腹探查等诊断策略使得腹腔感染的早期诊断成为可能。而治疗上除了通过外科手段进行感染源控制外,如何用好抗生素仍然是临床医师的一个难题。近年来,细菌耐药形势越发严峻,耐药菌导致的感染发病率居高不下,其中近一半发生于危重患者[48]。细菌耐药会大大增加住院成本,尤其是ICU患者的病死率和感染相关的医疗成本[49]。对于腹腔感染患者,特别是c-IAI患者亦是如此。
对于高危及耐药菌高流行地区的腹腔感染患者建议应用抗菌药物之前留取腹水或感染组织进行培养,发现可能的耐药或机会性致病的病原体,积累并分析数据用以指导治疗,但对于低危腹腔感染患者,笔者不建议仅为留取标本而进行有创操作检查。在初始经验性治疗的抗菌药物选择上,应考虑当地微生物流行病学和抗生素的敏感性,在对患者疾病严重程度和耐药菌感染风险的评估后选择合适的抗感染治疗方案(图1)[4]。经验性抗感染治疗的过程中,应考虑到:(1)根据感染部位和药物特点调整药物及剂量,保证药物组织渗透浓度达标。(2)危重患者,药物的药效学会发生明显变化。(3)应用常见致病菌的最低抑菌浓度(minimum inhibitory concentration,MIC)指导抗菌药物初始剂量。(4)根据抗菌药物的药代动力学/药效学(pharmacokinetic/pharmacodynamic,PK/PD)特点滴定至药物的最佳目标剂量[50]。
(二)腹腔感染联合抗菌药物治疗策略的应用时机
抗菌药物联合治疗是指对于一种目标病原体同时使用两种不同类别预期有效的抗生素治疗,以加快清除病原体。多药治疗是指应用多种抗菌药物以实现经验抗感染治疗的广谱覆盖或加快已知或疑似病原体的清除[2]。对于腹腔感染,一般经过有效的感染源控制后不需要常规进行抗菌药物的联合治疗。若患者出现脓毒性休克时,可考虑应用此策略迅速改善其疾病状态。对于初始经验性抗感染启动了联合治疗的患者,应在其临床症状体征好转和/或感染缓解的数天内尽快停止联合治疗,并根据相关实验室检查结果进行降阶梯治疗[51]。需要指出的是,对于明确感染鲍曼不动杆菌的患者,不建议给予抗菌药物的联合治疗[52]。最新脓毒症指南指出[53],对于未证实的脓毒症或脓毒症休克的成人患者,建议评估患者有无非感染性诊断。最好识别脓毒症或脓毒症休克1 h内启动抗生素治疗,否则推迟使用抗菌药物。当患者还具有多重耐药高风险时,建议抗菌药物覆盖两种革兰氏阴性菌。一旦明确病原体和药敏结果,不再建议双重覆盖[53]。
(三)腹腔感染抗感染治疗疗程
抗感染治疗疗程仍是困扰广大临床医师的难题。STOP-IT研究结果显示[54],对于经过恰当的感染源控制的腹腔感染患者,短疗程(约4 d)抗生素治疗与长疗程(约8 d)抗生素治疗的结果差异无统计学意义。另一项研究结果显示[55],短疗程(8 d)抗生素治疗有效减少了腹腔感染术后抗生素的暴露率,相比之下长疗程(15 d)并未显示出更多的临床获益。因此,建议限制感染源得到充分控制的腹腔感染患者接受抗菌药物治疗的时间在4 d以内,但对于尚未接受确切感染源控制的患者或继发性菌血症经充分控制感染源后已不再存在菌血症的患者,抗菌药物治疗时间可延长至5~7 d[4]。值得注意的是,降钙素原和临床评估联合有利于判断抗菌药物的疗程。
四、展望
耐药革兰阴性杆菌感染是影响腹腔感染患者预后的重要因素,未来迫切需要开展相关临床研究来监测腹腔感染感染趋势的变化,切实落实院感防控措施,做好耐药菌爆发流行的预防对于耐药菌的治疗极为重要[4, 56]。如何优化抗菌药物的使用也是医院管理的重大难题,在未来应继续加强对临床医师的培训和考核,使其更好地掌握抗菌药物剂量优化、最佳治疗疗程及联合治疗时机等,以期能够达到同质化应用抗菌药物的目标。此外,鉴于细菌耐药的现状,未来需要新型抗菌药物的研发,截至目前已有多种药物进入临床试验,相信未来临床医师在耐药细菌感染的药物选择上会有更多余地[56]。
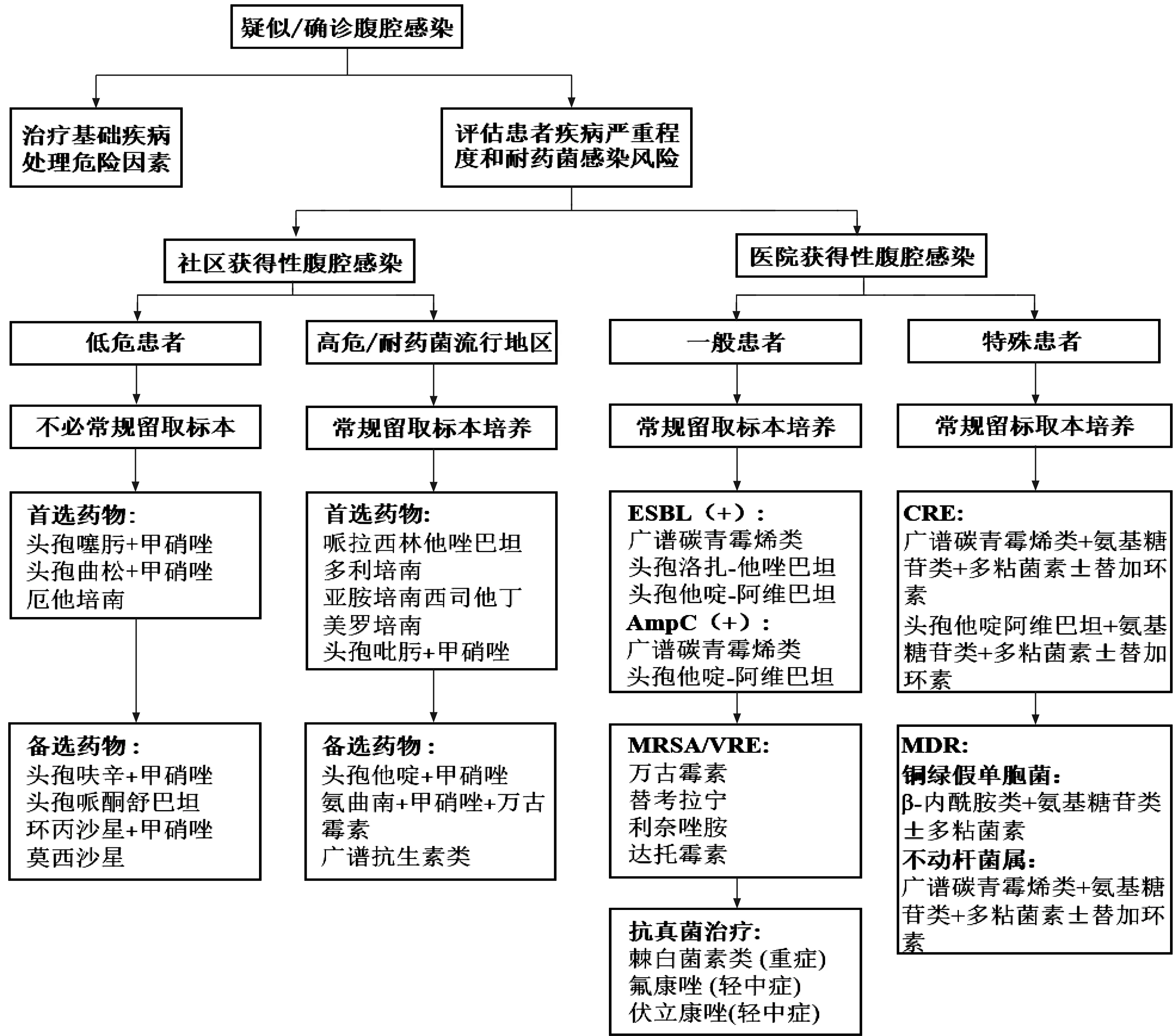
图1 腹腔感染经验性抗菌药物的选择策略
五、总结与展望
耐药是细菌进化的必然途径,自人类发现并应用抗菌药物以来,细菌耐药的形势逐渐加重,其中不可忽视的因素即为抗生素对耐药菌的筛选作用,抗菌药物不合理地应用使得耐药菌对人类健康的威胁愈发严重。在腹腔感染患者中,耐药革兰阴性杆菌已成为最常见的致病菌,各级医院及广大临床医师应关注cIAI致病菌的耐药现状,切实做好抗生素管理,“治疗疾病”与“预防耐药”并举。

