p38丝裂原活化蛋白激酶、上皮细胞间质转化在胃食管反流病及食管腺癌组织中的表达及其临床意义
钟江利 王红 赵凌苇
胃食管反流病(gastroesophageal reflux disease,GERD)是一个多因素造成的以食管下括约肌为主的胃肠动力障碍性疾病,影响了北美国家超过1/5的人口[1],我国发病率也超过5%[2],其高发病率及并发症严重影响了人们的生活质量,长期反复发作的胃食管反流病癌变的风险较高,且Barrett食管是食管腺癌的癌前病变,确诊后的食管腺癌预后极差。p38丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路是MAPK家族中重要的炎症信号通路。p38 MAPK受外界刺激活化后可使肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleuin-6,IL-6)、IL-8等上调从而诱发炎症反应[3]。在胃食管反流病中,p38 MAPK能够被胃酸、胰蛋白酶等激活,通过炎症因子介导食道黏膜组织的病变过程[4-5]。同时越来越多的证据表明在反流性食管炎-Barrett食管-食管腺癌的演变过程中,食管黏膜细胞上皮-间质转化(epithelial-mesenchymal transition,EMT)扮演极其重要的作用。
有学者发现在胆管癌细胞系ICBD上细菌脂多糖(Lipopolysac-charide,LPS)能够激活Toll样受体(Toll-like receptors,TLR4)信号转导通路,活化下游的p38 MAPK信号通路表达上调,导致上皮细胞标志物(Epithelial-cadherin,E-cadherin)的表达显著降低,而间皮细胞的标志物Vimentin蛋白的表达显著升高,诱导EMT的发生[6]。本研究旨在探讨p38 MAPK、Vimentin、E-cadherin在胃食管反流病及食管腺癌发病过程中的作用。
资料与方法
一、对象
收集2017年1月至2019年4月遵义医科大学附属医院病理科42例胃食管反流病患者蜡块标本(来源于消化内科内镜活检患者)为胃食管反流病组、2013年1月至2019年4月9例食管腺癌患者标本(来源于胸外科行食管腺癌切除术患者)为食管腺癌组、9例食管腺癌癌旁组织标本(来源于食管腺癌患者癌旁黏膜组织)为癌旁组,所有标本均具有完整的信息及病史资料,病理类型由我院病理科医师诊断,标本的使用经过医院伦理委员会的同意和许可。42例胃食管反流病标本中,其中男性27例、女性15例;年龄:≥60岁14例、<60岁28例;幽门螺旋杆菌(helicobacter pylori,Hp)感染:有Hp感染16例、无Hp感染26例;GERD类型:反流性食管炎21例、Barrett食管21例。
二、方法
1.主要试剂:兔抗p38 MAPK单克隆抗体、兔抗E-cadherin单克隆抗体、兔抗Vimentin单克隆抗体由CST公司提供,多聚-L-赖氨酸、柠檬酸盐缓冲液、PBS缓冲液、DAB显色液由上海基因科技有限公司提供,通用型山羊血清由北京中杉金桥公司提供。
2.免疫组化法检测相关蛋白表达:所有组织标本经石蜡切片后、依次进行脱蜡、去除内源性过氧化物酶、抗原修复、一抗孵育、滴加二抗、DAB显色等步骤,所用抗体浓度分别为p38 MAPK (1∶400),E-cadherin (1∶400),Vimentin(1∶200)。p38 MAPK特异性染色主要表达于胞浆和胞核,呈黄色、棕黄色或棕褐色颗粒,E-cadherin特异性染色主要表达于细胞膜,呈黄色、棕黄色或棕褐色颗粒,Vimentin特异性染色主要表达于胞质和间质,呈棕黄色、棕褐色颗粒。判读结果以每张切片上染色强度和染色阳性细胞数分别计分,在显微镜下排除非特异性染色区域后,找到5个阳性细胞着色最强的视野,分别计数细胞的染色强度和阳性细胞百分率,按两数据之积计分[7](两者相乘0分为阴性,1~4分为弱阳性,5~8分为阳性,9~12分为强阳性)。染色强度:无着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;阳性细胞百分率:≤5%为0分,6%~25%为1分,26%~30%为2分,51%~75%为3分,≥75%为4分。
三、统计学分析
采用SPSS 20.0统计软件进行数据分析。计量资料用均值±标准差(±s)表示,采用t检验;计数资料用例数(百分率)表示,采用χ2检验。P<0.05为差异有统计学意义。
结 果
一、p38 MAPK、E-cadherin、V-imentin的表达
p38 MAPK主要表达在胞浆和胞核,呈黄色、棕黄色、棕褐色颗粒,在食管腺癌癌旁组织、胃食管反流病组织及食管腺癌组织中阳性率分别为11.1%(1/9)、59.5%(25/42)、88.9%(8/9),(见图1、表1)。
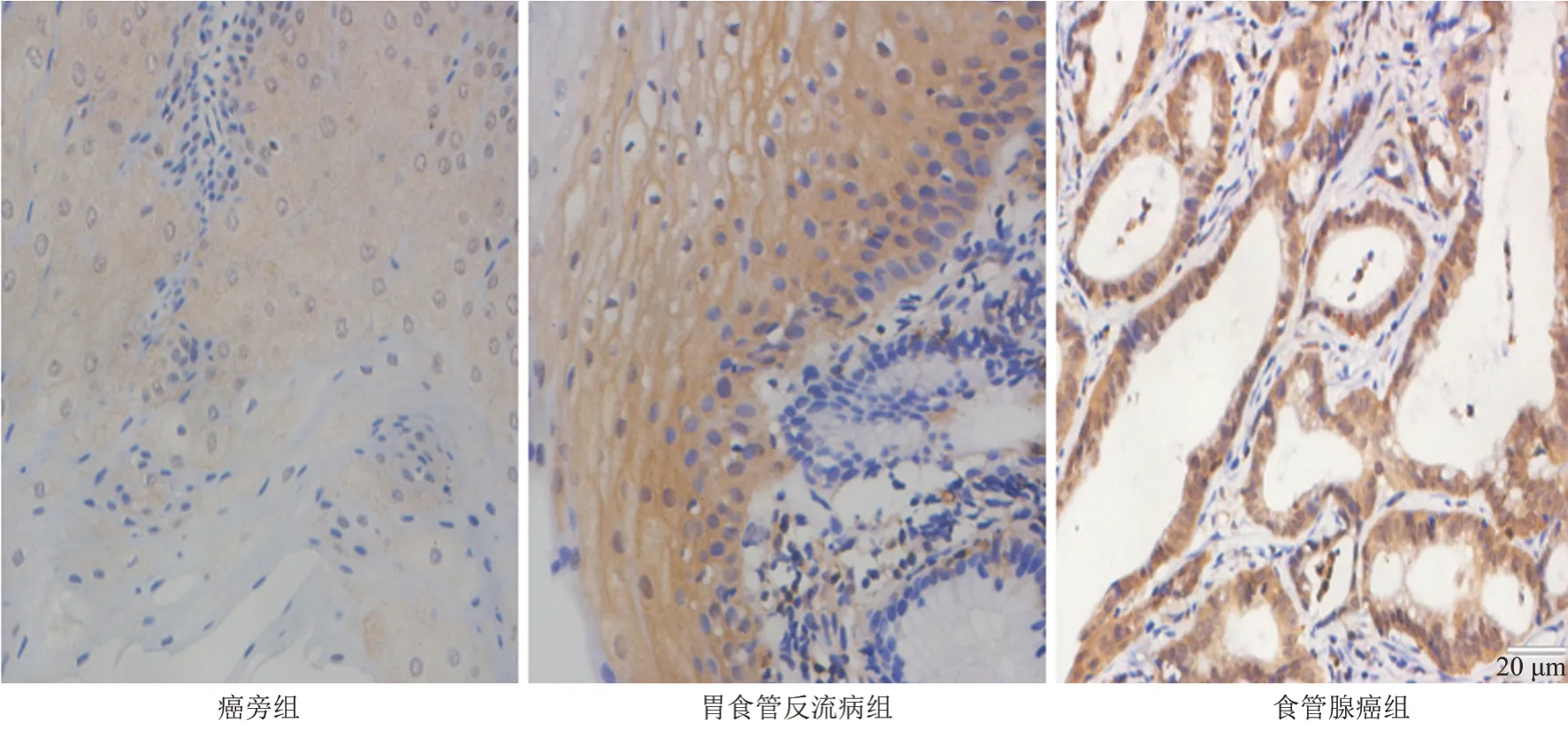
图1 -p38 MAPK在3组中的表达(×400)
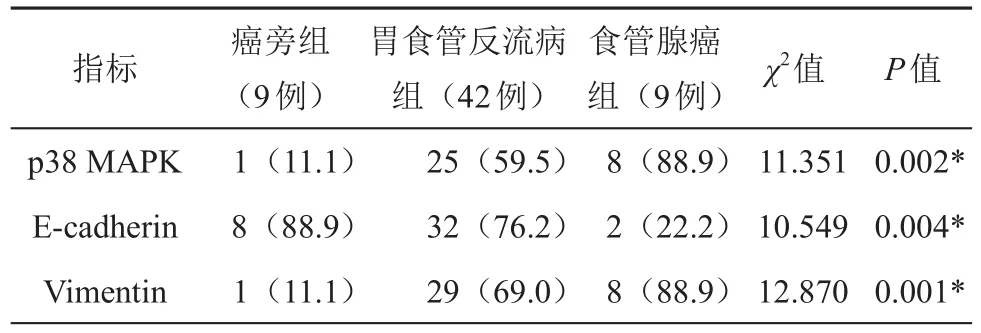
表1 p38 MAPK、E-cadherin、Vimentin在食管腺癌癌旁组织、胃食管反流病组织、食管腺癌组织中的阳性率(%)
E-cadherin特异性染色主要表达于细胞膜,呈黄色、棕黄色或棕褐色颗粒,在食管腺癌癌旁组织、胃食管反流病组织及食管腺癌组织中阳性率分别为88.9%(8/9)、76.2%(32/42)、22.2%(2/9),(见图2、表1)。

图2 -E-cadherin在3组中的表达(×400)
Vimentin特异性染色主要表达于胞质和间质,呈棕黄色、棕褐色颗粒,V-imentin在食管腺癌癌旁组织、胃食管反流病组织及食管腺癌组织中阳性率分别为11.1%(1/9)、69.0%(29/42)、88.9%(8/9),(见图3、表1)。
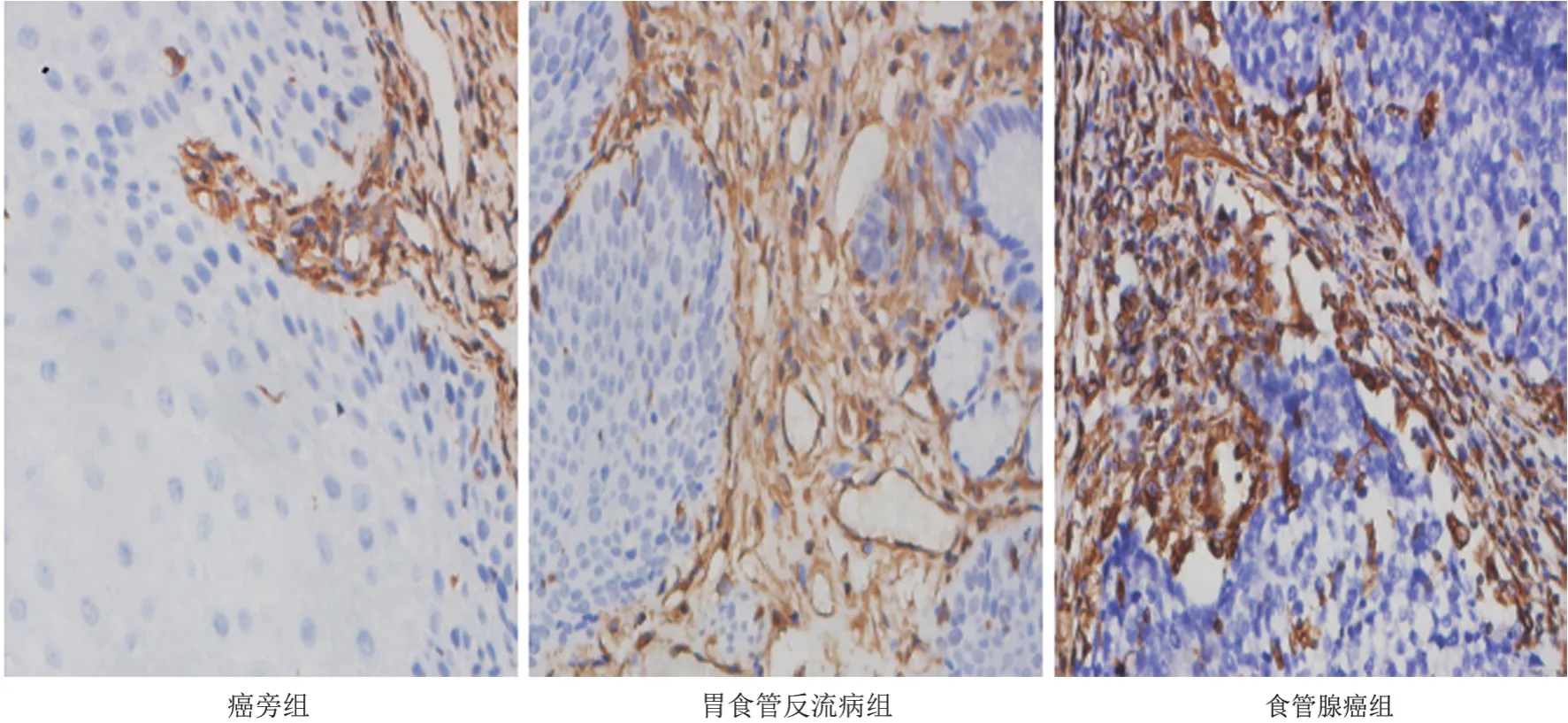
图3 -E-Vimentin在3组中的表达(×400)
二、p38 MAPK、E-cadherin、Vimentin在胃食管反流病的表达与临床特征之间的关系
p38 MAPK、Vimentin在胃食管反流病中的表达情况与性别、年龄及Hp感染均无关(P>0.05),与GERD类型有关(P<0.05)。E-cadherin在胃食管反流病中的表达情况与性别、年龄、Hp感染及GERD类型均无关(P>0.05),(见表2)。
讨 论
p38 MAPK通路已被认定为炎症反应中细胞因子协同释放的重要调节因子[8],激活之后活化下游MAPK激活蛋白激酶2(MK2),MK2通过转录调节和产生促炎细胞因子如肿瘤坏死因子TNF-α、IL-6、IL-8和IL-1来产生炎症分子,抑制p38激酶可以导致这些促炎介质的显著减少和炎症过程的产生[9]。GERD是一种多因素疾病,酸暴露环境通过调节p38 MAPK的活化影响其发生、发展。胃酸和胰蛋白酶等反流物的刺激引起食道黏膜组织中炎症细胞聚集,继而引起IL-8、TNF-α等炎症因子的释放,这些炎症因子通过下调紧密连接蛋白的表达来诱导上皮屏障功能的损伤,这会导致黏膜上皮的炎症反应加重,形成恶性循环[10]。柳刚[11]通过原代培养人食管上皮,给予酸、胰蛋白酶刺激及胃底结扎加幽口限制法诱导形成反流性食管炎模型并运用免疫组化、PCR、Western blotting分析等方法验证了这一观点,在胃食管反流病中p38 MAPK通路在胰蛋白酶和酸的刺激下激活诱发炎症,从而造成食管黏膜上皮的炎性损伤。另有研究报道,抑制p38 MAPK激活,通过调节食管屏障功能和调节炎症细胞的聚集,以及NO和活性氧的形成可以减轻酸性反流性食管炎(reflux esophagitis,RE)大鼠食管黏膜损伤[12]。与没有Barrett食管(Barrett esophagus,BE)的人相比,BE的存在增加了食管腺癌30至120倍的风险,但最近的几项研究表明,即使在没有BE的存在下,长期存在GERD本身就是一种腺癌的风险因子,这种风险与GERD频率、严重程度以及反流症状的持续时间相关[13]。BE是一种癌前病变,长期存在GERD症状,主要由酸和胆盐的反流所致,胆汁酸和盐酸可诱导活性氧和一氧化氮的产生,与DNA损伤和基因突变有关[14-15]。这些机制涉及MAPK途径从细胞表面到细胞核的信号[16]。在有和没有Barrett食管的GERD患者的活检中,发现了酸暴露激活的MAPK通路的差异,这些差异可能是Barrett食管化生发展的基础[17]。本试验中,p38 MAPK蛋白在食管腺癌癌旁组织、胃食管反流病、食管腺癌中阳性表达率逐渐升高,且与GERD患者性别、年龄、是否存在Hp感染均无关,而是随着胃食管反流病的发病过程呈现递增趋势,在RE、BE中差异明显,说明p38 MAPK通路在胃食管反流病的不同类型中表达不同,并可能参与了胃食管反流病及食管腺癌的发病,但由于标本量较少,胃食管反流病组与腺癌组差异不太明显。
目前有关EMT的研究认为上皮细胞的不同程度转化受细胞内信号转导机制的精确调控。细胞外信号转导通过与细胞表面特异性受体相结合将信号转入细胞内,再通过胞内的转化生长因子-β、Wnt、Notch、Hedgehog、磷脂酰肌醇3激酶、NF-κB、MAPK等信号转导途径,活化核内转导因子,调节转导基因表达,在发育、伤口愈合、纤维化和癌症进展中都有着十分重要的作用。有研究表明,EMT在食管炎到食管癌的的纤维化过程中有着十分重要的作用。ROS可以活化NF-κB等转录因子,进而促进蛋白磷酸化及TGF-β表达增加,从而导致食管的纤维化过程[18]。炎症在GERD损伤中的作用已得到国内外学者的广泛认可,从GERD患者的食管可活检出IL-6、IL-8和IL-1β等炎性介质[19]。酸和TLR4配体LPS刺激食管上皮下肌成纤维细胞,可激活NF-κB和辣椒素受体1,并促进IL-6、IL-8等炎症因子分泌,造成食管黏膜炎症性损害以及食管高敏状态,表明上皮-间质的相互作用可能和胃食管反流病发生、发展存在着相关性[20]。在胆汁反流动物模型中观察到炎症细胞、IL-6和肿瘤坏死因子-α的过表达,胆汁可能通过诱导食管炎症反应而促BE的发展[21]。另外,Zhang等[22]用酸性胆汁盐处理Barrett食管细胞时,发现血管内皮生长因子-A(vascular endothelial growth factor-A,VEGF-A)分泌迅速增加,VEGF-A的增加伴随着VEGFR2磷酸化的增加,下游信号通路的激活导致E盒结合锌指蛋白的上调,E-cadherin的下调和细胞迁移的增加。抑制VEGF/VEGFR2信号(通过VEGF阻断抗体,VEGF-A基因缺失,药理性VEGFR2抑制或VEGFR2 shRNA)消除了这些EMT功能。这项研究表明,酸性胆汁盐可以通过激活VEGF/VEGFR2信号传导来诱导食管Barrett细胞的EMT功能,即EMT导致Barrett食道患者发生肠化生。肠型化生黏膜取代胃食管反流酸和胆汁损伤的食管鳞状黏膜,是食管腺癌的主要危险因素。本试验中,从食管腺癌癌旁组织、胃食管反流病至食管腺癌中,E-cadherin呈递减趋势表达,Vimentin呈递增趋势表达,提示E-cadherin、Vimentin可能参与了胃食管反流病及食管腺癌的发病过程。但可能由于标本量较少,导致E-cadherin的表达在胃食管反流病组与癌旁组相比差异不明显,Vimentin的表达在胃食管反流病组与腺癌组相比差异不明显。E-cadherin的表达与性别、年龄、是否存在Hp感染及GERD临床类型均无关。Vimentin的表达与性别、年龄、是否存在Hp感染均无关,在BE、RE中,表达有显著差异。这也许是因为在炎症向肿瘤发展的早期阶段可能会发生间质向上皮的转变,导致早期疾病中波形蛋白阳性表达的趋势较高[23]。
在胃食管反流病中,p38 MAPK能够被胃酸、胰蛋白酶等激活诱导食道黏膜上皮细胞的炎症因子分泌,p38 MAPK失活可以抑制这一反应,并抑制食道黏膜上皮中这些紧密连接功能蛋白的表达下调,紧密连接蛋白的降低通常认为是细胞EMT化的重要前期指针。本实验仅说明在胃食管反流病、食管腺癌的发病过程中,p38 MAPK、EMT都有着十分重要的作用,可能是在酸和胆盐的刺激下p38 MAPK活化后调控下游TNF-α、IL-6等炎症因子,通过其各自的途径促进了EMT[24,25]。可能是p38 MAPK激活了活性氧簇,从而诱发了食管纤维化的EMT导致了胃食管反流病发展的过程,也可能是更多通路的共同作用,这就需要在本试验的基础上加大样本量研究,并结合动物学、细胞学试验来进一步阐明其中的机制。

