细菌长极性菌毛的研究进展
丁雪燕,王思权,庞胜美,常雅洁,朱国强
(1.扬州大学 兽医学院 江苏省动物重要疫病与人兽共患病防控协同创新中心/教育部农业与农产品安全国际合作联合实验室,江苏 扬州 225009)
为了适应环境,细菌已经演化出不同的生存策略。细菌启动感染模式通常开始于细菌附着到宿主易感细胞的表面,而菌毛在这一初始过程中发挥关键的作用。菌毛存在于许多革兰阴性细菌和一些革兰阳性细菌的表面,其对于细菌的毒力和致病性至关重要。无论是致病性还是非致病性菌株都具有多种负责不同菌毛生物合成、组装和分泌机制的菌毛基因簇。菌毛是导致很多疾病的重要毒力因子,特别是泌尿、生殖和胃肠道感染性疾病,因此菌毛也被认为是疫苗开发的重要靶标。
长极性菌毛(long polar fimbriae,LPF)最初在鼠伤寒沙门菌(Salmonellatyphimurium,S.typhimurium)中作为一种潜在的黏附素被报道,并且与细菌的肠道定植有关,可在促进S.typhimurium黏附并侵袭宿主派氏结M细胞的同时引起IL-8的大量分泌[1-2]。TORRES等[3]曾通过Western blot试验确定了大肠杆菌O157:H7菌株中LPF的表达,并用透射电镜观察到其形态。LPF属于一种最常见的CU (chaperone/usher)菌毛类型,与经典Ⅰ型菌毛的fim操纵子结构相似,根据编码菌毛基因簇组成的不同,将LPF分为LPF1和LPF2等2种类型。LPF1操纵子由lpfABCDE组成,LPF2操纵子则由lpfABCD编码(部分菌株还携带重复的lpfD′)。与lpf2操纵子相比,lpf1操纵子多了一个编码菌毛次要亚单位的基因lpfE[1,4]。事实上,在LPF被发现的若干年间,其介导的分子致病机制在很多细菌中得到了不断的挖掘和探索。
本实验室前期开展了对细菌菌毛的研究,近来集中关注了LPF分布的广泛性和功能的多样性。现综述当前有关LPF的研究进展,旨在为控制与LPF相关的细菌性疾病提供参考。
1 LPF的发现和分布
LPF最初是在S.typhimurium中被发现,研究中通过Southern blot杂交技术在S.typhimurium染色体78 min处鉴定出一个7 065 bp的区域。克隆和序列分析表明该区域编码了一个新的菌毛操纵子。当将该菌毛操纵子导入到非菌毛大肠杆菌ORN172中时,通过电镜观察到一种分布在细菌两极的直径为7~8 nm、长度为2~10 μm的长菌毛。因此,将编码该菌毛的操纵子称为lpf。极性分布表明,LPF不同于先前描述的Ⅰ型、Ⅲ型和GVVPQ菌毛,因为这些菌毛都是在细菌表面周身存在的(图1)。事实上,LPF在长度、宽度和极性分布等形态上与肠杆菌科其他成员的Ⅳ型菌毛相似[1,5]。然而,对LPF蛋白一级结构分析比较表明,lpf操纵子与编码S.typhimuriumⅠ型菌毛的fim操纵子的亲缘关系比与编码Ⅳ型菌毛的操纵子的亲缘关系更加密切,而且fim操纵子和lpf操纵子具有相同的基因排列顺序(图2)[6]。后来在其他许多菌株中也发现了lpf基因或其类似物,如肠出血性大肠杆菌(enterohemorrhagicEscherichiacoli,EHEC)、黏附侵袭性大肠杆菌(adherent and invasiveEscherichiacoli,AIEC)、肠致病性大肠杆菌(enteropathogenicEscherichiacoli,EPEC)、产志贺毒素大肠杆菌(Shiga toxin-producingEscherichiacoli,STEC)、产肠毒素大肠杆菌(enterotoxigenicEscherichiacoli,ETEC)、禽致病性大肠杆菌(avian pathogenicEscherichiacoli,APEC)、致乳房炎大肠杆菌(mammary pathogenicEscherichiacoli,MPEC)、肠凝集性大肠杆菌(enteroaggregativeEscherichiacoli,EAEC)和多种大肠杆菌标准及参考菌株等[7-11]。根据操纵子的基因组成将LPF大致分为2类:LPF1和LPF2,在大多数菌株中只含有其中1种,但在少数菌株中则同时含有2种LPF(如EHEC O157:H7、EHEC O104:H4和兔特异性EPEC等)[4,12]。LPF分布的广泛性提示其可能作为许多细菌中一个必要的辅助附属结构,但其在其他更多菌株(尤其是对人和动物具有致病性的菌株)中的存在情况还有待进一步的鉴定和调查。
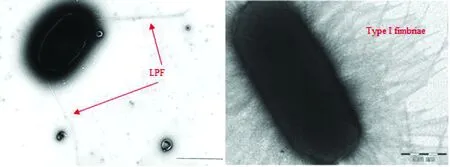
图1 细菌的LPF和Ⅰ型菌毛在显微镜下的形态比较[1,13]

图2 fim操纵子和lpf操纵子基因排列顺序
2 LPF操纵子组成和各亚基的功能
菌毛一般是由一组基因簇编码,在细菌中也称为菌毛操纵子,负责菌毛亚基的生物发生、组装和分泌机制。LPF1的操纵子lpf1由5或6个基因(lpfA,B,C,D和E,在某些菌株中存在重复的C')组成,而LPF2的操纵子lpf2则具有4或5个基因(lpfA,B,C,D,部分菌株中存在重复的D')(图3)。
通过序列比较,在一些菌株中已经预测了lpf基因簇中每个基因所编码蛋白质的功能。一般来说,LpfA是LPF的主要结构亚基,LpfB是伴侣蛋白,LpfC (LpfC')是外膜推进蛋白,LpfB和LpfC聚集在一起负责菌毛多肽链的有效聚合和跨膜运输,LpfD (LpfD')是次要菌毛亚基,而LpfE可能是调节因子或次要亚基[14]。但LPF亚基的功能在不同研究中被描述的并不完全相同,因而我们要根据研究对象对其进行具体研究和识别。事实上,在一个菌毛操纵子中,并不是所有的亚基都在致病过程中发挥主要功能。例如:在K88菌毛中,FaeG亚基作为主要亚单位专门负责与宿主细胞上的受体结合,以促进K88+ETEC对猪小肠黏膜的黏附和定植,从而引起新生和断奶仔猪发生腹泻[15]。而在Sfm菌毛中,SfmH作为尖端黏附素对Sfm菌毛发挥功能起着决定性的作用[16]。因此,通过研究LPF菌毛蛋白结构亚单位和基因序列将有助于研发新型基因工程疫苗,阻断宿主细胞上的菌毛受体,从而阻止细菌的黏附,有利于 LPF介导的细菌性疾病的预防和控制。
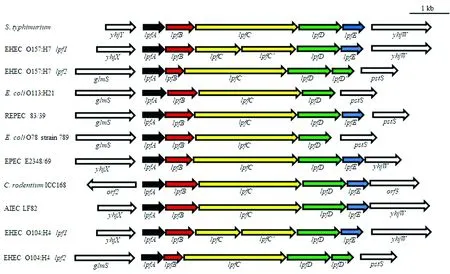
图3 一些代表性菌株中lpf基因簇的结构和组成模式图
3 影响LPF表达的因素
LPF的表达受到多种因素的严格调控,如相变(phase variation)机制、LEE编码的调节因子(locus of enterocyte effacement-encoded regulator,Ler)和组蛋白样类核结构蛋白(histone-like nucleoid-structuring protein,H-NS)调节机制、细菌本身的因素(如生长阶段)或各种环境因素(如温度、pH、渗透压、铁和胆盐含量等)均可影响LPF的表达。
3.1 相变机制细菌通常可以通过2种机制来改变其表面的抗原特性,包括抗原变异和相变,通过相变能够使细菌可逆性地获取或丢失抗原。例如,相变可以调节包括LPF、Ⅰ型菌毛在内的多种不同菌毛抗原的表达。LPF的合成由一个处于开(ON)/关(OFF)状态的“相变开关”(phase-variable genetic switch)控制,该开关调节LPF在不同组织和器官中的表达。lpf操纵子在Phase ON和Phase OFF表达状态之间变化,导致LPF抗原表达的群体异质性[17-18]。NICHOLSON等[19]报道,受相变控制的LPF表达同时也为细菌提供了逃避不同血清型之间交叉免疫的手段,这直接支持了LPF的相变是S.typhimurium和肠炎沙门菌之间逃避交叉免疫的机制这一假说,从而使它们能够在宿主群中共存。迄今为止,LPF的相变在沙门菌中已有很好的研究基础,如早期对S.typhimurium的研究发现LpfA蛋白与宿主细胞的互作是调节LPF操纵子表达ON/OFF机制的关键[20]。但在其他细菌特别是致病菌中LPF的相变及其调控机制仍有待进一步探索。
3.2 Ler和H-NS调节机制以EHEC O157:H7的LPF1为例,H-NS结合到lpf1操纵子调控序列上沉默其转录,而Ler则充当抗沉默剂来抑制H-NS的功能并正向调节LPF1的表达[21]。H-NS是一种调节沉默蛋白,在结合DNA中起同型二聚体的作用,对弯曲双链DNA表现出偏好。通过优先与内在弯曲的DNA相互作用,H-NS已被用作多种基因的转录阻遏物,特别是那些在细菌代谢和致病机理中负责环境适应性和毒力的基因[22-23]。H-NS有3个假定的结合位点,其中2个结合位点,分别称为沉默调控序列1 (silencer regulatory sequence 1,SRS1)和沉默调控序列2(silencer regulatory sequence 2,SRS2),位于一个覆盖了2个lpf1启动子(P1和P2)的区域。第3个假定的H-NS结合位点位于ATG下游lpfA1基因区域内,但似乎该位点在lpfA1调节中不起作用。H-NS通过结合启动子区域上的2个SRSs来沉默lpf1的表达,从而形成SRS-H-NS复合物以阻断聚合酶介导的RNA转录(图4)[21]。同时,Ler与Ler结合位点(Ler binding site,LBS)相互作用,LBS1和LBS2位于P1和P2启动子的上游,LBS1与SRS1重叠,而LBS3与P1启动子和SRS2重叠。在引发宿主细胞黏附及擦拭性损伤(A/E表型)的细菌中,Ler不仅是关键性因子,而且还作为除LEE以外的其他致病因子的正调控因子[24]。目前,Ler和H-NS作为转录调控因子的功能已经得到了很好的证实,而其他生物活性分子是否与lpf操纵子的调控机制有关有待进一步的探索。

图4 H-NS和Ler调控的大肠杆菌O157:H7 lpfA1操纵子模型
3.3 其他可能影响LPF表达的因素除了上述调节因素,细菌本身的一些因素(如生长阶段)或各种环境因素(如温度、pH、渗透压、铁和胆盐含量等),也可能影响LPF的表达。TORRES等[25-26]报道,lpf1和lpf2操纵子的表达响应于不同的生长阶段和环境条件;在EHEC O157:H7中,lpf1的表达似乎受到生长时期、渗透压和pH的影响,其最大量表达出现在pH6.5和37℃的指数生长后期。而lpf2操纵子则受到温度、pH、胆盐和铁的调节,并受到铁摄取调节蛋白(ferric-uptake-regulator,Fur)的控制,其表达在指数生长后期和铁耗竭期间被显著诱导。ARENAS-HERNANDEZ等[27]发现,pH值变化、胆盐存在和铁利用率的降低是在人类近端小肠中LPF2表达的重要环境因素。当EHEC到达远端小肠时,铁的可用性导致Fur结合到lpf2启动子区域并抑制菌毛的表达。在该研究中建立的模型支持了在肠道定植过程中控制EHEC中LPF表达的分级环境信号的存在。另外,CHASSAING等[28]分析了胃肠道生长条件尤其是各种胆盐对AIEC菌株中lpf操纵子表达的影响,发现胆盐的存在大大提高了AIEC LF82菌株lpf操纵子的表达,并且FhlA转录因子是在胆盐存在时lpf表达的关键细菌调节因子。因此,通过改变环境条件或细菌生长所需的各项营养指标来控制LPF的表达非常值得关注。同时也注意到在不同的细菌背景中LPF可能会对不同的条件做出反应或由不同的调节剂进行控制。
4 LPF的生物学功能
随着对各种细菌中LPF的研究不断探索,LPF的功能也不断地被发现。现有证据表明,LPF在不同细菌中可能具有不同的功能,即使是在同一菌株中LPF的功能也是多方面的。
4.1 LPF促进细菌的黏附和定植大量的试验数据表明,LPF能够促进细菌对靶细胞和组织的黏附和定植。大肠杆菌O157:H7中lpf1操纵子的突变导致黏附在HeLa细胞上的细菌数量减少并降低微集落的形成[3]。类似地,O157:H7lpf2突变体对Caco-2细胞的黏附性有所降低,并且lpf2可能在早期黏附性中起关键作用[4]。JORDAN等[29]研究表明,LPF1和LPF2的突变降低了大肠杆菌O157:H7在绵羊和猪中的定植能力,其引起A/E损伤程度也有所减轻。另据报道,O157:H7菌株与lpf1和lpf2双突变株的竞争试验表明突变株在受试家兔肠组织中的竞争优势明显,证实了LPF对细菌肠道定植的促进作用[30]。与O157:H7相似,EHEC O113:H21菌株在敲除lpfA基因后丧失了对上皮细胞的黏附能力,提示LPF2在非O157分离株中也具有黏附素的作用[31]。另外,在APEC中,LPF2菌毛有助于非菌毛大肠杆菌K-12株在体外对禽肺组织和人上皮细胞的黏附作用,LPF2突变体在鸡气囊、肺和气管中的定植也减少[32]。此外,ROSS等[33]在STEC O104:H4体内外模型中探究发现,ΔlpfA1突变体在非极化和极化肠上皮细胞上的黏附性降低,并减少了在小鼠大肠中的定植,这证实LPF1是导致O104:H4黏附和定植的致病因素之一。
那么LPF介导细菌黏附的机制如何?在S.typhimurium感染期间,LPF介导该细菌附着于宿主派氏结的M细胞[18]。FARFAN等[34]观察到EHEC原型菌株和其他O157:H7临床分离株能够与肠道中最常见的细胞外基质(extracellular matrix,ECM)蛋白结合,这表明LPF是由ECM蛋白识别的,而且两者的相互作用有助于EHEC对肠道细胞的黏附和在胃肠道内的定植。CORDONNIER等[35]还发现,LPF是EHEC O157:H7跨越人M细胞单层主动移位所必需的。与此一致的是:AIEC通过LPF1靶向小鼠和人类派氏结并在M细胞之间转移[36]。此外,作为O157:H7中的同源菌毛,携带LPF1的细菌被证实通过靶向位于回肠远端派氏结上的滤泡相关上皮细胞(follicle-associated epithelium,FAE)感染人类肠道[37-38]。然而,与Ⅰ型菌毛不同,LPF对细胞内的D-甘露糖受体并不敏感[39]。因此对LPF细胞受体的进一步识别将有助于阐明LPF介导的细菌-宿主相互作用。
4.2 LPF参与细菌生物被膜的形成在自然界中,细菌附着于有生命或无生命物体表面(如玻璃、塑料或真核细胞)被胞外大分子包裹后,可以形成复杂的三维生物被膜,从而使细菌对抗生素和宿主的免疫防御机制更具抵抗力。研究表明,LPF参与了几个与生物被膜相关的过程,包括附着于底物、细胞间黏附和ECM的生物合成[40]。LEDEBOER等[41]研究发现,lpf突变体完全丧失了在鸡肠道组织上形成生物被膜的能力,同时在组织培养细胞和塑料表面上形成生物被膜的能力也发生中等程度的丧失,从而证明LPF参与了S.typhimurium在HEp-2组织细胞和鸡肠上皮细胞表面形成生物被膜的过程。ROSS等[33]研究测试了大肠杆菌O104:H4菌株中lpf操纵子突变体形成生物被膜的能力,发现lpfA1基因缺失株并不能形成稳定的生物被膜。近年来耐药菌株逐渐增多,其中一个重要的影响因素就是生物被膜的形成,这给细菌性疾病的预防和治疗工作提出了挑战。因此,如果能够从生物被膜的角度阐明细菌形成耐药性的详细机理,将有助于新抗菌药物的开发和细菌性疾病的控制。
4.3 LPF影响细菌的组织嗜性细菌对宿主的不同组织具有不同的嗜性,其中细菌的多种毒力因子参与了此生物学过程。LPF作为细菌中存在的一种重要的毒力因子,也对细菌的组织嗜性产生一定的影响。FITZHENRY等[37]发现,大肠杆菌O157:H7 中LPF菌毛突变导致了O157:H7对近端和远端小肠的定植并形成A/E损伤的新表型。LPF菌毛基因是在LEE区域外发现的第一个影响O157:H7人类肠道组织嗜性的基因。另外,与克罗恩病(Crohn's disease,CD)相关的71%的AIEC中存在LPF,提示LPF在AIEC的组织嗜性和毒力中起一定的作用[42-43]。由此可见,可能正是由于LPF对细菌组织嗜性的影响,从而导致其对细菌毒力造成了广泛影响。
4.4 LPF参与诱导宿主炎症反应VERGARA等[44]通过用EHEC O157菌株感染极化的T84细胞发现LPF1和LPF2都是重要的细菌毒力因子,参与EHEC感染相关的炎症反应,并可以诱导IL-8的分泌和多形核中性粒细胞(polymorphonuclear neutrophils,PMNs)通过肠道单层细胞进行的迁移。作为一种重要的促炎标志物,肠道细胞高表达和分泌IL-8提示了EHEC发生感染的过程。另外,FARFAN等[45]在用STEC野生株和lpf等基因突变株感染肠道T84细胞后检测了27种细胞因子,发现被lpfA1、lpfA2双突变株感染的细胞分泌IL-8以及产生其他炎症标志物的能力显著降低。因此,与LPS、鞭毛蛋白和HCP一样,LPF不再只是一种简单的黏附素,而是一种影响宿主炎症反应的必要细菌毒力。经典的LPS-TLR4和鞭毛蛋白-TLR5通路已经得到了很好的证实。HCP属于细菌Ⅳ型菌毛家族,通过调节EHEC中的NF-κB和AP-1途径,促进IL-8和TNF-α的分泌[46]。然而,LPF介导的促炎反应可能与NF-κB信号通路有关,因为肠道T84细胞中的NF-κB信号通路在表达LPF的STEC作用后被激活,这支持了LPF作为STEC因子介导肠道炎症的作用[45]。此外,由于LPF在EHEC诱导的PMNs迁移中起着重要作用,所以LPF介导的炎症反应可能参与了PMNs在乳腺内的募集和迁移,从而导致MPEC乳腺内感染时体细胞计数(somatic cell count,SCC)升高[47]。
综上,LPF与细菌的黏附、侵袭、生物被膜形成、组织嗜性、宿主免疫等生物学过程有关,在肠细胞脱落位点 (locus of enterocyte effacement,LEE) 毒力岛阴性的STEC菌株中还参与了严重腹泻的发生,这些都提示LPF具有重要的科研和临床意义。同时,沙门菌的LPF也被认为是优化沙门菌与宿主互作和新流行菌株出现的驱动因素[48]。然而LPF2不会影响EHEC O157:H7 86-24菌株对羔羊肠道外植体的黏附能力[25],这种现象可以用该菌株中具有2个lpf操纵子的事实来解释,即其中一个lpf的突变可以被另外一个lpf操纵子所代偿[49]。此外,TATSUNO等[50]发现,EPEC E2348/69菌株lpf基因簇对于感染过程中EPEC的黏附和A/E病变的形成不是必需的,C.rodentiumICC168菌株lpf基因簇也被报道在C3H/HeJ或C57BL/6小鼠感染模型中并不参与C.rodentium的毒力。由此可见,对LPF的生物学功能研究不能一概而论。因此,进一步挖掘更多菌株中LPF的功能将会有助于我们进一步全面地理解和掌握细菌的致病机理,从而更好地预防和控制细菌性疾病的发生。
5 总结和展望
细菌引起感染的首要一步,也是最关键的步骤就是与宿主细胞表面特定的大分子受体结合,从而启动细菌的黏附和定植,该过程通常由暴露于细菌表面的黏附素介导。因此,菌毛黏附素被认为是疫苗开发的重要目标。自从LPF在S.typhimurium中被鉴定以来,在许多其他菌株中均发现了LPF,并且其各种功能正在被挖掘。LPF不仅作为黏附分子介导细菌和宿主间的黏附和定植,而且还参与细菌的生物被膜形成和感染组织嗜性。也发现LPF还能增强细菌对宿主细胞的定植和持久性存在并介导宿主炎症反应。尤其在流行株EHEC O157:H7 中对其LPF进行了较为深入的探索研究,这可能为O157:H7引起疾病的预防和治疗提供较好启示。
另外,鉴于LPF的免疫原性,其在新型诊断技术的建立和基因工程疫苗的研发方面或许具有广阔的应用前景。虽然近年来有关LPF的研究不断深入,但仍然存在很多未知的领域。从分子水平上研究LPF与易感宿主细胞表面特异性受体结合、相互作用的精确机制将有助于开辟出阻断细菌感染的高效途径。同时,阐明LPF与细菌中其他毒力因子之间的协同作用或相互影响也是非常重要的。因为抵抗细菌感染的免疫保护作用通常需要多种抗原的协同参与,单一抗原一般不能对宿主提供足够的保护。而且使用联合抗原还可以达到广谱的效果,还可能会增强免疫原性和交叉保护作用。然而,LPF的致病机制和免疫机理还需要进一步的揭示和阐明,从而实现更好的应用效果。

