Fluspirilene下调Akt抗肝癌的分子机制研究
石西南,张荣平,解宇环,孟卓然,吴施国,陈 嵘,万伟萍,张 珊,陈 伟,王 健
(1. 云南中医药大学基础医学院病理学教研室, 昆明 650500;2. 黔西南民族职业技术学院医药系, 兴义 562400;3. 云南中医药大学中药学院南药研究院, 4.云南省高校芳香中药研究重点实验室;5. 云南省中医治未病理论应用研究创新团队,6. 云南中医药大学基础医学院方剂学教研室,7. 云南中医药大学基础医学院生理学教研室, 昆明 650500;8.昆明市中医医院肛肠科,昆明 650032;9. 云南中医药大学第一附属医院神经内科, 昆明 650000)
肝癌(hepatic cell carcinoma,HCC)是常见且晚期的慢性肝脏疾病,其死亡率占全世界疾病死亡率的9.1%,在癌症发病率排第5位[1]。其疾病形成高风险因子多与乙/丙型肝炎病毒感染[2]、肝毒性化合物、酒精及非酒精性脂肪肝等有关[3]。
细胞周期紊乱(abnormal cell cycle)是恶性肿瘤形成的一个主要特征。细胞周期蛋白依赖性激酶( cyclin-dependent kinases,CDKs) 的激活与失活维持着细胞周期各时相有序进行[4]。CDK2 与Cyclin E形成细胞周期激酶复合体可磷酸化激活Rb,形成G1过渡到S期的关键步骤[5-6]。抑制CDK2可以抑制肿瘤细胞的增生,为一个很好的肿瘤药物靶点[7]。
我们前期通过体内外分子生物学实验发现小分子化合物Fluspirilene通过下调了CDK2的表达,阻滞了细胞周期G1期,抑制肝癌细胞增殖[8-12]。但是Fluspirilene抗肝癌具体分子通路机制不明。
CDK4/6-cyclin D 和 CDK2-cyclin E两种细胞周期激酶复合体可解除对含有视网膜母细胞瘤蛋白 (Rb) 和 E2F 的动态转录复合体的抑制作用,从而启动细胞周期G1期到S期的顺利转换。在生长因子的作用下,Akt 可以磷酸化 FoxO1/3,并活化FoxO1/3出核功能,实现细胞存活和增殖。大量不同的刺激如TGF-β、DNA 损伤、复制性衰老等可通过转录因子作用诱导周期依赖性激酶抑制剂 (cyclin-dependent kinas inhibitors,CKIs) 的 Kip/Cip 家族成员p21、p27等水平上调从而抑制周期依赖性激酶CDK2/4/6的活性达到抑制细胞增殖的作用。前期实验验证了Fluspirilene下调了CDK2水平[12],抑制肝癌细胞增殖作用,具体分子机制不明。本实验通过mRNA转录组筛查:Fluspirilene干预了肝癌细胞的基因差异表达,进一步分子功能实验验证:Fluspirilene通过调控Akt激酶活性,下调磷酸化CDK2蛋白水平,干预细胞周期G1期,达到抗肝癌作用。
1 材料与方法
1.1 实验材料Fluspirilene(Lot#103M4604V, Sigma)购自于美国Sigma公司。肝癌细胞系 HepG2和Huh7 购自于中国科学典型培养物保藏委员会细胞库。胎牛血清购自于Invitrogen, Rockville, Maryland, USA。Akt、GAPDH抗体购自于Cell Signaling Technology, Inc., Danvers, Massachusetts, USA。细胞用含10%胎牛血清的 RPMI 1640 培养基在温度37 ℃、5% CO2及 95%湿度的培养箱中培养[13]。
1.2 仪器CO2细胞培养箱(S111)(Thermo, 美国); Min-PROTEAN Western blot电泳仪器(美国Bio-Rad);凝胶成像系统SYSTEM GelDoc XR+IMAGELAB(美国Bio-Rad)。
1.3 方法
1.3.1mRNA转录组筛查(mRNA array) 将处于对数生长的HepG2细胞进行消化、计数,加入六孔板中,每孔加入2 mL培养基,加入2×105个细胞悬液,孵育至细胞长满到每孔70%-80%,加入Fluspirilene 15 μmol·L-1,4 h后进行细胞收集,加入适量TRIzol裂解液反复吹打混匀至形成清亮的透明液体,转移到无酶管中干冰保存,送检。实验重复3次。
1.3.2BALB/C裸鼠移植瘤动物实验 购买BALB/C裸鼠50只,4-5周,♂,体质量(17±2)g(Vital River Laboratory Technology Co. Ltd, Peking, China)动物生产许可证号为:SCXK(京)2012-0001,遵照昆明医科大学动物实验室伦理委员会制定的原则在特殊无菌的条件下进行喂养。成瘤时,先用含5×109/L肝癌细胞Huh7的PBS 注射到裸鼠右侧腋窝皮下(同样的实验重复3次),1周后当瘤块长到80-100 mm3, 裸鼠随机的分组(每组5只),用含有不同浓度Fluspirilene (8、15 mg·kg-1)或5-Flurouracil(5-Flurouracil,5-FU,)(Sigma) 10 mg·kg-1[14]的0.5% CMC-NaCl进行口服灌胃21 d后,裸鼠断颈处死。肿瘤体积用公式V= ab2/2进行计算(a=最长直径,b=最短直径)。实验重复3次。
1.3.3免疫组化(immunohistochemistry,IHC) 室温二甲苯对样本脱蜡、水化切片、热抗原修复、封闭非特异性位点后,滴加一抗盖住组织,然后放入湿盒内4 ℃过夜。d 2,室温复温、PBS及蒸馏水冲洗后,加二抗,室温孵育10 min后,PBS及蒸馏水冲洗。滴加链霉菌抗生物素-过氧化物酶溶液,室温孵育10 min,PBS及蒸馏水再冲洗。冲洗后每张切片快速滴加两滴或者100 μL DAB溶液,染色合适即可终止染色,自来水冲洗。苏木素复染,细胞核变蓝色即可终止,自来水或者PBS冲洗还蓝。1%盐酸酒精分化后,自来水冲洗,脱水、凉干后滴加适量中性树胶封片,盖上盖玻片、晾干。显微镜下拍照即可。实验重复3次。
1.3.4Western blot实验 HepG2细胞在六孔板内用含10% FBS的 RPMI 1640 培养到每孔细胞长满90%以后,倒掉培养基,加入含 Fluspirilene的10% FBS的 新鲜RPMI 1640培养基,6 h后收集细胞,用含 1 mmol·L-1PMSF及蛋白酶抑制剂的RIPA buffer进行蛋白裂解后,把收集的样本放在 4 ℃, 13 000 r·min-1,离心15 min,收集上清,用 BCA Protein Assay Kit (Thermo)进行蛋白浓度检测。把测定浓度的蛋白样本按不同目的浓度加入到 10% SDS-PAGE电泳液中进行目的蛋白电泳,转膜、封闭,加一抗、加二抗。用ECL蛋白印迹底物(Pierce,Thermo,USA)化学发光法显影拍照即可。实验重复3次。
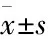
2 结果
2.1 mRNA转录筛查Fluspirilene处理肝癌细胞的基因差异表达我们前期试验结果验证了小分子化合物Fluspirilene具有强烈抗肝癌作用,但是具体分子机制不明。本实验通过mRNA转录组筛查试图寻找Fluspirilene处理肝癌细胞的差异基因表达,结果如Tab 1所示,Fluspirilene对Akt基因表达量呈现3.07倍差异。Fig 1A红色箭头所示,Fluspirilene处理肝癌细胞HepG2后,差异基因分类显示Fluspirilene对细胞增殖分化过程影响明显。Fig 1B转录组热图显示,Fluspirilene对Akt基因表达量呈现明显差异;Akt蛋白表达水平呈现明显低表达(Fig 1C)。

Tab 1 Quantity of gene expression on Fluspirilene treatment HCC cells

Fig 1 Effect of Fluspirilene treatment on HCC cells
2.2 Fluspirilene对BALB/C移植瘤裸鼠治疗效果为了观察Fluspirilene对动物体内瘤体的抑制作用,通过对 BALB/C裸鼠皮下注射肝癌细胞Huh7成瘤实验后,进行随机分组(每组6只),通过口服灌胃21 d含不同剂量Fluspirilene (8、15 mg·kg-1)的0.5% CMC-NaCl。同时比较了5-Fu (10 mg·kg-1)对BALB/C裸鼠移植瘤的治疗效果。我们的结果如Fig 2所示,当治疗21 d后,与对照组相比,Fluspirilene治疗组强烈的抑制了肿瘤的生长,且肿瘤瘤体重量及体积呈现浓度依赖性抑制作用。且与临床常用抗肝癌药物5-Fu呈现相同的抑制肿瘤的效果。

Fig 2 Effect of Fluspirilene treatment on HCC
2.3 Fluspirilene对肿瘤组织蛋白水平的影响Fig 2实验表明Fluspirilene处理肝癌移植瘤小鼠后肿瘤体积及重量呈现明显浓度依懒性抑制趋势。进一步瘤体组织免疫组化检测如Fig 3所示: Fluspirilene处理肝癌移植瘤小鼠后,与对照组织相比,Fluspirilene处理组磷酸化-Akt(phosphorylate-Akt,p-Akt)呈现浓度依赖性低表达(Fig 3A)。
2.4 Fluspirilene对肝癌细胞蛋白水平的影响Fig 4A、B所示,Fluspirilene处理肝癌细胞HepG2和Huh7后,与对照组相比,Fluspirilene处理组Akt、磷

Fig 3 Effect of protein expression of cancer tissues on HCC xenograft BALB/C nude n=3)

Fig 4 Effect of protein expression on Fluspirilene treatment HCC n=3)

Fig 5 Mechanism of Fluspirilene suppressing HCC
酸化CDK2 (phosphorylate-CDK2,p-CDK2)及磷酸化Rb(phosphorylate-Rb,p-Rb)呈明显浓度依赖性下降趋势。
3 讨论
细胞周期紊乱是恶性肿瘤的特征之一。CDKs作为细胞周期检测点的重要调控因子,对细胞周期各时相有序进行起着重要调控作用。CDK2 与CyclinE形成细胞周期激酶复合物可磷酸化激活Rb,为G1期转换到S 期的起着关键调控作用[4-6]。因此抑制CDK2活性可以抑制肿瘤细胞恶性增殖[7]。
Akt激酶是一种重要的蛋白激酶,在生理和病理方面都能够通过磷酸化下游底物蛋白和转录因子来影响细胞生长、细胞迁移、肿瘤发生等许多重要的生理功能。Akt激酶属于AGC激酶家族,它由3个保守结构域构成,分别是:N端的PH结构域、中央激酶催化亚基结构域和1个含有调节疏水基序的C-末端。Akt激酶是细胞内重要的调控蛋白,Akt的活性与其自身的磷化、去磷酸化密切相关。当细胞分裂素、细胞因子等刺激时,Akt与PI3K结合并被招募到细胞膜上,然后被蛋白激酶1(PDK1)和mTORC2激活Akt磷酸化位点。激活的Akt进一步磷酸化其下游的底物,进而发挥不同的生物学功能。PI3K / Akt / mTOR 信号通路对肝脏恶性肿瘤细胞的增殖、迁移、存活和肿瘤的形成起到重要调控作用[15]。高表达Akt、mTOR与肝癌患者预后呈现直接相关[16]。活化后的Akt参与细胞周期、肿瘤细胞生存等细胞重要进程[17-18]。
本团队前期实验结果发现Fluspirilene下调了CDK2蛋白表达水平,阻滞了细胞周期G1期,从而抗肝癌细胞增殖作用[12],但是其具体分子机制不明。为了探索小分子化合物Fluspirilene与活化后的Akt激酶调控肿瘤细胞周期G1期影响肿瘤的发生发展的关系,本实验进行了如下研究。首先通过mRNA转录组筛查发现:Fluspirilene处理肝癌细胞后Akt基因呈现3.07倍差异表达,进一步蛋白实验验证了其差异表达(Fig 1)。据此,本实验推测Fluspirilene有可能通过抑制了CDK2的上游通路Akt激酶的活性,从而降低了CDK2的活性,阻滞了细胞周期G1期抗肝癌作用。为了验证本假设,本团队进一步进行了动物实验,结果表明:与对照组相比,Fluspirilene治疗组强烈的抑制了肿瘤的生长,且肿瘤瘤体重量及体积呈现浓度依赖性抑制作用(Fig 2)。为了验证Fluspirilene抗肝癌是通过抑制了Akt激酶活性抗肝癌的假设,接下来对动物瘤体组织进行免疫组化检测,结果表明:p-Akt蛋白呈现浓度依赖性低表达(Fig 3)。又为了验证Fluspirilene通过抑制了CDK2上游通路Akt激酶的活性,而下调了CDK2的活性达到阻滞细胞周期G1的假设,进一步通过Western blot实验处理肝癌细胞,检测结果表明:Fluspirilene治疗组Akt、p-CDK2、p-Rb蛋白表达水平呈现明显浓度依赖性下降(Fig 4)。
本实验通过体内外分子生物功能实验验证了Fluspirilene抗肝癌的作用,并推测小分子化合物Fluspirilene可能通过下调Akt活性,干预下游CDK2/Rb细胞周期信号分子通路, 阻滞细胞周期G1期,从而抑制肝癌细胞增殖作用(Fig 5)。通过mRNA转录组筛查热图(Fig 1)显示Fluspirilene处理肝癌细胞后同时有几个基因都有差异表达,我们推测Fluspirilene抗肝癌作用可能通过一个复杂的分子信号调控网络而实现的,这部分的假设将是本团队接下来将要深入探讨的内容。

